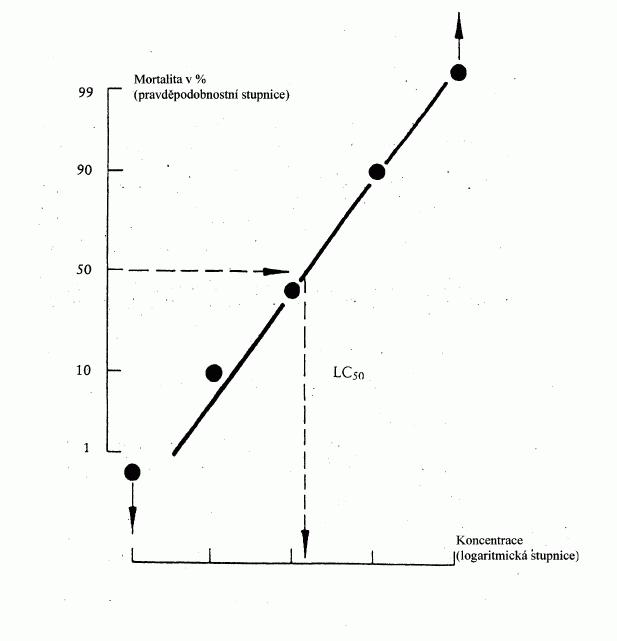
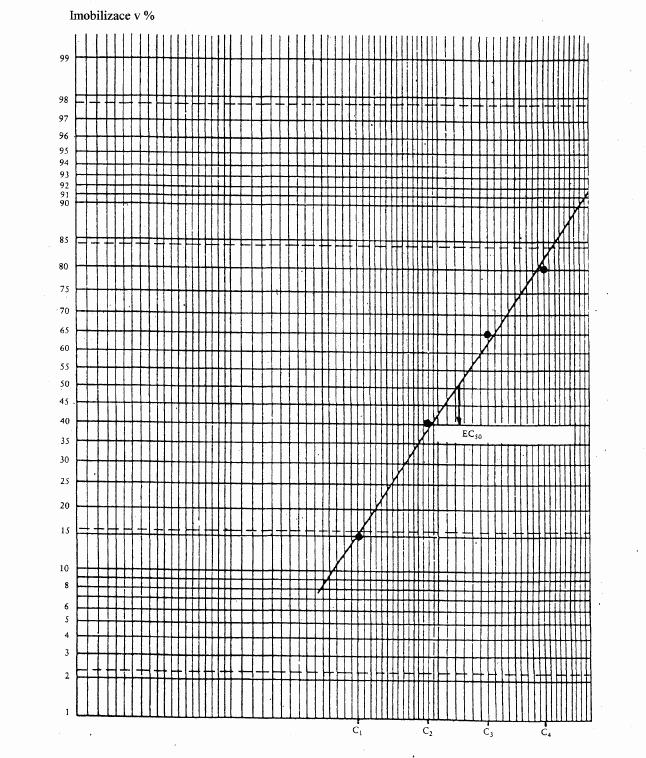
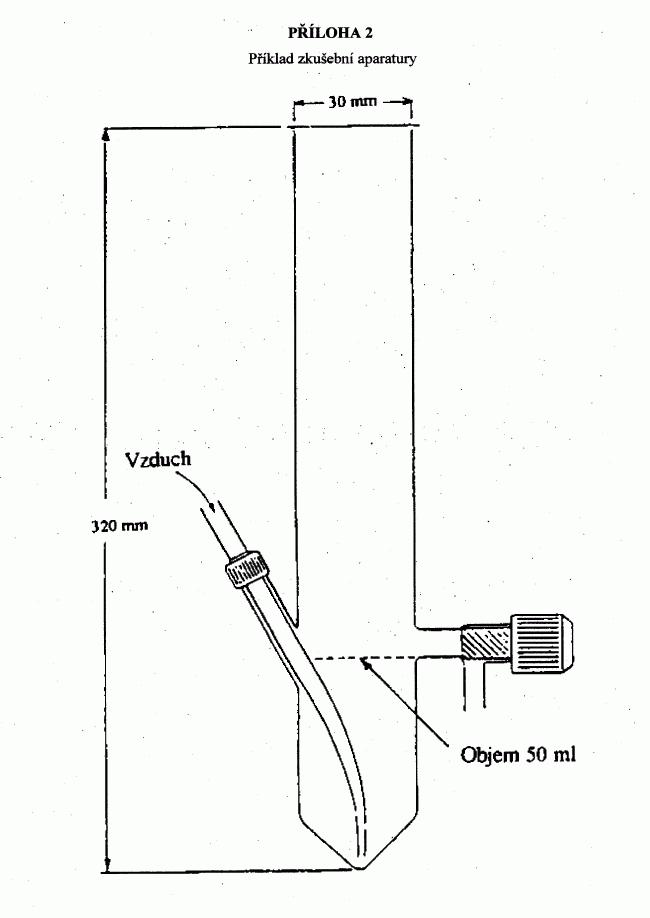
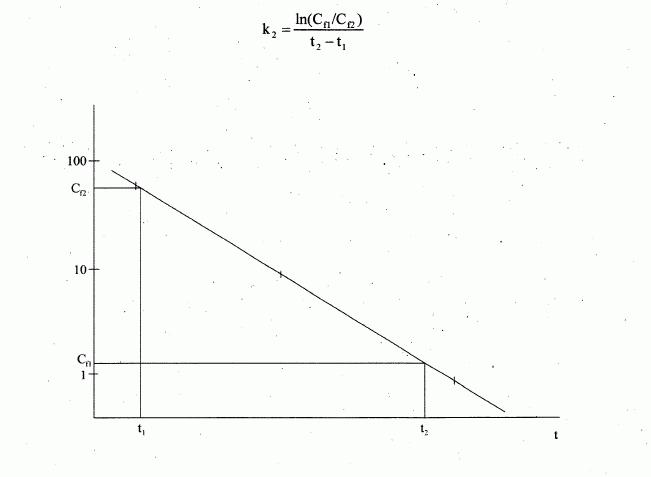
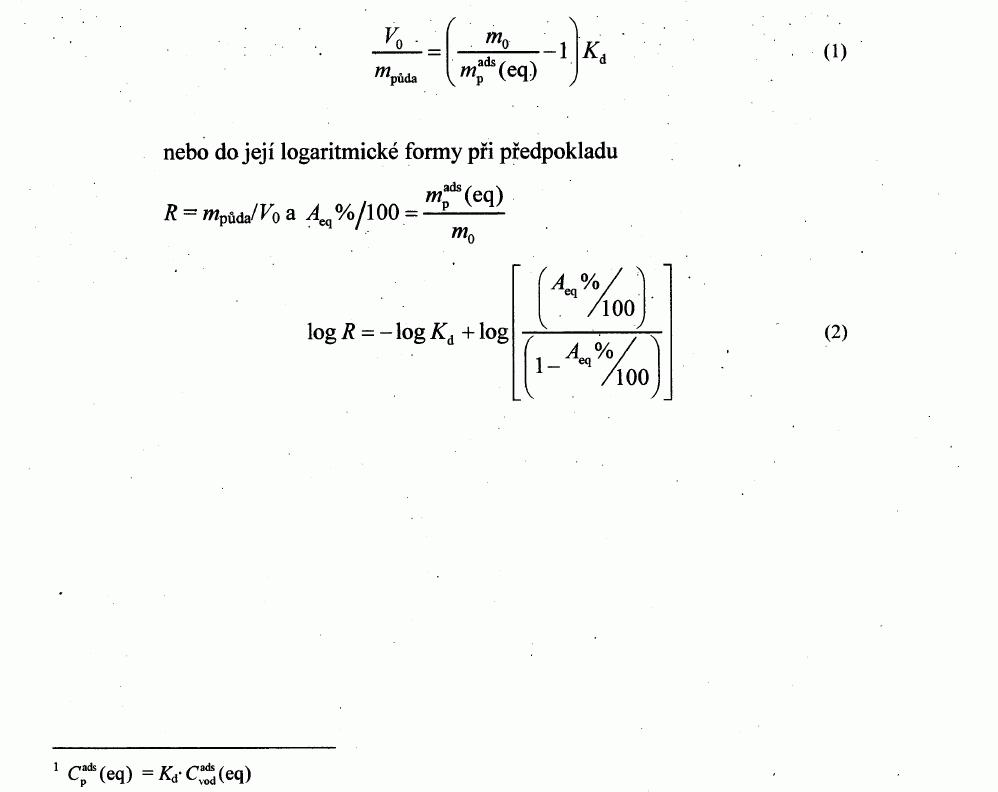
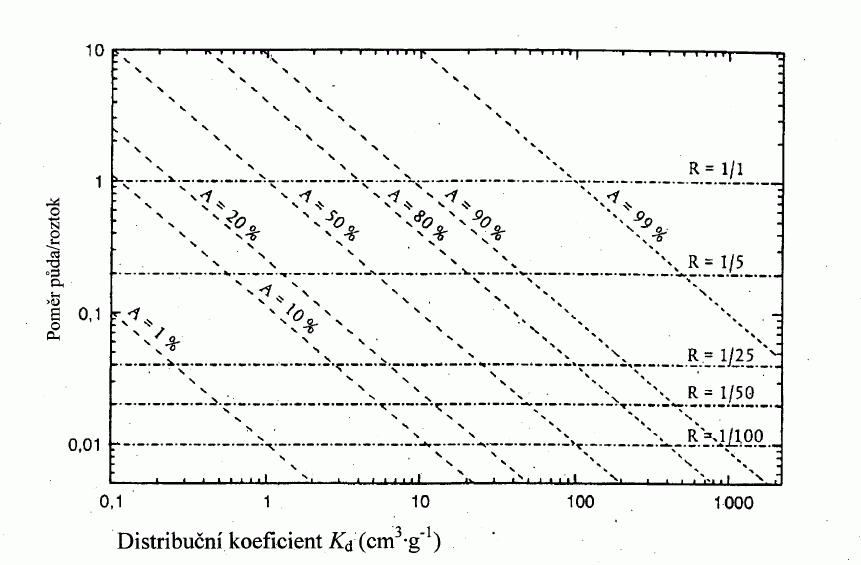
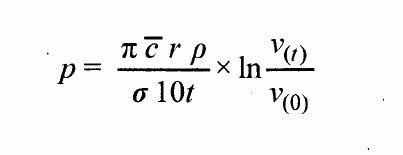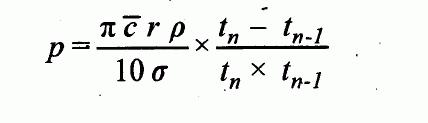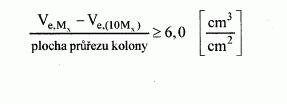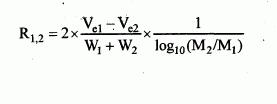222/2004 Sb.
VYHLÁŠKA
ze dne 14. dubna 2004,
kterou se u chemických látek a chemických přípravků
stanoví základní metody pro zkoušení fyzikálně-chemických
vlastností, výbušných vlastností
a vlastností nebezpečných pro životní prostředí
Změna: 389/2005 Sb.
Ministerstvo životního prostředí stanoví podle § 8 odst. 5
písm. c) zákona č. 356/2003 Sb., o chemických látkách a chemických
přípravcích a o změně některých zákonů:
§ 1
Metody pro zkoušení fyzikálně-chemických a výbušných
vlastností chemických látek (dále jen "látky") a chemických
přípravků (dále jen "přípravky"), které jsou uvedeny v příloze č. 1, se použijí pro stanovení
a) bodu tání/bodu tuhnutí,
b) bodu varu,
c) relativní hustoty,
d) tlaku par,
e) povrchového napětí,
f) rozpustnosti ve vodě,
g) rozdělovacího koeficientu,
h) výbušných vlastností,
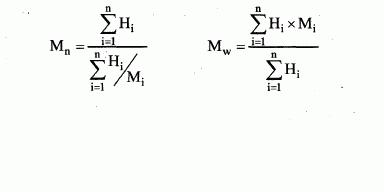
i) číselně střední molekulové hmotnosti a distribuce molekulové
hmotnosti polymerů,
j) obsahu molekul o nízké hmotnosti v polymerech,
k) chování polymerů při rozpouštění/extrakci ve vodě.
§ 2
Metody pro zkoušení vlastností látek a přípravků
nebezpečných pro životní prostředí, které jsou uvedeny v příloze č. 2, se použijí
pro stanovení
a) akutní toxicity pro ryby,
b) akutní toxicity pro dafnie,
c) inhibice růstu řas,
d) "snadné" biologické rozložitelnosti pomocí
- úbytku rozpuštěného organického uhlíku (DOC),
- úbytku DOC modifikovanou screeningovou zkouškou,
- uvolňování oxidu uhličitého (CO
2
) modifikovanou Sturmovou
zkouškou,- manometrické respirometrie,
- zkoušky v uzavřených lahvičkách,
- zkoušky MITI,
e) rozložitelnosti - biologická spotřeba kyslíku,
f) rozložitelnosti - chemická spotřeba kyslíku,
g) abiotického rozkladu - hydrolýza jako funkce pH,
h) toxicity pro žížaly - zkouška na umělé půdě,
i) biologické rozložitelnosti - Zahn-Wellensova zkouška,
j) biologické rozložitelnosti - simulační zkouška s aktivovaným
kalem,
k) biologické rozložitelnosti - zkouška inhibice dýchání
aktivovaného kalu,
l) biologické rozložitelnosti - modifikovaná zkouška SCAS,
m) bioakumulace - průtoková zkouška na rybách,
n) růstu na nedospělých rybách,
o) toxicity na rybích embryích a potěru - krátkodobá zkouška,
p) akutní orální toxicity pro včelu medonosnou,
r) akutní kontaktní toxicity pro včelu medonosnou,
s) adsorpce/desorpce v rovnovážném stavu,
t) odhadu adsorpčního koeficientu (KOU) pro půdy a čistírenské
kaly vysokoúčinnou kapalinovou chromatografií (HPLC),
u) toxicity pro reprodukci u Daphnia magna,
v) aktivity půdních mikroorganismů při transformaci dusíku,
w) aktivity půdních mikroorganismů při transformaci uhlíku,
x) aerobní a anaerobní transformace v půdě,
y) aerobní a anaerobní transformace v systémech voda-sediment.
§ 3
Zrušuje se:
1. Vyhláška č. 299/1998 Sb., kterou se stanoví metody pro
zjišťování fyzikálně-chemických a chemických vlastností
chemických látek a chemických přípravků a vlastností chemických
látek a chemických přípravků nebezpečných pro životní
prostředí.
2. Vyhláška č. 316/1998 Sb., kterou se stanoví metoda pro
zjišťování výbušnosti chemických látek a chemických přípravků.
§ 4
Tato vyhláška nabývá účinnosti dnem vstupu smlouvy
o přistoupení České republiky k Evropské unii v platnost.
Ministr:
RNDr. Ambrozek v. r.
Příl.1
METODY PRO ZKOUŠENÍ FYZIKÁLNĚ-CHEMICKÝCH A VÝBUŠNÝCH
VLASTNOSTÍ
I. METODY PRO STANOVENí BODU TÁNÍ / BODU TUHNUTÍ – metody
uvedené v bodu a.1 přílohy směrnice Komise 92/69/EHS ze dne
31. července 1992, kterou se po sedmnácté přizpůsobuje
technickému pokroku směrnice Rady 67/548/EHS o sbližování
správních a právních předpisů týkajících se klasifikace,
balení a označování nebezpečných látek (dále jen „směrnice
92/69/EHS“)
I.1 METODA
Většina dále popsaných metod je založena na Pokynech
OECD pro zkoušení (1). Jejich základní principy jsou
uvedeny v literatuře (2) a (3).
I.1.1 ÚVOD
Popsané metody a přístroje jsou určeny ke stanovení
bodu tání látek bez omezení z hlediska stupně jejich
čistoty.
Výběr metody závisí na povaze látky, která má být
zkoumána. Omezením bude tedy skutečnost, zda lze danou
látku rozmělnit na prášek snadno, obtížně nebo zda ji
nelze rozmělnit.
U některých látek je vhodnější stanovení bodu tuhnutí
nebo krystalizace a normalizované metody pro tato
stanovení jsou v této metodě rovněž uvedeny.
Nelze-li vzhledem ke zvláštním vlastnostem látky dobře
stanovit žádný z uvedených parametrů, může být vhodné
stanovit bod tekutosti.
I.1.2 DEFINICE A JEDNOTKY
Bod tání je definován jako teplota, při níž dochází za
atmosférického tlaku k přechodu z tuhého do kapalného
skupenství a která za ideálních podmínek odpovídá bodu
tuhnutí.
Vzhledem k tomu, že u mnoha látek dochází k fázovému
přechodu v rozmezí teplot, je toto rozmezí často
nazýváno rozmezím bodu tání.
Přepočet jednotek (K na st.C):
t = T - 273,15
t - Celsiova teplota, stupně Celsia (st.C)
T - termodynamická teplota, kelvin (K)
I.1.3 REFERENČNÍ LÁTKY
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
Některé kalibrační látky jsou uvedeny v literatuře (4).
I.1.4 PODSTATA ZKUŠEBNÍCH METOD
Stanovuje se teplota (teplotní rozmezí) fázového
přechodu z tuhého do kapalného skupenství nebo
z kapalného do tuhého skupenství. V praxi se při
zahřívání/ochlazování vzorku zkušební látky za
atmosférického tlaku stanoví teploty počátku
tání/tuhnutí a konce tání/tuhnutí. Je popsáno pět typů
metod, jmenovitě kapilární metoda, metody používající
zahřívací bloky, stanovení bodu tuhnutí, metody
termické analýzy a stanovení bodu tekutosti (vyvinuto
pro minerální oleje).
V některých případech může být vhodné měřit bod tuhnutí
místo bodu tání.
I.1.4.1 Kapilární metoda
I.1.4.1.1 Zařízení pro stanovení bodu tání s kapalinovou
lázní
Malé množství jemně rozmělněné látky se vpraví do
kapiláry a zhutní se. Kapilára se zahřívá spolu
s teploměrem, přičemž se rychlost nárůstu teploty během
tání nastaví na méně než 1 K·min
-1
. Stanoví se teploty
počátku a konce tání.I.1.4.1.2 Zařízení pro stanovení bodu tání s kovovým blokem
Provádí se podobně jako v bodě 1.4.1.1 s tím rozdílem,
že kapilára a teploměr jsou umístěny v kovovém
vyhřívaném bloku a pozorují se otvory v bloku.
I.1.4.1.3 Detekce fotočlánkem
Vzorek v kapiláře se automaticky zahřívá v kovovém
válci. Otvorem ve válci prochází látkou světelný
paprsek na přesně kalibrovaný fotočlánek. Při tání mění
většina látek optické vlastnosti a z neprůhledných se
mění na průhledné. V tomto okamžiku vzroste intenzita
světla dopadajícího na fotočlánek a do zařízení
odečítajícího teplotu platinového odporového teploměru
umístěného v topné komůrce je vyslán signál k zastavení
zaznamenávání. Tato metoda není vhodná pro některé
silně zbarvené látky.
I.1.4.2 Zahřívací bloky
I.1.4.2.1 Koflerův zahřívací stolek
Koflerův zahřívací stolek je tvořen dvěma kovovými
hastmi s různou teplotní vodivostí, je vyhříván
elektricky a je konstruován tak, že teplotní gradient
je po jeho délce téměř lineární. Teplota stolku se může
měnit od 283 do 573 K; stolek je vybaven speciálním
zařízením pro odečítání teploty, tvořeným jezdcem
s ukazatelem a stupnicí navrženou pro daný stolek. Pro
stanovení bodu tání se látka nanese v tenké vrstvě
přímo na povrch stolku. Během několika sekund se
vytvoří ostrá dělicí linie mezi kapalnou a tuhou fází.
Teplota v místě dělicí linie se odečte po nastavení
ukazatele na tuto dělicí linii.
I.1.4.2.2 Tavicí mikroskop
Pro stanovení bodu tání velmi malých množství látek se
používají různé typy mikroskopů s ohřívacím stolkem.
Většina ohřívacích stolků využívá k měření teploty
citlivé termočlánky, používají se však i rtuťové
teploměry. Typický přístroj pro stanovení bodu tání
pomocí mikroskopu s ohřívacím stolkem má ohřívací
komoru s kovovou deskou, na kterou se umístí vzorek na
podložním sklíčku. Ve středu kovové desky je otvor,
kterým může procházet světelný paprsek odražený
osvětlovacím zrcátkem mikroskopu. Při měřeních se
ohřívací komora přikryje skleněnou destičkou, aby se
omezila cirkulace vzduchu v místě, kde se nachází
vzorek.
Ohřev vzorku se kontroluje regulačním odporem. Pro
velmi přesná měření opticky anisotropních látek lze
používat polarizované světlo.
I.1.4.2.3 Menisková metoda
Tato metoda se používá především pro polyamidy.
Vizuálně se stanoví teplota, při které se zřetelně
posune meniskus silikonového oleje uzavřeného mezi
ohřívacím blokem a skleněnou krycí destičkou umístěnou
na vzorku zkoušeného polyamidu.
I.1.4.3 Metoda stanovení bodu tuhnutí
Vzorek se vloží do speciální zkumavky, která se umístí
do přístroje pro stanovení bodu tuhnutí. Během
ochlazování se vzorek nepřetržitě pomalu míchá a ve
vhodných intervalech se odečítá teplota. Jakmile je
teplota po několik odečtů konstantní (po odpovídající
korekci teploměru), je zaznamenána jako bod tuhnutí.
Podchlazení je nutno zabránit udržováním rovnováhy mezi
tuhou a kapalnou fází.
I.1.4.4 Termická analýza
I.1.4.4.1 Diferenční termická analýza (DTA)
Při této technice se zaznamenává teplotní rozdíl mezi
danou látkou a referenční látkou, jež jsou podrobeny
stejnému řízenému teplotnímu programu. Jestliže u
vzorku dojde k fázovému přechodu, který je spojen se
změnou enthalpie, je tato změna zaznamenána jako
endotermická (tání) nebo exotermická (tuhnutí) odchylka
od základní linie záznamu teploty.
I.1.4.4.2 Diferenční skenovací kalorimetrie (DSC)
Při této technice se daná látka a referenční látka
podrobí stejnému řízenému teplotnímu programu a
zaznamenává se rozdíl energie absorbované danou látkou
a referenční látkou jako funkce teploty. Tato energie
je energií potřebnou k zachování nulového teplotního
rozdílu mezi danou látkou a referenční látkou. Jestliže
u vzorku dojde k fázovému přechodu, který je spojen se
změnou enthalpie, je tato změna zaznamenána jako
endotermická (tání) nebo exotermická (tuhnutí) odchylka
od základní linie záznamu tepelného toku.
I.1.4.5 Bod tekutosti
Metoda byla vyvinuta pro minerální oleje a je vhodná
pro měření olejovitých látek s nízkým bodem tání.
Po počátečním zahřátí se vzorek určitou rychlostí
ochlazuje a v intervalech po 3 K se stanovuje jeho
tekutost. Nejnižší teplota, při níž je ještě pozorován
pohyb látky, se zaznamená jako bod tekutosti.
I.1.5 KRITÉRIA JAKOSTI
Použitelnost a přesnost různých metod stanovení
bodu / rozmezí bodu tání jsou uvedeny v následující
tabulce.
TABULKA: POUŽITELNOST METOD
A. Kapilární metody
----------------------------------------------------------------
Metoda Látky, Látky, Rozsah Odhadnutá Existující
měření které lze které teplot přesnost 1) norma
rozmělnit nelze
na prášek snadno
rozmělnit
na prášek
----------------------------------------------------------------
Zařízení ano pouze pro 273 až +/-0,3 K JIS K 0064
pro několik 573 K
stanovení látek
bodu tání s
kapalinovou
lázní
----------------------------------------------------------------
Zařízení ano pouze pro 293 až +/-0,5 K ISO 1218(E)
pro několik > 573 K
stanovení látek
bodu tání
s kovovým
blokem
----------------------------------------------------------------
Detekce ano pro 253 až +/-0,5 K
fotočlánkem některé 573 K
látky
s použitím
přídavných
zařízení
----------------------------------------------------------------
1) Závisí na typu zařízení a stupni čistoty látky
B. Zahřívací bloky a stanovení bodu tuhnutí
----------------------------------------------------------------
Metoda Látky, Látky, Rozsah Odhadnutá Existující
měření které lze které teplot přesnost1) norma
rozmělnit nelze
na prášek snadno
rozmělnit
na prášek
----------------------------------------------------------------
Koflerův ano ne 283 až +/-1,0 K ANSI/ASTM
zahřívací > 573 K D 345176
stolek
----------------------------------------------------------------
Tavicí ano pouze pro 273 až +/-0,5 K DIN 53736
mikroskop několik > 573 K
látek
----------------------------------------------------------------
Menisková ne především 293 až +/-0,5 K ISO 1218
metoda pro > 573 K (E)
polyamidy
----------------------------------------------------------------
Metoda ano ano 223 až +/-0,5 K např. BS
stanovení 573 K 4695
bodu
tuhnutí
----------------------------------------------------------------
1) Závisí na typu zařízení a stupni čistoty látky
C. Termická analýza
----------------------------------------------------------------
Metoda Látky, Látky, Rozsah Odhadnutá Existující
měření které lze které teplot přesnost norma
rozmělnit nelze 1)
na prášek snadno
rozmělnit
na prášek
----------------------------------------------------------------
Diferenční ano ano 173 až do 600 K ASTM
termická 1 273 K +/-0,5 K E 53776
analýza do
1 273 K
+/-2,0 K
----------------------------------------------------------------
Diferenční ano ano 173 až do 600 K ASTM
skenovací 1 273 K +/-0,5 K E 53776
kalorimetrie do
1 273 K
+/-2,0 K
----------------------------------------------------------------
1) Závisí na typu zařízení a stupni čistoty látky
D. Bod tekutosti
----------------------------------------------------------------
Metoda Látky, Látky, Rozsah Odhadnutá Existující
měření které lze které nelze teplot přesnost norma
rozmělnit snadno 1)
na prášek rozmělnit
na prášek
----------------------------------------------------------------
Teplota pro pro 223 až +/-3,0 K ASTM
tekutosti minerální minerální 323 K D 9766
oleje a oleje a
olejovité olejovité
látky látky
----------------------------------------------------------------
1) Závisí na typu zařízení a stupni čistoty látky
I.1.6 POPIS METOD
Postupy téměř všech těchto zkušebních metod jsou
popsány ve vnitrostátních a mezinárodních normách (viz
doplněk 1)
.I.1.6.1 Kapilární metody
Při pomalém vzestupu teploty lze u jemně práškovitých
látek obvykle rozlišit stupně tání znázorněné na
obrázku 1.
Obrázek 1
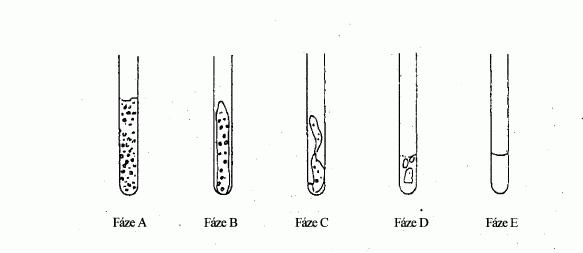
Fáze A (Počátek tání): na vnitřní straně trubičky se
stejnoměrně drží jemné kapičky.
Fáze B V důsledku smrštění vzorku se mezi vnitřní
stěnou a vzorkem tvoří mezera.
Fáze C Smrštěný vzorek se začíná hroutit dolů a
stává se tekutým.
Fáze D Na povrchu se tvoří úplný meniskus, ale
značná část vzorku je dosud tuhá.
Fáze E (Konečná fáze tání): Vzorek již neobsahuje
žádné tuhé částice.
Během stanovení bodu tání se zaznamenávají teploty
počátku tání a konečné fáze.
I.1.6.1.1 Zařízení pro stanovení bodu tání s kapalinovou
lázní
Na obrázku 2 je znázorněna normalizovaná skleněná
aparatura pro stanovení bodu tání (JIS K 0064); všechny
rozměry jsou uvedeny v milimetrech.
Obrázek 2
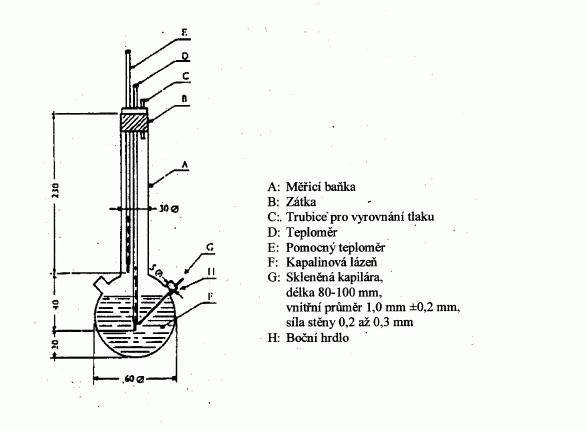
Kapalinová lázeň:
Je třeba zvolit vhodnou kapalinu. Volba kapaliny závisí
na bodu tání, který má být stanovena např. kapalný
parafin pro stanovení bodu tání nižšího než 473 K,
silikonový olej pro stanovení bodu tání nižšího než
573 K.
Pro stanovení bodu tání vyššího než 523 K lze použít
směs tří hmotnostních dílů kyseliny sírové a dvou
hmotnostních dílů síranu draselného. S tímto typem
směsi je třeba pracovat s náležitou opatrností.
Teploměr:
Měly by se používat pouze teploměry, které splňují
požadavky norem ASTM E 171, DIN 12770, JIS K 8001 nebo
rovnocenných norem.
Postup:
Suchá látka se jemně rozetře v třecí misce a vpraví se
do kapiláry zatavené na jednom konci, a to tak, aby po
zhutnění byla kapilára naplněna do výšky přibližně
3 mm. Má-li se dosáhnout stejnoměrného zhutnění, nechá
se kapilára dopadnout z výšky přibližně 700 mm
skleněnou trubicí na hodinové sklíčko.
Naplněná kapilára se vloží do lázně tak, aby se střední
část rtuťové baňky teploměru dotýkala kapiláry v místě,
kde se nachází vzorek. Kapilára se obvykle vkládá do
lázně při teplotě asi o 10 K nižší, než je bod tání.
Lázeň se zahřívá tak, aby vzestup teploty činil
přibližně 3 K·min
-1
. Lázeň se míchá. Asi 10 K pod
očekávaným bodem tání se růst teploty upraví na nejvýše
1 K*min-1
.Výpočet:
Bod tání se vypočte takto:
T = T
D
+ 0,00016 (TD
- TE
) nkde:
T = korigovaný bod tání v K
T
D
= odečet teploty na teploměru D v K T
E
= odečet teploty na teploměru E v K n = počet stupňů, o něž rtuťový sloupec teploměru D
vyčnívá z kapaliny
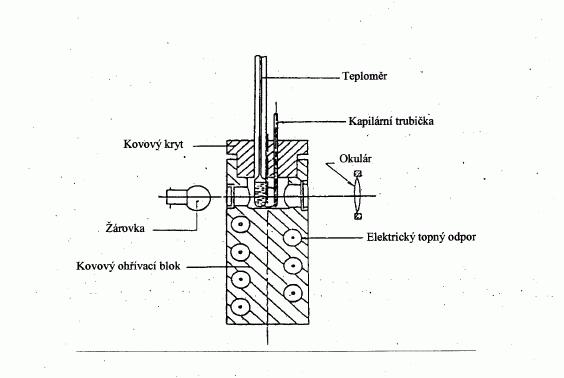
.I.1.6.1.2 Zařízení pro stanovení bodu tání s kovovým blokem
Přístroj:
Je tvořen
— válcovým kovovým blokem, jehož horní část je dutá
a tvoří komoru (viz obrázek 3),
— kovovou krycí deskou se dvěma nebo více otvory,
kterými je možno do kovového bloku zavést
trubičky,
— ohřívacím systémem kovového bloku, například
elektrickým topným odporem uzavřeným v kovovém
bloku,
— regulačním odporem pro regulaci příkonu, jeli
použit elektrický ohřev,
— čtyřmi okénky ze žáruvzdorného skla v bočních
stěnách ohřívací komory, orientovanými vůči sobě
pod pravým úhlem. Před jedním z těchto okének je
umístěn okulár pro pozorování kapilární trubičky.
Ostatní tři okénka slouží k osvětlení vnitřního
prostoru žárovkami,
— kapilární trubičkou ze žáruvzdorného skla
zatavenou na jednom konci (viz 1.6.1.1).
Teploměr:
Viz normy uvedené v 1.6.1.1. Je rovněž možné použít
termoelektrické měřicí přístroje srovnatelné přesnosti.
Obrázek 3
I.1.6.1.3 Detekce fotočlánkem
Přístroj a postup:
Přístroj sestává z kovové komory s automatickým
ohřívacím zařízením. Tři kapilární trubičky se naplní
podle bodu 1.6.1.1 a umístí se do ohřívací komory.
Pro kalibraci přístroje je k dispozici několik
lineárních režimů růstu teploty, přičemž vhodný
lineární růst teploty se elektricky nastaví předem
zvolenou konstantou. Zaznamenávací zařízení ukazují
teplotu v ohřívací komoře a teplotu látky v kapilárách.
I.1.6.2 Zahřívací bloky
I.1.6.2.1 Koflerův zahřívací stolek
Viz doplněk.
I.1.6.2.2 Tavicí mikroskop
Viz doplněk.
I.1.6.2.3 Menisková metoda (pro polyamidy)
Viz doplněk.
V oblasti bodu tání by měla být rychlost ohřevu menší
než 1 K·min
-1
.I.1.6.3 Metody stanovení bodu tuhnutí
Viz doplněk.
I.1.6.4 Termická analýza
I.1.6.4.1 Diferenční termická analýza
Viz doplněk.
I.1.6.4.2 Diferenční skenovací kalorimetrie
Viz doplněk.
I.1.6.5 Stanovení bodu tekutosti
Viz doplněk
.I.2 DATA
V některých případech je nutno provést korekci
teploměru.
I.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— použitá metoda,
— přesná specifikace látky (identita a nečistoty) a
popř. informace o provedeném předběžném čištění,
— odhad přesnosti.
Jako bod tání se uvede střední hodnota alespoň dvou
měření, jejichž výsledky leží v rozmezí odhadnuté
přesnosti (viz tabulky).
Leží-li rozdíl teplot počáteční a konečné fáze tání
v mezích přesnosti metody, uvede se jako bod tání
konečná teplota, v opačném případě se uvedou obě
teploty.
Jestliže se látka před dosažením bodu tání rozkládá
nebo sublimuje, uvede se teplota, při které dochází
k pozorovanému jevu.
Musí být uvedeny všechny informace a poznámky, které
jsou důležité pro interpretaci výsledků, zejména pokud
jde o nečistoty a fyzikální stav látky.
I.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 102, Decision of
the Council C(81) 30 final.
(2) IUPAC, B. Le Neindre, B. Vodar, (eds.).
Experimental thermodynamics. Butterworths, London,
1975, II, 803-834.
(3) R. Weissberger (ed.): Technique of organic
Chemistry, Physical Methods of Organic Chemistry.
3rd ed., Interscience Publ., New York, 1959, I,
Part I, Chapter VII.
(4) IUPAC, Physicochemical measurements: Catalogue of
reference materials from national laboratories,
Pure and applied chemistry. 1976, 48, 505-515.
DODATEK
Další technické podrobnosti je možné zjistit například
v následujících normách:
1. Kapilární metody
1.1 Přístroje pro stanovení bodu tání s kapalinovou lázní
ASTM E 3269 Standard test method for relative
initial and final melting points
and the melting range of organic
chemicals
BS 4634 Method for the determination
of melting point and/or melting
range
DIN 53181 Bestimmung des Schmelzintervalles
von Harzen nach Kapillarverfahren
JIS K 00-64 Testing methods for melting point
of chemical products
1.2 Přístroje pro stanovení bodu tání s kovovým blokem
DIN 53736 Visuelle Bestimmung der
Schmelztemperatur von
teilkristallinen Kunststoffen
ISO 1218 (E) Plastics – polyamides –
determination of „melting point“
2. Zahřívací bloky
2.1 Koflerův zahřívací stolek
ANSI/ASTM D 345176 Standard recommended practices
for testing polymeric powder
coatings
2.2 Tavicí mikroskop
DIN 53736 Visuelle Bestimmung der
Schmelztemperatur von
teilkristallinen Kunssttoffen
2.3 Menisková metoda (polyamidy)
ISO 1218 (E) Plastics – polyamides –
determination of „melting point“
ANSI/ASTM D 213366 Standard specificatin for acetal
resin injection moulding and
extrusion materials
NF T 51-050 Résines de polyamides.
Détermination du „point de
fusion“. Méthode du ménisque
3. Metody stanovení bodu tuhnutí
BS 4633 Method for the determination
of crystallizing point
BS 4695 Method for Determination of
Melting Point of Petroleum Wax
(Cooling Curve)
DIN 51421 Bestimmung des Gefrierpunktes von
Flugkraftstoffen,
Ottokraftstoffen und
Motorenbenzolen
ISO 2207 Cires de pétrole: détermination
de la temperature de figeage
DIN 53175 Bestimmung des Erstarrungspunktes
von Fettsäuren
NF T 60-114 Point de fusion des paraffines
NF T 20-051 Méthode de détermination du point
de cristallisation (point de
congélation)
ISO 1392 Method for the determination of
the freezing point
4. Termická analýza
4.1 Diferenční termická analýza
ASTM E 537-76 Standard method for assessing the
thermal stability of chemicals by
methods of differential thermal
analysis
ASTM E 473-85 Standard definitions of terms
relating to thermal analysis
ASTM E 472-86 Standard practice for reporting
thermoanalytical data
DIN 51005 Thermische Analyse, Begriffe
4.2 Diferenční skenovací kalorimetrie
ASTM E 537-76 Standard method for assessing the
thermal stability of chemicals by
methods of differential thermal
analysis
ASTM E 473-85 Standard definitions of terms
relating to thermal analysis
ASTM E 472-86 Standard practice for reporting
thermoanalytical data
DIN 51005 Thermische Analyse, Begriffe
5. Stanovení bodu tekutosti
NBN 52014 Echantillonnage et analyse des
produits du pétrole: Point de
trouble et point ďécoulement
limite – Monsterneming en
ontleding van aardolieproducten:
Troebelingspunt en vloeipunt
ASTM D 97-66 Standard test method for pour
point of petroleum oils
ISO 3016 Petroleum oils – Determination of
pour point.
II. METODY PRO STANOVENÍ BODU VARU – METODY UVEDENÉ V BODU
A.2 PŘÍLOHY SMĚRNICE 92/69/EHS
II.1 METODA
Většina dále popsaných metod je založena na Pokynech
OECD pro zkoušení (1). Jejich základní principy jsou
uvedeny v literatuře (2) a (3).
II.1.1 ÚVOD
Popsané metody a zařízení lze použít pro kapaliny a
látky s nízkým bodem tání, pokud nepodléhají chemickým
reakcím pod bodem varu (např. autooxidaci, přesmyku,
rozkladu atd.). Metody lze použít jak pro čisté kapalné
látky, tak pro kapalné látky obsahující nečistoty.
Přednost mají metody využívající detekci fotočlánkem a
metody termické analýzy, protože umožňují stanovení jak
bodu tání, tak bodu varu. Tato měření mohou být navíc
prováděna automaticky.
„Dynamická metoda“ má tu výhodu, že ji lze použít i ke
stanovení tlaku par a přitom není třeba korigovat bod
varu na normální tlak (101,325 kPa), neboť ten lze
během měření nastavit manostatem.
Poznámky:
Vliv nečistot na stanovení bodu varu závisí ve velké
míře na jejich povaze. Jestliže vzorek obsahuje těkavé
nečistoty, které mohou ovlivnit výsledky, může být
látky přečištěna.
II.1.2 DEFINICE A JEDNOTKY
Standardní bod varu je definován jako teplota, při
které je tlak par dané kapaliny roven 101,325 kPa.
Jestliže se měření bodu varu neprovádí za normálního
tlaku, lze závislost tlaku par na teplotě popsat
Clausiovou-Clapeyronovou rovnicí:
delta Hv
log p = ---------- + konst.
2,3 RT
kde
p = tlak par látky v Pa
delta H
v
= výparné teplo v J*mol-1
R = univerzální molární plynová konstanta =
8,314 J*mol
-1
*K-1
T = termodynamická teplota v K
Bod varu se uvádí s ohledem na okolní tlak při měření.
Přepočty:
Tlak (jednotka: kPa)
100 kPa = 1 bar = 0,1 MPa
(jednotka „bar“ je nadále přípustná, její
používání se však nedoporučuje)
133 Pa = 1 mm Hg = 1 torr
(jednotky „mm Hg“ a „torr“ nejsou povoleny)
1 atm = standardní atmosféra = 101 325 Pa
(jednotka „atm“ není povolena).
Teplota (jednotka: K)
t = T - 273,15
t - Celsiova teplota, stupeň Celsia (st.C)
T - termodynamická teplota, kelvin (K)
II.1.3 REFERENČNÍ LÁTKY
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
Některé kalibrační látky jsou uvedeny v doplňku.
II.1.4 PODSTATA ZKUŠEBNÍCH METOD
Pět metod stanovení bodu varu (teplotního rozmezí bodu
varu) je založeno přímo na měření teploty varu, další
dvě využívají termální analýzy.
II.1.4.1 Stanovení ebuliometrem
Ebuliometry byly původně vyvinuty pro stanovení
molekulové hmotnosti na základě zvýšení teploty varu,
jsou však vhodné také pro přesná měření bodu varu.
Velmi jednoduchý přístroj je popsán v normě
ASTM D 112072 (viz doplněk). V tomto přístroji se
kapalina zahřívá za rovnovážných podmínek při
atmosférickém tlaku, dokud nezačne vřít.
II.1.4.2 Dynamická metoda
Metoda zahrnuje měření teploty kondenzace páry vhodným
teploměrem umístěným za varu ve zpětném toku (refluxu).
U této metody lze měnit tlak.
II.1.4.3 Destilační metoda pro stanovení bodu varu
Metoda zahrnuje destilaci kapaliny a měření teploty
kondenzace páry, přičemž se stanovuje také množství
destilátu.
II.1.4.4 Postup podle Siwoloboffa
Vzorek se zahřívá ve zkumavce, která je ponořena do
tepelné lázně. Do zkumavky se vzorkem je zasunuta
zatavená kapilára, v jejíž spodní části se nachází
vzduchová bublinka.
II.1.4.5 Detekce fotočlánkem
Při použití principu unikajících bublinek podle
Siwoloboffa se provádí automatické fotoelektrické
měření.
II.1.4.6 Diferenční termická analýza
Při této technice se zaznamenává teplotní rozdíl mezi
danou látkou a referenčním materiálem jako funkce
teploty, přičemž látka a referenční materiál se podrobí
témuž řízenému teplotnímu programu. Jestliže u
studované látky dojde k fázovému přechodu, který je
spojen se změnou enthalpie, je tato změna indikována
jako endotermická odchylka (var) od základní linie
záznamu teploty.
II.1.4.7 Diferenční skenovací kalorimetrie
Při této technice se látka a referenční materiál
podrobí stejnému řízenému teplotnímu programu a
zaznamenává se rozdíl energie absorbované látkou a
referenčním materiálem jako funkce teploty. Tato
energie je energií potřebnou k zachování nulového
teplotního rozdílu mezi látkou a referenčním
materiálem. Jestliže u vzorku dojde k fázovému
přechodu, který je spojen se změnou enthalpie, je tato
změna indikována jako endotermická odchylka (var) od
základní linie záznamu tepelného toku.
II.1.5 KRITÉRIA JAKOSTI
Použitelnost a přesnost různých metod používaných pro
stanovení bodu / teplotního rozmezí bodu varu jsou
uvedeny v následující tabulce 1.
TABULKA 1: SROVNÁNÍ METOD ----------------------------------------------------------------- Metoda měření Odhadnutá přesnost Existující norma ----------------------------------------------------------------- Stanovení +/-1,4 K (do 373 K)1) 2) ASTM D 1120721) ebuliometrem +/-2,5 K (do 600 K)1) 2) Dynamická metoda +/-0,5 K (do 600 K)2) Destilační metoda +/-0,5 K (do 600 K) ISO / R 918, (stanovení rozmezí DIN 53171, bodu varu) BS 4591/71 Postup podle +/-2 K (do 600 K)2) Siwoloboffa Detekce fotočlánkem +/-0,3 K (při 373 K)2) Diferenční termická +/-0,5 K (do 600 K) ASTM E 53776 analýza +/-2,0 K (do 1 273 K) Diferenční skenovací +/-0,5 K (do 600 K) ASTM E 53776 kalorimetrie +/-2,0 K (do 1 273 K) ----------------------------------------------------------------- 1) Tato přesnost platí pouze pro jednoduchý přístroj, popsaný např. v normě ASTM D 112072; může být zlepšena užitím dokonalejšího ebuliometru. 2) Platí pouze pro čisté látky. Užití za jiných okolností by mělo být zdůvodněno.
II.1.6 POPIS METOD
Postupy některých zkušebních metod jsou popsány
v mezinárodních a vnitrostátních normách (viz doplněk).
II.1.6.1 Ebuliometr
Viz doplněk.
II.1.6.2 Dynamická metoda
Viz metoda A.4 pro stanovení tlaku par.
Zaznamená se teplota varu naměřená při tlaku
101,325 kPa.
II.1.6.3 Destilační metoda (stanovení rozmezí bodu varu)
Viz doplněk.
II.1.6.4 Postup podle Siwoloboffa
Vzorek se zahřívá ve zkumavce o průměru přibližně 5 mm
v přístroji pro stanovení bodu tání (obrázek 1).
Na obrázku 1 je znázorněn normalizovaný přístroj pro
stanovení bodu varu (JIS K 0064) (přístroj je skleněný,
všechny rozměry jsou uvedeny v milimetrech).
Obrázek 1
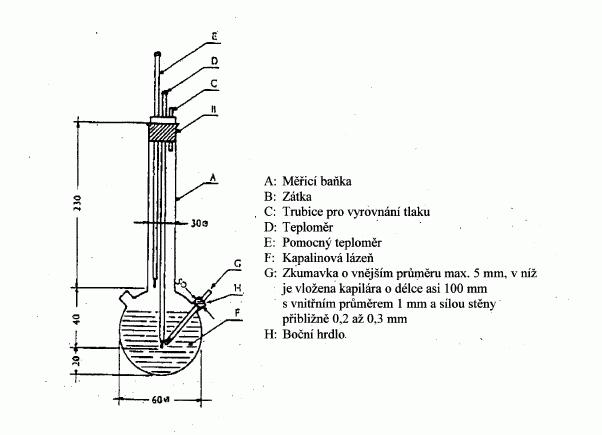
Do zkumavky se vloží kapilára (varná kapilára) zatavená
asi 1 cm nad spodním koncem. Zatavená část kapiláry
musí ležet pod hladinou kapaliny. Zkumavka obsahující
kapiláru se upevní buď pryžovou páskou k teploměru nebo
pomocí bočního držáku (viz obrázek 2).
Obrázek 2
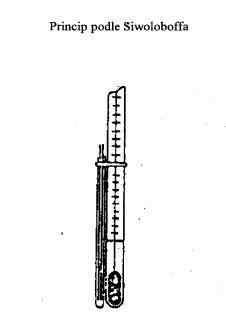
Obrázek 3
Kapalina pro lázeň se volí podle bodu varu. Pro teploty
do 573 K lze použít silikonový olej. Parafinový olej
lze použít pouze do 473 K. Kapalina v lázni se zahřívá
tak, aby vzestup teploty byl zpočátku asi 3 K*min
-1
.
Lázeň se míchá. Asi 10 K před očekávaným bodem tání se
zahřívání sníží tak, aby nárůst teploty byl nejvýše
1 K*min-1
. Krátce před dosažením bodu varu začnou
z varné kapiláry rychle unikat bublinky. Bodu varu je dosaženo, když při ochlazování náhle
ustane unikání bublinek a kapalina začne v kapiláře
stoupat. Příslušný údaj na teploměru je bodem varu
látky.
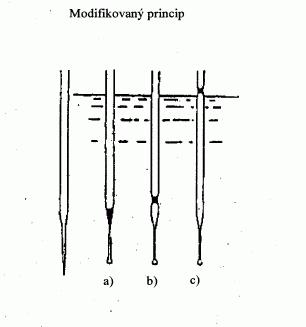
Modifikovanou metodou (obrázek 3) se bod varu stanovuje
v kapiláře pro stanovení bodu tání. Ta se vytáhne do
tenké špičky dlouhé asi 2 cm (a) a do ní se nasaje malé
množství vzorku. Otevřený konec tenké části kapiláry se
zataví tak, aby na konci byla malá vzduchová bublinka.
Při zahřívání v aparatuře pro stanovení bodu tání (b)
se vzduchová bublinka rozpíná. Bod varu odpovídá
teplotě, při které sloupeček látky dosáhne hladiny
kapalinové lázně (c).
II.1.6.5 Detekce fotočlánkem
Vzorek se zahřívá v kapiláře ve vyhřívaném kovovém
bloku.
Otvory v bloku se vede světelný paprsek tak, aby
procházel látkou na přesně kalibrovaný fotočlánek.
Při zvyšování teploty vzorku stoupají z kapiláry
jednotlivé vzduchové bublinky. Při dosažení bodu varu
počet bublinek značně vzroste. To vede ke změně
intenzity světla zaznamenané fotočlánkem a vyvolá
signál v měřicím přístroji, kterým se zastaví
zaznamenávání teploty měřené platinovým odporovým
teploměrem umístěným v bloku.
Tato metoda je zvláště vhodná, protože umožňuje
stanovení teplot nižších než laboratorní teplota až do
253,15 K (-20 st.C) bez jakékoli úpravy přístroje. Pouze
je třeba umístit přístroj v chladicí lázni.
II.1.6.6 Termická analýza
II.1.6.6.1 Diferenční termická analýza
Viz doplněk.
II.1.6.6.2 Diferenční skenovací kalorimetrie
Viz doplněk.
II.2 DATA
Při malých odchylkách od normálního tlaku (nejvýše +/-
5 kPa) se hodnoty teploty varu přepočítávají na
normalizovanou teplotu Tn pomocí SidneyovyYoungovy
rovnice:
Tn = T + (fT × deltap)
kde:
delta p = (101,325 - p) [pozor na znaménko]
p = naměřený tlak v kPa
fT = velikost změny teploty varu v závislosti na změně
tlaku v K*kPa
-1
T = naměřená teploty varu v K
T
n
= teplota varu korigovaná na normální tlak v K Teplotní korekční faktory fT a rovnice pro jejich
aproximaci jsou uvedeny pro řadu látek ve zmíněných
mezinárodních a vnitrostátních normách.
Například metoda podle DIN 53171 uvádí přibližné
korekce pro rozpouštědla obsažená v nátěrových hmotách:
TABULKA 2: TEPLOTNÍ KOREKČNÍ FAKTORY fT
-----------------------------------------------------------------
Teplota T (K) Korekční faktor fT (K kPa-1)
-----------------------------------------------------------------
323,15 0,26
348,15 0,28
373,15 0,31
398,15 0,33
423,15 0,35
448,15 0,37
473,15 0,39
498,15 0,41
523,15 0,44
548,15 0,45
573,15 0,47
-----------------------------------------------------------------
II.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— použitá metoda,
— přesná specifikace látky (identita a nečistoty) a
popř. informace o provedeném předběžném čištění,
— odhad přesnosti.
Jako bod varu se uvede střední hodnota alespoň dvou
měření, jejichž výsledky leží v rozmezí odhadnuté
přesnosti (viz tabulka 1).
Uvedou se naměřené teploty varu a jejich střední
hodnota a dále hodnota tlaku v kPa, při kterém byla
měření provedena. Tlak by se měl pokud možno blížit
normálnímu tlaku.
Musí být uvedeny všechny informace a poznámky, které
jsou důležité pro interpretaci výsledků, zejména pokud
jde o nečistoty a fyzikální stav látky.
II.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 103, Decision
of the Council C (81) 30 final.
(2) IUPAC, B. Le Neindre, B. Vodar, (eds.).
Experimental thermodynamics. Butterworths, London
1975, volume II.
(3) R. Weissberger (ed.): Technique of organic
chemistry, Physical methods of organic chemistry.
3rd ed. Interscience Publications, New York,
1959, volume I, Part I, Chapter VIII.
DODATEK
Další technické podrobnosti je možné zjistit například
v následujících normách:
1. Ebuliometr
ASTM D 112072 Standard test method for boiling
point of engine antifreezes
2. Destilační postupy (teplotní rozmezí bodu varu)
ISO/R 918 Test Method for Distillation
(Distillation Yield and
Distillation Range)
BS 4349/68 Method for determination of
distillation of petroleum
products
BS 4591/71 Method for the determination of
distillation characteristics
DIN 53171 Lösungsmittel für Anstrichstoffe,
Bestimmung des Siedeverlaufes
NF T 20608 Distillation: détermination du
rendement et de l'intervalle de
distillation
3. Diferenční termická analýza a diferenční skenovací
kalorimetrie
ASTM E 53776 Standard method for assessing the
thermal stability of chemicals by
methods of differential thermal
analysis
ASTM E 47385 Standard definitions of terms
relating to thermal analysis
ASTM E 47286 Standard practice for reporting
thermoanalytical data
DIN 51005 Thermische Analyse: Begriffe
III. METODY PRO STANOVENÍ RELATIVNÍ HUSTOTY – METODY UVEDENÉ
V BODU A.3 PŘÍLOHY SMĚRNICE 92/69/EHS
III.1. METODA
Popsané metody jsou založeny na Pokynech OECD pro
zkoušení (1). Základní principy jsou uvedeny
v literatuře (2).
III.1.1 ÚVOD
Popsané metody stanovení relativní hustoty jsou
použitelné pro tuhé a kapalné látky bez jakýchkoli
omezení, pokud jde o jejich čistotu. Jednotlivé metody,
které lze použít, jsou uvedeny v tabulce 1.
III.1.2 DEFINICE A JEDNOTKY
Relativní hustota D20
4
tuhých látek nebo kapalin je poměr
mezi hmotností určitého objemu zkoumané látky
stanovenou při 20 st.C a hmotností stejného objemu vody
stanovenou při 4 st.C. Relativní hustota nemá rozměr.
Hustota látky ró je podíl hmotnosti látky m a jejího
objemu V. Jednotkou hustoty ró v soustavě SI je kg·m
-3
.III.1.3 REFERENČNÍ LÁTKY (1, 3)
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
III.1.4 PODSTATA METOD
Používají se čtyři skupiny metod.
III.1.4.1 Vztlakové metody
III.1.4.1.1 Hustoměry (pro kapaliny)
Dostatečně přesné a rychlé stanovení hustoty lze
provést plovoucími hustoměry, které umožní stanovit
hustotu kapaliny odečtením hloubky jejich ponoření na
kalibrované stupnici.
III.1.4.1.2 Hydrostatické váhy (pro kapaliny a tuhé látky)
Ke stanovení hustoty zkušebního vzorku lze využít
rozdíl mezi jeho hmotností stanovenou na vzduchu a ve
vhodné kapalině (např. vodě).
U tuhých látek je naměřená hustota reprezentativní jen
pro daný použitý vzorek. Při stanovení hustoty kapalin
se zváží těleso známého objemu nejdříve na vzduchu a
poté v kapalině.
III.1.4.1.3 Metoda ponořené kuličky (pro kapaliny) (4)
Touto metodou se stanoví hustota kapaliny z rozdílu
mezi výsledky vážení kapaliny před ponořením kuličky
známého objemu do zkušební kapaliny a po něm.
III.1.4.2 Pyknometrické metody
Pro tuhé látky a kapaliny lze použít pyknometry různých
tvarů o známém objemu. Hustota se vypočte z rozdílu
výsledků vážení plného a prázdného pyknometru a z jeho
známého objemu.
III.1.4.3 Vzduchový srovnávací pyknometr (pro tuhé látky)
Hustotu tuhé látky v libovolné formě je možné měřit při
pokojové teplotě plynovým srovnávacím pyknometrem.
Objem látky se měří ve vzduchu nebo v inertním plynu
v kalibrovaném válci nastavitelného objemu. Pro výpočet
hustoty se po skončení měření objemu provede vážení.
III.1.4.4 Oscilační densimetr (5, 6, 7)
Hustotu kapaliny lze měřit oscilačním densimetrem.
Mechanický oscilátor konstruovaný ve tvaru Utrubice se
rozkmitá na rezonanční kmitočet, který závisí na jeho
hmotnosti. Po vložení vzorku se rezonanční kmitočet
oscilátoru změní. Aparaturu je nutné kalibrovat dvěma
kapalinami o známé hustotě. Kapaliny by měly být voleny
nejlépe tak, aby pokrývaly rozmezí, ve kterém leží
hustota měřeného vzorku.
III.1.5 KRITÉRIA JAKOSTI
Použitelnost různých metod pro stanovení relativní
hustoty je uvedena v tabulce.
III.1.6 POPIS METOD
Normy uvedené jako příklady, ve kterých je možno
vyhledat technické podrobnosti, jsou uvedeny v doplňku.
Zkoušky musí být provedeny při 20 st.C a provedou se
nejméně dvě měření.
III.2 DATA
Viz normy.
III.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— použitá metoda,
— přesná specifikace látky (identita a nečistoty) a
popř. informace o provedeném předběžném čištění.
Relativní hustota se uvede podle definice v bodě 1.2
společně se skupenstvím měřené látky.
Musí být uvedeny všechny informace a poznámky, které
jsou důležité pro interpretaci výsledků, zejména pokud
jde o nečistoty a skupenství látky.
TABULKA: POUŽITELNOST METOD
------------------------------------------------------------------
Metoda měření Hustota Nejvyšší Existující
možná norma
hodnota
dynamické
viskozity
-----------------
pevné kapaliny
látky
------------------------------------------------------------------
1.4.1.1 Hustoměr ano 5 Pa*s ISO 387,
ISO 649-2,
NF T 20-050
------------------------------------------------------------------
1.4.1.2 Hydrostatické
váhy ano ISO 1183 (A),
a) tuhé látky ano 5 Pa*s ISO 901 a 758
b) kapaliny
------------------------------------------------------------------
1.4.1.3 Metoda ponořené ano 20 Pa*s DIN 53217
kuličky
------------------------------------------------------------------
1.4.2 Pyknometr ISO 3507,
a) tuhé látky ano ISO 1183 (B),
NF T 20053,
b) kapaliny ano 500 Pa*s ISO 758
------------------------------------------------------------------
1.4.3 Vzduchový ano DIN 55990
srovnávací pyknometr Teil 3,
DIN 53243
------------------------------------------------------------------
1.4.4 Oscilační ano 5 Pa*s
densimetr
------------------------------------------------------------------
III.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 109, Decision
of the Council C(81) 30 final.
(2) R. Weissberger (ed.), Technique of Organic
Chemistry, Physical Methods of Organic Chemistry.
3rd ed., Chapter IV, Interscience Publ., New
York, 1959, I, Part 1.
(3) IUPAC. Recommended reference materials for
realization of physico-chemical properties, Pure
and applied chemistry. 1976, 48, 508.
(4) Wagenbreth, H. Die Tauchkugel zur Bestimmung der
Dichte von Flüssigkeiten. Technisches Messen tm,
1979, 11, 427-430.
(5) Leopold, H. Die digitale Messung von
Flüssigkeiten. Elektronik, 1970, 19, 297-302.
(6) Baumgarten, D. Füllmengenkontrolle bei
vorgepackten Erzeugnissen – Verfahren zur
Dichtebestimmung bei flüssigen Produkten und ihre
praktische Anwendung. Die Pharmazeutische
Industrie, 1975, 37, 717-726.
(7) Riemann, J. Der Einsatz der digitalen
Dichtemessung im Brauereilaboratorium.
Brauwissenschaft, 1976, 9, 253-255.
DODATEK
Technické podobnosti lze vyhledat například
v následujících normách.
1. VZTLAKOVÉ METODY
1.1 Hustoměr
DIN 12790, ISO 387 Hydrometer; general instructions
DIN 12791 Part I: Density hydrometers;
construction, adjustment and use
Part II: Density hydrometers;
standardized sizes, designation
Part III: Use and test
ISO 649-2 Laboratory glassware: Density
hydrometers for general purpose
NF T 20050 Chemical products for industrial
use – Determination of density of
liquids – Areometric method
DIN 12793 Laboratory glassware: range find
hydrometers
1.2 Hydrostatické váhy
Pro tuhé látky
ISO 1183 Method A: Methods for determining
the density and relative density
of plastics including cellular
plastics
NF T 20049 Chemical products for industrial
use – Determination of the
density of solids other than
powders and cellular products –
Hydrostatic balance method
ASTM-D-792 Specific gravity and density of
plastics by displacement
DIN 53479 Testing of plastics and
elastomers; determination of
density
Pro kapaliny
ISO 901 ISO 758
DIN 51757 Testing of mineral oils and
related materials; determination
of density
ASTM D 941-55, ASTM D 1296-67 a ASTM D 1481-62
ASTM D 1298 Density, specific gravity or API
gravity of crude petroleum and
liquid petroleum products by
hydrometer method
BS 4714 Density, specific gravity or
API gravity of crude petroleum
and liquid petroleum products by
hydrometer method
1.3 Metoda ponořené kuličky
DIN 53217 Testing of paints, varnishes and
similar coating materials;
determination of density;
immersed body method
2. PYKNOMETRICKÉ METODY
2.1 Pro kapaliny
ISO 3507 Pycnometers
ISO 758 Liquid chemical products;
determination of density at 20 st.C
DIN 12797 GayLussac pycnometer (for non-
volatile liquids which are not
too viscous)
DIN 12798 Lipkin pycnometer (for liquids
with a kinematic viscosity of
less than 100*10
-6
m2*s-1
at
15 st.C) DIN 12800 Sprengel pycnometer (for liquids
as DIN 12798)
DIN 12801 Reischauer pycnometer (for
liquids with a kinematic
viscosity of less than
100*10
-6
m2*s-1
at 20 st.C,
applicable in particular also to
hydrocarbons and aqueous
solutions as well as to liquids
with higher vapour pressure,
approximately 1 bar at 90 st.C) DIN 12806 Hubbard pycnometer (for viscous
liquids of all types which do not
have too high a vapour pressure,
in particular also to paints,
varnishes and bitumen)
DIN 12807 Bingham pycnometer (for liquids,
as in DIN 12801)
DIN 12808 Jaulmes pycnometer (in particular
for ethanol – water mixture)
DIN 12809 Pycnometr with groundin
thermometer and capillary side
tube (for liquids which are not
too viscous)
DIN 53217 Testing of paints, varnishes and
similar products; determination
of density by pycnometer
DIN 51757 Point 7: Testing of mineral oils
and related materials;
determination of density
ASTM D 297 Section 15: Rubber Products –
Chemical Analysis
ASTM D 2111 Method C: Halogenated organic
compounds
BS 4699 Method for determination of
specific gravity and density of
petroleum products (graduated
bicapillary pycnometer method)
BS 5903 Method for determination of
relative density and density of
petroleum products by the
capillary – stoppered pycnometer
method
NF T 20053 Chemical products for industrial
use – Determination of density of
solids in powder and liquids –
Pycnometric method
2.2 Pro tuhé látky:
ISO 1183 Method B: Methods for determining
the density and relative density
of plastics excluding cellular
plastics
NF T 20053 Chemical products for industrial
use – Determination of density of
solids in powder and liquids –
Pycnometric method
DIN 19683 Determination of the density of
soils
3. VZDUCHOVÉ SROVNÁVACÍ PYKNOMETRY
DIN 55990 Part 3: Prüfung von
Anstrichstoffen und ähnlichen
Beschichtungsstoffen; Pulverlack;
Bestimmung der Dichte
DIN 53243 Anstrichstoffe; Chlorhaltige
Polymere; Prüfung
IV. METODY PRO STANOVENí TLAKU PAR – METODY UVEDENÉ V BODU
A.4 PŘÍLOHY SMĚRNICE 92/69/EHS
IV.1 METODA
Většina dále popsaných metod je založena na Pokynech
OECD pro zkoušení (1). Jejich základní principy jsou
uvedeny v literatuře (2) a (3).
IV.1.1 ÚVOD
Pro provádění zkoušky je užitečné mít předběžné
informace o struktuře, bodu tání a bodu varu zkušební
látky.
Neexistuje žádný postup vhodný pro celý rozsah tlaku
par. Proto je pro měření tlaku par v rozmezí od
<10
-4
Pa do 105
Pa doporučeno několik metod.
Nečistoty mají obvykle na tlak par vliv, a to
v rozsahu, který do značné míry závisí na druhu
nečistoty. Jsouli ve vzorku přítomny těkavé nečistoty, které by
mohly ovlivnit výsledek, může být látka přečištěna.
Může být vhodné uvést tlak par technického materiálu.
U některých zde popsaných metod se užívají přístroje
s kovovými díly. Tato skutečnost by měla být vzata
v úvahu při zkoušení korozivních látek.
IV.1.2 DEFINICE A JEDNOTKY
Závislost tlaku par na teplotě je popsána
ClausiovouClapeyronovou rovnicí:
Tlak par látky je definován jako tlak nasycené páry nad
tuhou nebo kapalnou látkou. Při termodynamické
rovnováze je tlak par čisté látky pouze funkcí teploty.
Jednotkou tlaku v soustavě SI je pascal (Pa).
Dále jsou uvedeny některé dříve používané jednotky
s odpovídajícími přepočítávacími faktory:
1 torr (= 1 mm Hg) = 1,333*10
2
Pa 1 fyzikální atmosféra (atm) = 1,013*10
5
Pa 1 bar = 10
5
Pa Jednotkou termodynamické teploty v soustavě SI je
kelvin (K).
Univerzální molární plynová konstanta R má hodnotu
8,314 J*mol
-1
*K-1
.
delta Hv
log p = ---------- + konst.
2,3 RT
kde
p = tlak par látky v Pa,
delta H
v
= výparné teplo v J*mol-1
, R = univerzální molární plynová konstanta
v J*mol
-1
*K -1
, T = termodynamická teplota v K.
IV.1.3 REFERENČNÍ LÁTKY
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
IV.1.4 PODSTATA ZKUŠEBNÍCH METOD
Pro stanovení tlaku par je navrženo sedm metod, které
lze používat v různých oblastech hodnot tlaku par.
Každou z metod se stanovuje tlak par při různých
teplotách. V omezeném rozsahu teplot je logaritmus
tlaku par čisté látky nepřímo úměrný teplotě.
IV.1.4.1 Dynamická metoda
Při dynamické metodě se měří teplota varu při daném
tlaku.
Doporučený rozsah:
10
3
až 105
Pa, Tato metoda se rovněž doporučuje pro stanovení bodu
varu a je vhodná až do teploty 600 K.
IV.1.4.2 Statická metoda
Statickou metodou se měří tlak par, který se ustaví při
termodynamické rovnováze v uzavřeném systému při dané
teplotě. Tato metoda je vhodná pro jednosložkové i
vícesložkové tuhé látky a kapaliny.
Doporučený rozsah:
10 až 10
5
Pa Při potřebné pečlivosti lze tuto metodu použít také pro
oblast od 1 do 10 Pa.
IV.1.4.3 Isoteniskop
Tato normalizovaná metoda je rovněž statickou metodou,
obecně však není vhodná pro vícesložkové systémy.
Bližší informace lze získat v metodě ASTM D287986.
Doporučený rozsah:
100 až 10
5
Pa.IV.1.4.4 Efusní metoda: Váhy pro měření tlaku par
Ve vakuu se stanoví množství látky, které opustí měřicí
celu za časovou jednotku otvorem známé velikosti tak,
že může být zanedbán návrat látky do měřicí cely (např.
měřením impulsů generovaných prouděním par na citlivých
vahách nebo stanovením ztráty hmotnosti).
Doporučený rozsah:
10
-3
až 1 Pa.IV.1.4.5 Efusní metoda: Měření hmotnostního úbytku nebo
měření záchytem parní fáze
Metoda je založena na stanovení hmotnosti par zkušební
látky unikající za jednotku času z Knudsenovy komůrky
(4) mikrodýzou za podmínek vysokého vakua. Hmotnost
difundujících par může být zjištěna buď stanovením
úbytku hmotnosti komůrky, nebo kondenzací par při nízké
teplotě a stanovením jejich množství chromatografickou
analýzou. Tlak se vypočte za použití Herzovy-Knudsenovy
rovnice.
Doporučený rozsah:
10
-3
až 1 PaIV.1.4.6 Metoda nasycení plynu
Nad látkou se vede proud inertního nosného plynu tak,
že se nasytí jejími parami. Množství látky, které se
přenese známým množstvím nosného plynu, lze stanovit
zachycením ve vhodném lapači nebo průtokovou
analytickou technikou. Z něho se vypočte tlak par při
dané teplotě.
Doporučený rozsah:
10
-4
až 1 Pa. Při potřebné pečlivosti lze tuto metodu použít také pro
oblast od 1 do 10 Pa.
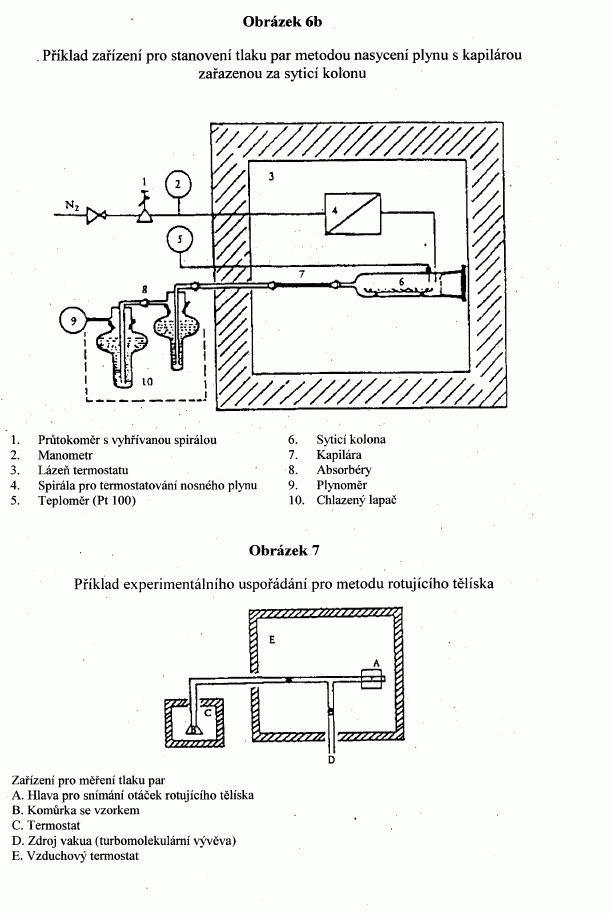
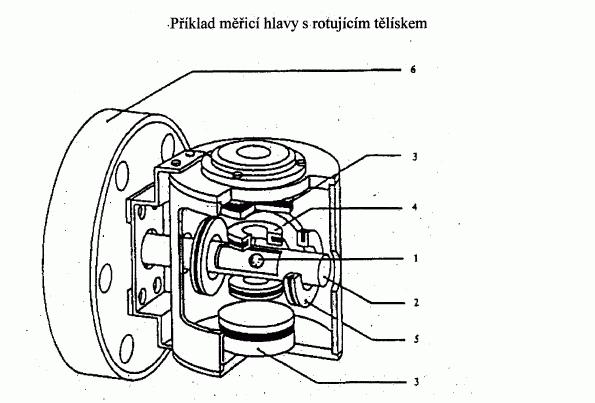
IV.1.4.7 Rotující tělísko
V zařízení s rotujícím tělískem je měřicím prvkem malá
ocelová kulička zavěšená v magnetickém poli, která
vysokou rychlostí rotuje. Tlak plynu se odvozuje ze
zpomalení ocelové kuličky, které je závislé na tlaku
plynu.
Doporučená oblast měření:
10
-4
až 0,5 Pa.IV.1.5 KRITÉRIA JAKOSTI
V následující tabulce je uvedeno srovnání různých metod
stanovení tlaku par z hlediska jejich použitelnosti,
opakovatelnosti, reprodukovatelnosti, oblasti měření a
existujících norem.
KRITÉRIA JAKOSTI
-------------------------------------------- -------------------------------------------
Metoda Látky Odhad Odhad Doporučená Existující
měření opakovatelnosti1) reprodukovatelnosti1) oblast norma
--------------
tuhé kapalné
-------------------------------------------- -------------------------------------------
1.4.1 s ano do 25 % do 25 % 103 Pa až —
Dynamická nízkým 2 × 103 Pa
metoda bodem 1 až 5 % 1 až 5 % —
tání 2 × 103 Pa
až 105
Pa2)
-------------------------------------------- -------------------------------------------
1.4.2 ano ano 5 až 10 % 5 až 10 % 10 Pa až NF T
Statická 105 Pa2) 20048(5)
metoda
-------------------------------------------- -------------------------------------------
1.4.3 ano ano 5 až 10 % 5 až 10 % 102 Pa až ASTMD
Isoteniskop 105 Pa 287986
-------------------------------------------- -------------------------------------------
1.4.4 ano ano 5 až 20 % do 50 % 10-3 Pa až NF T
Efusní 1 Pa 20047(6)
metoda -
váhy pro
měření
tlaku par
-------------------------------------------- -------------------------------------------
1.4.5 ano ano 10 až 30 % — 10-3 Pa až —
Efusní 1 Pa
metoda -
měření
úbytku par
-------------------------------------------- -------------------------------------------
1.4.6 ano ano 10 až 30 % do 50 % 10-4 Pa až —
Metoda 1 Pa2)
sycení
plynu
-------------------------------------------- -------------------------------------------
1.4.7 ano ano 10 až 20 % — 10-4 Pa až —
Metoda 0,5 Pa
rotujícího
tělíska
-------------------------------------------- -------------------------------------------
1) V závislosti na stupni čistoty látky.
2) Metody mohou být při pečlivém provedení použity také pro rozmezí 1 až 10 Pa.
IV.1.6 POPIS METOD
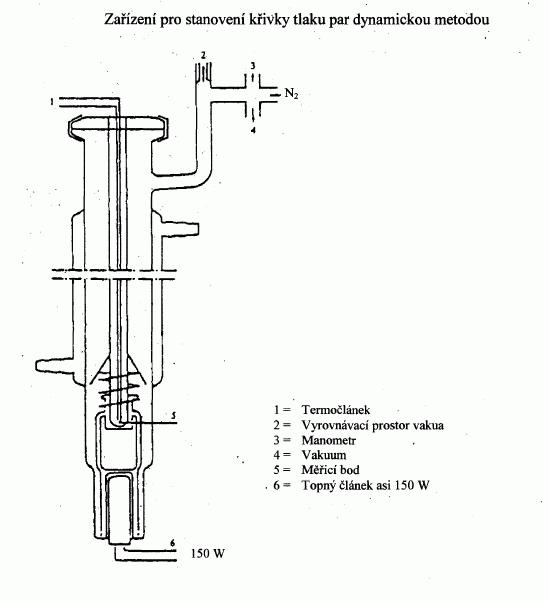
IV.1.6.1 Dynamická metoda
IV.1.6.1.1 Aparatura
Aparatura je obecně tvořena varnou nádobou s nasazeným
chladičem ze skla nebo kovu (obrázek l), zařízením pro
měření teploty, zařízením pro regulaci a měření tlaku.
Typická měřicí aparatura znázorněná na obrázku je ze
žáruvzdorného skla a skládá se z pěti částí:
Velká, částečně dvojitě oplášťovaná trubice sestává ze
zábrusového spoje, z chladiče, z chladicí baňky a ze
vpusti.
Skleněný válec s Cottrellovou vývěvou je umístěn ve
varné část trubice a má zdrsněný vnitřní povrch ze
slinutého skla, aby se zabránilo „utajenému“ varu.
Teplota se měří vhodným teplotním čidlem (např.
odporovým teploměrem, plášťovým termočlánkem) zasunutým
do aparatury až k místu měření (obrázek 1, číslo 5)
přes vhodnou spojku (např. s vnějším zábrusem).
Musí být vytvořeno nezbytné spojení k regulátoru tlaku
a k měřicímu zařízení.
Přes kapiláru je s měřicí aparaturou spojena kulatá
baňka, která slouží jako vyrovnávací objem.
Varná nádoba je vyhřívána topnou vložkou např.
zavedenou zespoda do skleněné aparatury. Požadovaná
intenzita proudu pro ohřev se nastavuje a reguluje
prostřednictvím termočlánku.
Potřebný podtlak mezi 10
2
Pa a přibližně 105
Pa se
dosáhne pomocí vývěvy. K měření a regulaci tlaku vzduchu nebo dusíku (měřicí
rozsah přibližně 10
2
až 105
Pa) a k ventilaci se
použije vhodný ventil. Tlak se měří manometrem.
IV.1.6.1.2 Postup měření
Pro stanovení tlaku par vzorku se měří jeho teplota
varu při různých specifikovaných tlacích mezi asi 10
3
a
105
Pa. Ustálení teploty při konstantním tlaku znamená,
že bylo dosaženo teploty varu. Tato metoda není vhodná
pro měření látek, které pění. Látka se umístí do čisté, suché vzorkovnice. Při plnění
tuhých látek, které nejsou ve formě prášku, může dojít
k problémům, které však lze někdy obejít zahřátím
chladicího pláště. Po naplnění se aparatura uzavře
přírubou a látka se odplyní. Poté se nastaví nejnižší
požadovaný tlak a zapne se ohřev. Současně se teplotní
čidlo připojí k zapisovači.
Rovnováhy je dosaženo, je-li při konstantním tlaku
zaznamenána konstantní teplota varu. Je třeba věnovat
zvláštní pozornost tomu, aby se zabránilo prudkému
uvolňování par během varu. Navíc musí dojít k úplné
kondenzaci v chladiči. Při stanovování tlaku par u
nízkotajících pevných látek je třeba dbát na to, aby
nedošlo k ucpání chladiče.
Po zaznamenání naměřeného rovnovážného teplotního bodu
se nastaví vyšší tlak. Takto se pokračuje, dokud se
nedosáhne tlaku 10
5
Pa (celkem asi 5 až 10 měření). Pro
kontrolu se musí stanovení rovnovážných bodů opakovat
při klesajících hodnotách tlaku.IV.1.6.2 Statické měření
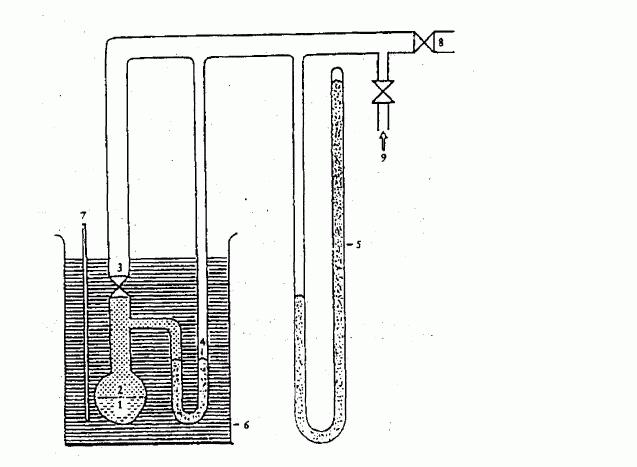
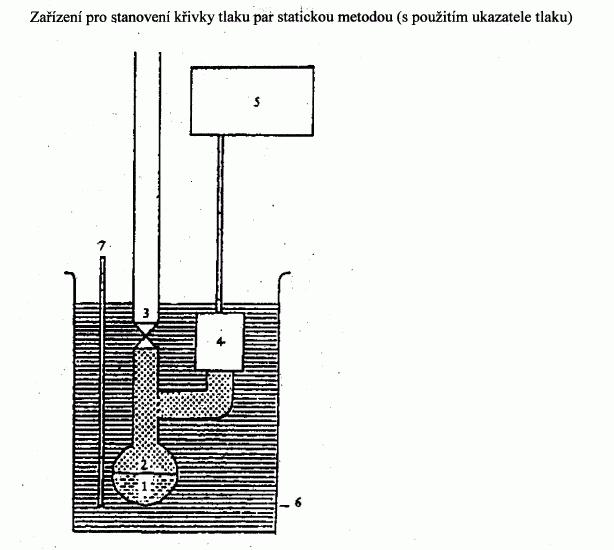
IV.1.6.2.1 Aparatura
Aparatura sestává ze zásobníku vzorku, z ohřívací a
chladicí soustavy k regulaci teploty vzorku a měření
teploty. Aparatura též zahrnuje zařízení k nastavení a
měření tlaku. Základní principy jsou znázorněny na
obrázcích 2a a 2b.
Baňka na vzorek (obrázek 2a) je z jedné strany uzavřena
vhodným vysokovakuovým ventilem. Z druhé strany je
připojena Utrubice obsahující vhodnou manometrickou
kapalinu. Jeden konec Utrubice je napojen k vývěvě,
k tlakové lahvi s dusíkem, nebo k odvzdušňovacímu
ventilu a k manometru.
Místo Utrubice se dá použít manometr s ukazatelem
tlaku (obrázek 2b).
Za účelem regulace teploty vzorku je baňka se vzorkem
spolu s ventilem a Utrubicí či tlakoměrem umístěna
v lázni s konstantní teplotou udržovanou s přesností +/-
0,2 K. Teplota se měří na vnější straně baňky se
vzorkem nebo v baňce samotné.
K evakuaci aparatury se užije vývěva s protiproudým
chlazeným lapačem.
U metody 2a se tlak par látky měří nepřímo za použití
indikátoru nuly. Přitom se zohledňuje skutečnost, že se
hustota kapaliny při velkých změnách teploty
v Utrubici mění.
V závislosti na rozsahu tlaků a v závislosti na
chemickém chování zkušební látky jsou jako indikátory
nuly pro Utrubici vhodné následující látky: silikonové
oleje, ftaláty. Zkušební látka se nesmí znatelně
rozpouštět ani nesmí reagovat s kapalinou v Utrubici.
V oblasti normálního tlaku vzduchu do 10
2
Pa lze
v manometru používat rtuť, zatímco silikonové oleje a
ftaláty je vhodné používat pro tlak od 10 Pa do 102
Pa.
Ohřívatelné membránové kapacitní manometry lze dokonce
používat pro tlak nižší než 10-1
Pa. Existují též jiná
měřidla tlaku, která lze použít pro tlaky pod 102
Pa.IV.1.6.2.2 Postup měření
Před měřením se všechny části aparatury znázorněné na
obrázku 2 důkladně očistí a vysuší.
V případě metody 2a se Utrubice naplní zvolenou
kapalinou, která musí být před použitím odplyněna za
zvýšené teploty.
Zkušební látka se vloží do aparatury, která se uzavře a
sníží se v ní teplota, aby došlo k odplynění. Teplota
musí být dostatečně nízká, aby se zajistilo vysátí
vzduchu, aniž by došlo u vícesložkových směsných
materiálů ke změně jejich složení, V případě potřeby
lze rovnováhy rychleji dosáhnout mícháním.
Vzorek může být podchlazen např. kapalným dusíkem (je
nutno zabránit kondenzaci vzduchu nebo kapaliny
z vývěvy) nebo směsí ethylalkoholu a suchého ledu. Pro
měření nízkých teplot se použije lázeň s teplotou
regulovanou připojením k chladicímu systému
(ultrakryomatu).
Při otevřeném ventilu nádoby se vzorkem se připojí na
několik minut odsávání, aby se odstranil vzduch. Ventil
se poté uzavře a teplota vzorku se sníží na nejnižší
požadovanou úroveň. Je-li to nutné, musí se odplyňovací
postup několikrát opakovat.
Při zahřívání vzorku roste tlak par. To mění rovnováhu
kapaliny v Utrubici. Aby se změna kompenzovala,
připouští se ventilem dusík nebo vzduch do té doby,
dokud není indikátor tlaku opět na nule. Tlak potřebný
k ustavení nulové hodnoty může být odečten přesným
manometrem při laboratorní teplotě. Tento tlak odpovídá
tenzi par látky při dané teplotě měření.
Metoda 2b je podobná, ale tlak par se odečítá přímo.
Závislost tlaku par na teplotě se stanoví ve vhodných
krátkých intervalech (celkem přibližně 5 až 10 bodů
měření) až do požadovaného maxima. Odečty při nízkých
teplotách se musí pro kontrolu opakovat.
Neleží-li hodnoty zjištěné z opakovaných odečtů na
křivce zjištěné pro zvyšující se teplotu, může to být
způsobeno jednou z těchto příčin:
1. Vzorek stále obsahuje vzduch (např. u vysoce
viskózních materiálů) nebo obsahuje látky
s nízkým bodem varu, které jsou při zahřátí
uvolňovány a které lze odstranit odsátím po
předchozím podchlazení.
2. Teplota podchlazení není dostatečně nízká.
V tomto případě se použije jako chladicí médium
tekutý dusík.
Pokud nastane případ 1 nebo 2, musí se měření
opakovat.
3. V látce probíhá ve vyšetřovaném teplotním rozsahu
chemická reakce (např. rozklad, polymerace).
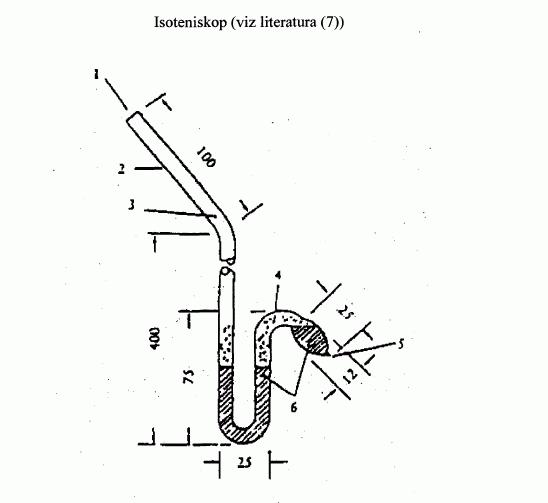
IV.1.6.3 Isoteniskop
Úplný popis této metody je uveden v literatuře (7).
Princip měřicího zařízení je znázorněn na obrázku 3.
Podobně jako statická metoda popsaná v bodě 1.6.2 je
isoteniskop vhodný k vyšetřování tuhých látek i
kapalin.
V případě kapalin slouží látka samotná jako indikační
sloupec v pomocném manometru. Do isoteniskopu se odměří
množství kapaliny postačující k naplnění baňky a
krátkého ramene manometru. Isoteniskop se připojí
k vakuovému systému, evakuuje se a poté se naplní
dusíkem. Evakuace a výplach systému se opakuje dvakrát,
aby se odstranil veškerý zbytkový kyslík. Naplněný
isoteniskop se umístí do horizontální polohy, aby se
vzorek rozprostřel v baňce a v Učásti manometru do
tenké vrstvy. Tlak v systému se sníží na 133 Pa a
vzorek se opatrně zahřeje právě k varu (odstranění
rozpuštěných plynů). Poté se isoteniskop vrátí do
původní polohy tak, aby se vzorek vrátil do baňky a
krátkého ramene manometru, takže oba díly jsou zcela
naplněny kapalinou. Tlak se udržuje jako při
odplyňování; špička baňky se zahřívá malým plamenem,
dokud uvolněná pára neexpanduje natolik, že přetlačí
část vzorku z horní části baňky a ramene manometru do
manometrické části isoteniskopu, přičemž se vytvoří
prostor bez dusíku, naplněný výhradně parami.
Isoteniskop se poté vloží do lázně se stálou teplotou a
tlak dusíku se upraví tak, aby se rovnal tlaku vzorku.
Rovnovážný tlak je udáván manometrickou částí
isoteniskopu. V rovnováze se rovná tlak dusíku tenzi
par látky.
U tuhých látek se v závislosti na oblasti tlaku a
teploty používají manometrické kapaliny uvedené v bodě
1.6.2.1. Odplyněná manometrická kapalina se naplní do
rozšířené části dlouhého ramene isoteniskopu. Poté se
vyšetřovaná látka naplní do baňky a odplyní se při
zvýšené teplotě. Isoteniskop se poté nakloní, aby
manometrická kapalina natekla do Utrubice. Měření
závislosti tlaku par na teplotě se provede jako v bodě
1.6.2.
IV.1.6.4 Efusní metoda: Váhy pro měření tlaku par
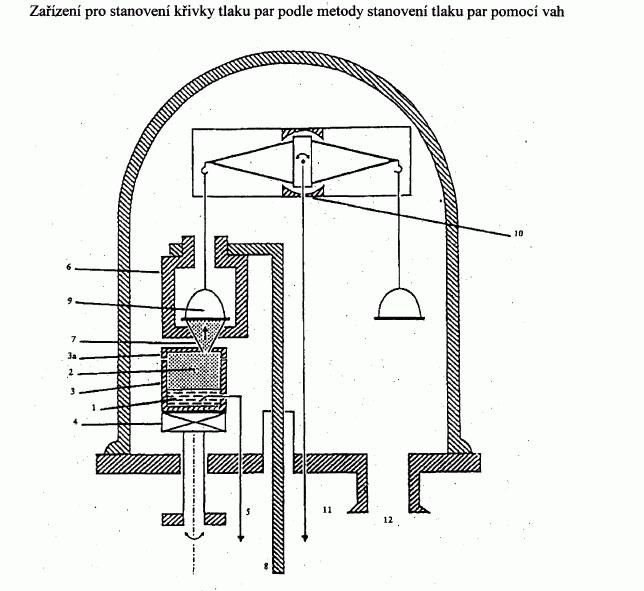
IV.1.6.4.1 Aparatura
V literatuře jsou popsána různá provedení aparatury
(1). Aparatura popsaná zde slouží ke znázornění
použitého obecného principu (obrázek 4). Na obrázku 4
jsou znázorněny hlavní části aparatury složené
z vysokovakuové komory z korozivzdorné oceli nebo ze
skla, z vývěvy a měřiče vakua a z vestavěného zařízení
pro měření tlaku par pomocí vah. V aparatuře jsou
vestavěny následující díly:
— odpařovací pícka s přírubou a otočnou průchodkou.
Odpařovací pícku tvoří válcová nádoba vyrobená
např. z mědi nebo z chemicky odolné slitiny
s dobrou tepelnou vodivostí. Rovněž lze použít
skleněnou nádobu opatřenou měděným pláštěm. Pícka
má průměr přibližně 3 až 5 cm a je 2 až 5 cm
vysoká. Je opatřena jedním až třemi otvory různé
velikosti pro průchod par. Pícka je vyhřívána buď
podstavenou vyhřívací destičkou nebo topnou
spirálou v plášti. Aby nedošlo k rozptylování
tepla do základní desky, je spojení vyhřívací
destičky se základní realizováno deskou přes
materiál s nízkou tepelnou vodivostí
(stříbroniklová nebo chromniklová ocel); je-li
např. použita pícka s několika průchody, je
izolace tvořena stříbroniklovými trubicemi
připojenými k rotující ose pícky. Toto uspořádání
je výhodné, neboť umožňuje zavedení měděné tyče.
Je tím umožněno chlazení z vnějšku chladicí
lázní,
— jeli měděné víko pícky opatřeno třemi otvory
různého průměru, jejichž poloha je posunuta vůči
sobě o 90°, pokrývá měření široký rozsah tlaků
par (otvory o průměru 0,30 až 4,50 mm). Široké
otvory se použijí při nízkých tlacích par a
naopak. Otáčením pícky se žádaný otvor nebo
mezipoloha nastaví do směru toku páry (v ose se
nachází otvor pícky – clona – miska vah) a proud
molekul se propustí nebo odkloní otvorem pícky na
misku vah. Pro měření teploty látky se na vhodné
místo umístí termočlánek nebo odporový teploměr,
— nad clonou je miska velmi citlivých mikrovah (viz
níže). Miska vah má průměr přibližně 30 mm.
Vhodným materiálem je pozlacený hliník,
— miska vah je obklopena válcovitým chladicím
blokem z mosazi nebo mědi. Otvory v bloku jsou
přizpůsobeny typu raménka podle typu vah a otvor
ve cloně musí umožnit průchod proudu molekul a
současně musí zajišťovat úplné zkapalnění par na
misce. Odvod tepla směrem ven je zajištěn např.
měděnou tyčí připojenou k chladicímu bloku. Tyč
prochází základní deskou a je od ní tepelně
izolována např. trubicí z chromniklové oceli. Tyč
je ponořena do Dewarovy nádoby s kapalným dusíkem
umístěné pod základní deskou a/nebo se zajistí
cirkulace kapalného dusíku přímo provrtanou tyčí.
Chladicí blok je tak udržován při teplotě
-120 st.C. Miska vah je chlazena výhradně
vyzařováním, které pro vyšetřovanou oblast tlaku
postačuje (zahájení chlazení přibližně 1 h před
začátkem měření),
— váha je umístěna nad chladicím blokem. Vhodné
váhy jsou např. vysoce citlivé dvojramenné
elektronické mikrováhy nebo vysoce citlivý
přístroj s pohyblivou cívkou (viz Pokyny OECD pro
zkoušení 104, vydání 12.5.1981),
— v základní desce jsou také elektrické zásuvky pro
připojení termočlánků (nebo odporových teploměrů)
a topných spirál,
— vakuum se vytváří v nádobě pomocí středněvakuové
nebo vysokovakuové pumpy (požadované vakuum
přibližně 1 až 2*10
-3
Pa, kterého se dosáhne po
dvouhodinovém odsávání). Tlak se sleduje vhodným
ionizačním manometrem.IV.1.6.4.2 Postup měření
Nádoba se naplní zkušební látkou a uzavře se víčkem.
Clona a chladicí blok jsou vysunuty proti pícce.
Aparatura se uzavře a spustí se vývěvy. Před zahájením
měření by měl být tlak asi 10
-4
Pa. Od 10-2
Pa je třeba
začít s chlazením chladicího bloku.
Po dosažení potřebného vakua se zahájí řada
kalibračních měření při nejnižší požadované teplotě.
Otevře se odpovídající otvor ve víku, proud páry projde
clonou umístěnou nad ním a dopadne na ochlazovanou
misku vah. Miska vah musí být dostatečně velká, aby
zajistila zachycení veškeré páry procházející clonou.
Hybnost proudu par působí jako síla proti misce vah a
molekuly se srážejí na jejím studeném povrchu.Hybnost a současná kondenzace vytvářejí signál
v zapisovači. Vyhodnocení signálu poskytuje dva druhy
informací:
1. V popsaném zařízení je tlak par určen přímo
z působení na misku vah (k tomu není třeba znát
molekulovou hmotnost (2)). Při vyhodnocení odečtu
musí být vzaty v úvahu geometrické faktory, jako
jsou otvor v pícce a úhel molekulárního proudu.
2. Současně může být měřeno množství kondenzátu,
z čehož může být vypočtena rychlost vypařování.
Tlak par může být také vypočítán z rychlosti
vypařování a z molekulové hmotnosti pomocí
Hertzovy rovnice (2).
2 píRT x 10 3
p = G odmocnina --------------------
M
kde
G = rychlost vypařování (kg*s
-1
*m-2
), M = molekulová hmotnost (g*mol
-1
), T = termodynamická teplota (K),
R = univerzální molární plynová konstanta
(J*mol
-1
*K-1
), p = tlak páry (Pa).
Poté, co je dosaženo potřebného vakua, začíná série
měření při nejnižší možné teplotě.
Pro další měření se teplota zvyšuje v malých
intervalech, dokud se nedosáhne její nejvyšší
požadované hodnoty. Vzorek se poté znovu ochladí a je
možné zaznamenat druhou křivku tlaku par. Jestliže se
při druhém opakování nepotvrdí výsledek prvního měření,
je možné, že se látka v dané teplotní oblasti měření
rozkládá.
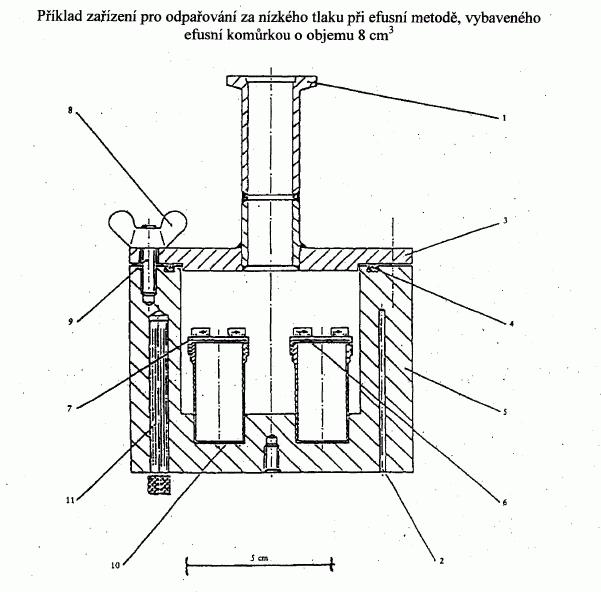
IV.1.6.5 Efusní metoda: Měření hmotnostního úbytku
IV.1.6.5.1 Aparatura
Zařízení se skládá z následujících částí:
— blok, ve kterém jsou umístěny efusní komůrky,
s možností termostatování a evakuace,
— vysokovakuová vývěva (např. difusní vývěva nebo
turbomolekulární vývěva) a podtlakové měřidlo,
— zařízení pro zachycování par se zkapalněným
dusíkem nebo suchým ledem.
Elektricky vyhřívaný hliníkový vakuový blok se čtyřmi
ocelovými efusními komůrkami je znázorněn jako příklad
na obrázku 5. Membrána z korozivzdorné oceli tloušťky
asi 0,3 mm s efusním otvorem o průměru 0,2 až 1 mm je
připojena k efusní komůrce víčkem opatřeným závitem.
IV.1.6.5.2 Postup měření
Do každé efusní komůrky se umístí referenční a zkušební
látka, kovová membrána s otvorem se zajistí šroubovacím
víčkem a každá komůrka se zváží s přesností na 0,1 mg.
Měřicí komůrka se umístí do termostatovaného bloku,
který se poté evakuuje na tlak nižší, než je jedna
desetina očekávaného tlaku par. Ve stanovených časových
intervalech v rozmezí od 5 do 30 h se do zařízení
vpouští vzduch a úbytek hmotnosti efusní komůrky se
stanoví opakovaným vážením.
Aby bylo zajištěno, že výsledky nebudou ovlivněny
těkavými nečistotami, váží se komůrka opakovaně ve
stanovených časových intervalech a tak se kontroluje,
zda je rychlost odpařování konstantní nejméně po dva
měřicí intervaly.
Tlak par p je dán vztahem:
m 2pí RT
p = ---- odmocnina ---------
KAt M
kde
p = tlak par (Pa),
m = hmotnost látky opouštějící komůrku za čas t (kg),
t = čas (s),
A = plocha otvoru (m
2
), K = korekční faktor,
R = univerzální plynová konstanta (J*mol
-1
*K-1
), T = teplota (K),
M = molekulární hmotnost (kg*mol
-1
). Korekční faktor K závisí na poměru délky a poloměru
kruhového otvoru:
poměr: 0,1 0,2 0,6 1,0 2,0
K: 0,952 0,909 0,771 0,672 0,514
Výše uvedená rovnice může být zapsána ve tvaru
m T
p = E -- odmocnina ---
t M
kde
1
E = ---- odmocnina 2pí R je efusní konstanta komůrky.
KA
Tato efusní konstanta může být určena s využitím
referenčních látek (2, 9) pomocí následující rovnice:
p(r)t M(r)
E = ----- odmocnina ----
m T
p(r) = tlak par referenční látky (Pa)
M(r) = molekulární hmotnost referenční látky (kg*mol-1).
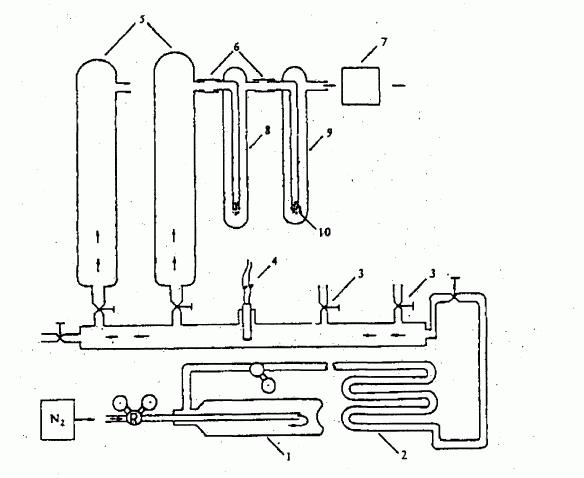
IV.1.6.6. Metoda nasycení plynu
IV.1.6.6.1 Aparatura
Typická aparatura používaná pro tuto zkoušku sestává
z řady dále popsaných a na obrázku 6a vyobrazených
částí (1).
Inertní plyn:
Nosný plyn nesmí se zkušební látkou chemicky reagovat.
Obvykle je vhodný dusík, někdy je však nutné použít
jiné plyny (10). Použitý plyn musí být suchý
(viz obrázek 6a, číslo 4: čidlo pro měření relativní
vlhkosti plynu).
Kontrola průtoku:
Pro kontrolu průtoku plynu je nezbytný vhodný regulační
systém pro zajištění konstantního a podle potřeby
nastavitelného průtoku plynu syticí kolonou.
Zařízení pro zachycování par:
Jejich výběr závisí na vlastnostech zkoumané látky a na
zvolené analytické metodě. Páry by se měly zachycovat
kvantitativně a ve formě, která umožní následnou
analýzu. Pro některé zkušební látky jsou vhodné lapače
obsahující kapaliny jako hexan nebo ethylenglykol. Pro
jiné látky lze použít tuhé absorbenty.
Jako alternativní metody zachycení páry a následné
analýzy mohou být ke stanovení množství hmoty
transportované známým množstvím nosného plynu použity
průtokové analytické techniky, jako je chromatografie.
Navíc může být měřen úbytek hmotnosti vzorku.
Výměník tepla:
Pro měření při různých teplotách může být nezbytné
zabudovat do aparatury výměník tepla.
Syticí kolona:
Zkušební látka se v rozpuštěné formě nanese na vhodný
inertní nosič. Nosič s nanesenou látkou se vloží do
sytící kolony. Kolona by měla být dimenzována a průtok
plynu nastaven tak, aby bylo zaručeno úplné nasycení
nosného plynu. Kyticí kolonu je nutno termostatovat. Má-
li se měřit při teplotách nad laboratorní teplotou,
musí být části aparatury mezi sytící kolonou a
zařízeními pro zachycování par rovněž ohřívány, aby se
zamezilo kondenzaci zkušební látky.
Za sytič kolony může být umístěna kapilára
(obrázek 6b), aby se snížil tok hmoty způsobený difůzí.
IV.1.6.6.2 Postup měření
Příprava sytící kolony:
Roztok zkušební látky ve vysoce těkavém rozpouštědle se
přidá k přiměřenému množství nosiče. Mělo by být
přidáno dostatečné množství zkušební látky, aby bylo
zajištěno nasycení po celou dobu zkoušky. Rozpouštědlo
se úplně odpaří na vzduchu nebo v rotačním odpařovači a
pečlivě promísený materiál se přidá do sytící kolony.
Po zahřátí vzorku se aparaturou vede suchý dusík.
Měření:
Zařízení na zachycování par nebo průtokové detektory se
připojí na výstup z kolony a měří se čas. Na počátku a
v pravidelných intervalech během měření se kontroluje
průtok počítačem bublinek (nebo kontinuálně
průtokoměrem).
Na výstupu ze sytící kolony je nutno měřit tlak. To lze
provést
a) zapojením manometru mezi kolonu a lapače (tento
způsob nemusí být zcela uspokojivý, protože se
zvyšuje mrtvý objem a zvětšuje se adsorpční
plocha); nebo
b) stanovením tlakových úbytků za použitým
zachycovacím zařízením jako funkce objemového
průtoku v samostatném experimentu (toto nemusí
přinášet uspokojivé výsledky pro lapače
s absorpčními kapalinami).
Doba potřebná pro zachycení množství látky nezbytného
pro jednotlivé metody analýzy se určí předběžnými
pokusy nebo odhadem. Jako alternativa zachycení látky
pro další analýzu může být užita průtoková
kvantitativní analytická technika (např.
chromatografie). Před výpočtem tlaku par při dané
teplotě se provedou předběžné pokusy pro stanovení
maximální průtokové rychlosti, při které je nosný plyn
dokonale nasycen parami látky. Za tímto účelem se
zavádí nosný plyn do sytící kolony nízkým objemovým
průtokem voleným tak, že dalším snižováním průtokové
rychlosti již vypočtená hodnota tlaku par neroste.
Specifická analytická metoda závisí na druhu studované
látky (např. plynová chromatografie nebo gravimetrie).
Stanoví se množství látky, které je unášeno známým
objemem nosného plynu.
IV.1.6.6.3 Výpočet tlaku par
Tlak par se počítá z hustoty par, W/V, podle rovnice:
W RT
p = --- x ---
V M
kde
p = tlak par (Pa),
W = hmotnost odpařené zkušební látky (g),
V = objem nasyceného plynu (m3),
R = univerzální molární plynová konstanta
(J*mol-1*K-1),
T = termodynamická teplota (K),
M = molární hmotnost (g*mol-1).
Naměřené objemy musí být korigovány v důsledku rozdílů
tlaků a teplot mezi průtokoměrem a sytící kolonou
vyhřívanou termostatem. Je-li průtokoměr zařazen za
lapači, může být nezbytné provést korekce s ohledem na
podíl složek odpařených z lapače (1).
IV.1.6.7 Rotující tělísko (8, 11, 13)
IV.1.6.7.1 Aparatura
Metoda rotujícího tělíska může být provedena za použití
měřiče viskozity s rotujícím tělískem, znázorněného na
obrázku 8. Schematický nákres měřicí soustavy je
znázorněn na obrázku 7.
Typické měřicí zařízení má měřicí hlavu s rotujícím
tělískem, umístěnou v termostatovaném prostoru
(regulovaném s přesností na 0,1 st.C). Nádobka se vzorkem
je umístěna do termostatovaného prostoru (regulovaného
s přesností na 0,01 st.C). Všechny ostatní části zařízení
jsou udržovány při vyšší teplotě, aby nedocházelo ke
kondenzaci. K zařízení se vakuovými ventily připojí
vysokovakuová vývěva.
Měřicí hlava s rotujícím tělískem se skládá z ocelové
kuličky (průměr 4 až 5 mm) umístěné v trubici. Kulička
je zavěšena a stabilizována v magnetickém poli obvykle
s využitím kombinace permanentních magnetů a
regulačních cívek.
Kulička je uváděna do rotačního pohybu rotujícími
magnetickými poli produkovanými cívkami. Zvedací cívky
měřící nízkou, ale trvalou zbytkovou magnetizaci
kuličky, umožňují měření rotační rychlosti.
IV.1.6.7.2 Postup měření
Jakmile kulička dosáhne stanovenou rotační rychlost
v(0) (obvykle asi 400 otáček za sekundu), zastaví se
další napájení a zahájí se zpomalování vyvolané
brzdicím účinkem plynu.
Pokles rotační rychlosti je měřen jako funkce času.
Vzhledem k tomu, že brzdění způsobené magnetickým
závěsem je zanedbatelné ve srovnání s brzděním
způsobeným plynem, je tlak par dán vztahem:
kde c = průměrná rychlost molekul plynu, r = poloměr kuličky, ró = hustota kuličky, sigma = koeficient tečného přenosového impulsu (ró = 1 pro ideálně kulový povrch kuličky), t = čas, v(t)= rotační rychlost po čase t, v(0)= počáteční rotační rychlost. Rovnice může být rovněž napsána ve tvaru:
kde tn, tn-1jsou časy potřebné pro stanovený počet rotací N. Časové intervaly tn, tn-1následují za sebou a tn > tn-1. Průměrná rychlost molekul plynu je dána vztahem:
kde T = teplota, R = univerzální molární plynová konstanta, M = molární hmotnost.
IV.2 DATA
Stanovení tlaku par kteroukoli z výše popsaných metod
by se mělo provést nejméně při dvou teplotách. Aby se
ověřil lineární průběh křivky tlaku par v oblasti
teplot od 0 st.C do 50 st.C, doporučuje se měření při třech
nebo více teplotách.
IV.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— použitá metoda,
— přesná specifikace látky (identita a nečistoty) a
popř. informace o provedeném předběžném čištění,
— nejméně dvě hodnoty tlaku par a teploty, pokud
možno v oblasti 0 st.C až 50 st.C,
— všechny původní údaje,
— křivka závislosti log p na 1/T,
— odhadnutá hodnota tlaku par při 20 st.C nebo 25 st.C.
Zjistíli se změna stavu (fázový přechod, rozklad),
měly by být uvedeny následující skutečnosti:
— druh změny,
— teplota při atmosférickém tlaku, při které ke
změně dochází,
— hodnoty tlaku par při 10 st.C a 20 st.C pod teplotou
přechodu a nad teplotou přechodu (s výjimkou
přechodů z tuhého do plynného skupenství).
Musí být uvedeny všechny informace a poznámky, které
jsou důležité pro interpretaci výsledků, zejména pokud
jde o nečistoty a fyzikální stav látky.
IV.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 104, Decision
of the Council C(81) 30 final.
(2) Ambrose, D. V: B. Le Neindre, B. Vodar, (eds.):
Experimental Thermodynamics. Butterworths,
London, 1975, II.
(3) R. Weissberger (ed.): Technique of Organic
Chemistry, Physical Methods of Organic Chemistry.
3rd ed. Chapter IX, Interscience Publ., New York,
1959, I, Part I.
(4) Knudsen, M. Ann. Phys. Lpz., 1909, 29, 1979;
1911, 34, 593.
(5) NF T 20-048 AFNOR (Sept. 85). Chemical products
for industrial use – Determination of vapour
pressure of solids and liquids within range from
10
-1
to 105 Pa – Static method. (6) NF T 20-047 AFNOR (Sept. 85). Chemical products
for industrial use – Determination of vapour
pressure of solids and liquids within range from
10
-3
to 1 Pa – Vapour pressure balance method. (7) ASTM D 2879-86, Standard test method for vapour
pressure- temperature relationship and initial
decomposition temperature of liquids by
isoteniscope.
(8) G. Messer, P. Röhl, G. Grosse, W. Jitschin.
J. Vac. Sci. Technol. (A), 1987, 5 (4), 2440.
(9) Ambrose, D., Lawrenson, I. J., Sprake, C. H. S.
J. Chem. Thermodynamics 1975, 7, 1173.
(10) B. F. Rordorf. Thermochimica Acta, 1985, 85, 435.
(11) G. Comsa, J. K. Fremerey, B. Lindenau.
J. Vac. Sci. Technol., 1980, 17 (2), 642.
(12) G. Reich. J. Vac. Sci. Technol., 1982, 20 (4),
1148.
(13) J. K. Fremerey. J. Vac. Sci. Technol. (A), 1985,
3 (3), 1715.
DODATEK 1
Metoda odhadu
ÚVOD
Vypočtené hodnoty tlaku par lze využít
— k rozhodnutí, která z experimentálních metod je vhodná,
— k provedení odhadu nebo ke stanovení mezní hodnoty
v případech, kdy nelze z technických důvodů použít
experimentální metodu (včetně případů, kdy je tlak par
velmi nízký),
— jako pomoc při vyhledání případů, kdy je neprovedení
experimentálního měření odůvodnitelné, neboť tlak par je
při laboratorní teplotě pravděpodobně < 10
-5
Pa.METODA ODHADU
Tlak par kapalin a tuhých látek může být odhadnut pomocí
modifikovaného Watsonova korelačního vztahu (a). Požaduje se
pouze jeden experimentální údaj, a to teplota varu za
normálního tlaku. Metoda je použitelná pro tlaky od 105 do
10
-5
Pa.Podrobná informace o metodě je uvedena v příručce Handbook of
Chemical Property Estimation Methods (b).
POSTUP VÝPOČTU
Podle příručky (b) se tlak par vypočte podle vzorce:
kde T = teplota, pro kterou je tlak par vypočítáván Tb= teplota varu při normálním tlaku Pvp= tlak par při teplotě T deltaHvb= výparné teplo deltaZb= faktor stlačitelnosti (použije se hodnota 0,97) m = empirický faktor, jehož hodnota závisí na fyzikálním stavu při teplotě, pro níž je prováděn výpočet Dále
kde KFje empirický součinitel zohledňující polaritu látky. V příručce b) jsou uvedeny hodnoty faktoru KF pro několik typů sloučenin. Velmi často jsou k dispozici údaje o teplotě varu při sníženém tlaku. V takovém případě se podle příručky (b) vypočte tlak par podle následujícího vztahu:
kde T1je teplota varu při sníženém tlaku P1.
ZPRÁVA
Jeli použita metoda odhadu, musí zpráva obsahovat úplný
postup výpočtu.
LITERATURA
a) K. M. Watson, Ind. Eng. Chem. 1943, 35, 398.
b) W. J. Lyman, W. F. Reehl, D. H. Rosenblatt. Handbook of
Chemical Estimation Methods. McGrawHill, 1982.
DODATEK 2
Obrázek 1 Zařízení pro stanovení křivky tlaku par dynamickou metodou
Obrázek 2a Zařízení pro stanovení křivky tlaku par statickou metodou (s manometrickou Utrubicí)
1. Zkušební látka 6. Lázeň termostatu 2. Plynná fáze 7. Měřidlo teploty 3. Vysokovakuový kohout 8. K vývěvě 4. Utrubice (pomocný 9. Odvzdušnění manometr) 5. Manometr Obrázek 2b Zařízení pro stanovení křivky tlaku par statickou metodou (s použitím ukazatele tlaku)
1. Zkušební látka 5. Ukazatel tlaku 2. Plynná fáze 6. Lázeň termostatu 3. Vysokovakuový kohout 7. Měřidlo teploty 4. Stupnice tlaku Obrázek 3 Isoteniskop (viz literatura (7))
1. K systému měření a kontroly tlaku 2. Trubice s vnějším průměrem 8 mm 3. Suchý dusík v tlakovém systému 4. Páry vzorku 5. Špička baňky 6. Kapalný vzorek Obrázek 4 Zařízení pro stanovení křivky tlaku par podle metody stanovení tlaku par pomocí vah
1. Zkušební látka 7. Clona 2. Plynná fáze s proudem par 8. Tyčka chladicího bloku 3. Odpařovací pícka s otočným 9. Miska vah vstupem 3a. Víko s otvory 10. Mikrováhy 4. Vyhřívání pícky (chlazení) 11. K zapisovači 5. Měření teploty vzorku 12. K vysokovakuové vývěvě 6. Chladicí box Obrázek 5 Příklad zařízení pro odpařování za nízkého tlaku při efusní metodě, vybaveného efusní komůrkou o objemu 8 cm3
1. Přípojka k vakuu 2. Otvory pro platinový odporový teploměr nebo pro systém měření a kontroly teploty (2) 3. Víko vakuového bloku 4. Okroužek 5. Hliníkový vakuový blok 6. Zařízení pro zasouvání a vytahování efusních komůrek 7. Šroubovací víčko 8. Křídlové matice (6) 9. Šrouby (6) 10. Efusní komůrky z korozivzdorné oceli 11. Topná tělesa (6) Obrázek 6a Příklad průtokového systému pro stanovení tlaku par metodou nasycení plynu
1 = Regulátor průtoku 2 = Výměník tepla 3 = Jehlové ventily 4 = Čidlo pro měření relativní vlhkosti plynu 5 = Saturační kolony 6 = Těsnění z PTFE 7 = Průtokoměr 8 = Lapač (absorbér) 9 = Olejový lapač 10 = Fritový počítač bublinek Obrázek 6b Příklad zařízení pro stanovení tlaku par metodou nasycení plynu s kapilárou zařazenou za syticí kolonu 1. Průtokoměr s vyhřívanou 6. Syticí kolona spirálou 2. Manometr 7. Kapilára 3. Lázeň termostatu 8. Absorbéry 4. Spirála pro termostatování 9. Plynoměr nosného plynu 5. Teploměr (Pt 100) 10. Chlazený lapač Obrázek 7 Příklad experimentálního uspořádání pro metodu rotujícího tělíska Zařízení pro měření tlaku par A. Hlava pro snímání otáček rotujícího tělíska B. Komůrka se vzorkem C. Termostat D. Zdroj vakua (turbomolekulární vývěva) E. Vzduchový termostat obrázky 6b a 7
Obrázek 8 Příklad měřicí hlavy s rotujícím tělískem
1. Kulička 2. Evakuovaný trubkový nástavec k 6 3. Permanentní magnety 4. Cívky (2) pro svislou stabilizaci 5. Hnací cívky (4) 6. Připojovací spojka
V. METODY PRO STANOVENÍ POVRCHOVÉHO NAPĚTÍ – METODY UVEDENÉ V
BODU A.5 PŘÍLOHY SMĚRNICE 92/69/EHS
V.1 METODA
Popsané metody jsou založeny na Pokynech OECD pro
zkoušení (1). Jejich základní principy jsou uvedeny
v literatuře (2).
V.1.1 ÚVOD
Popsané metody jsou určeny pro měření povrchového
napětí vodných roztoků.
Před provedením těchto zkoušek je vhodné mít
k dispozici předběžné informace o rozpustnosti látky ve
vodě, o její struktuře, o hydrolýze a o kritické
koncentraci pro tvorbu micel.
Níže uvedené metody jsou použitelné pro většinu
chemických látek bez omezení z hlediska stupně jejich
čistoty.
Měření povrchového napětí metodou prstencového
tenziometru je omezeno na vodné roztoky s dynamickou
viskozitou nižší než přibližně 200 mPa·s.
V.1.2 DEFINICE A JEDNOTKY
Povrchová volná enthalpie vztažená na jednotku povrchu
se nazývá povrchové napětí.
Povrchové napětí se vyjadřuje těchto jednotkách:
N*m
-1
(v soustavě SI) nebo mN*m
-1
(odvozená jednotka v soustavě SI) 1 N*m
-1
= 103
dyn*cm-1
1 mN*m
-1
= 1 dyn*cm-1
ve staré soustavě CGSV.1.3 REFERENČNÍ LÁTKY
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
Referenční látky, které pokrývají široké rozpětí hodnot
povrchového napětí, jsou uvedeny v literatuře (1, 3).
V.1.4 PODSTATA METOD
Metody jsou založeny na měření největší síly, kterou je
nutné působit ve svislém směru na třmínek nebo
prstenec, který se dotýká povrchu zkoumané kapaliny
umístěné v měřicí nádobě, aby se od tohoto povrchu
oddělil, nebo na destičku, která se svým okrajem dotýká
povrchu, aby se vzniklý film vytáhl nahoru.
Látky, jejichž rozpustnost ve vodě dosahuje hodnoty
alespoň 1 mg·l
-1
se zkoušejí ve vodných roztocích při
jedné koncentraci.V.1.5 KRITÉRIA JAKOSTI
Přesnost těchto metod je pravděpodobně vyšší, než je
požadováno pro účely hodnocení stavu životního
prostředí.
V.1.6 POPIS METOD
Připraví se roztok látky v destilované vodě.
Koncentrace roztoku by měla být 90 % koncentrace
nasyceného roztoku látky ve vodě; pokud tato
koncentrace přesáhne 1 g·l
-1
, použije se k měření
roztok o koncentraci 1 g*l-1
. Látky, jejichž
rozpustnost je menší než 1 mg*l-1
, není nutné zkoušet.V.1.6.1 Destičková metoda
Viz ISO 304 a NF T 73060 (Surface active agents –
determination of surface tension by drawing up liquid
films).
V.1.6.2 Třmínková metoda
Viz ISO 304 a NF T 73060 (Surface active agents –
determination of surface tension by drawing up liquid
films).
V.1.6.3 Prstencová metoda
Viz ISO 304 a NF T 73060 (Surface active agents –
determination of surface tension by drawing up liquid
films).
V.1.6.4 Harmonizovaná prstencová metoda OECD
V.1.6.4.1 Aparatura
Pro toto měření jsou vhodné komerční tenziometry.
Sestávají z těchto částí:
— pohyblivý stolek pro vzorek,
— systém měření síly,
— měřicí tělísko (prstenec),
— měřicí nádoba.
V.1.6.4.1.1 Pohyblivý stolek pro vzorek
Pohyblivý stolek pro vzorek slouží jako podložka pro
termostatovanou měřicí nádobu, ve které je kapalina,
která má být zkoušena. Spolu se systémem měření síly je
upevněn na stojanu.
V.1.6.4.1.2 Systém měření síly
Systém měření síly je umístěn nad stolkem pro vzorek
(viz obrázek). Chyba měření síly nemá překročit
+/-10
-6
N, což odpovídá chybě +/-0,1 mg při měření
hmotnosti. Ve většině případů je měřicí stupnice
komerčních tenziometrů dělena v mN*m-1
, takže je možné
povrchové napětí odečítat přímo v mN*m-1
s přesností na
0,1 mN*m-1
.V.1.6.4.1.3 Měřicí tělísko (prstenec)
Prstenec je obvykle zhotoven z platino-iridiového drátu
o průměru asi 0,4 mm a středním obvodu 60 mm. Prstenec
z drátu je zavěšen vodorovně na upevňovací vidlici
z drátu a na kovové tyčince, která tvoří spojení
k systému měření síly (viz obrázek).
Obrázek
Měřicí tělísko
(všechny rozměry jsou uvedeny v milimetrech)
V.1.6.4.1.4 Měřicí nádoba
Měřicí nádobou pro zkušební roztok je termostatovaná
skleněná nádoba. Má být konstruována tak, aby teplota
zkoumané kapaliny i plynné fáze nad jejím povrchem
zůstala během měření konstantní a aby se vzorek nemohl
odpařovat. Vhodná je válcová skleněná nádoba o vnitřním
průměru nejméně 45 mm.
V.1.6.4.2 Příprava aparatury
V.1.6.4.2.1 Čištění
Skleněné nádoby je třeba pečlivě vyčistit. Pokud je to
nutné, měly by se vymýt horkou kyselinou chromsírovou a
následně koncentrovanou kyselinou fosforečnou (83 až
98% hmot. H
3
PO4
), pečlivě vypláchnout tekoucí vodou a
nakonec omýt redestilovanou vodou do neutrální reakce a
následně vysušit nebo vypláchnout vzorkem kapaliny,
která má být měřena. Prstenec je třeba nejprve pečlivě umýt vodou, aby se
odstranily všechny látky rozpustné ve vodě. Poté se
krátce ponoří do kyseliny chromsírové, opláchne se
v redestilované vodě do neutrální reakce a nakonec se
krátce ohřeje nad methanolovým plamenem.
Poznámka:
Znečištění látkami, které se nerozpouštějí ani
nerozkládají kyselinou chromsírovou ani kyselinou
fosforečnou, jako například silikony, je nutné
odstraňovat vhodnými organickými rozpouštědly.
V.1.6.4.2.2 Kalibrování aparatury
Validace aparatury spočívá v ověření nuly a v nastavení
přístroje tak, aby jeho údaje umožňovaly spolehlivé
stanovení v mN·m
-1
. Poloha:
Přístroj musí být nastaven do vodorovné polohy, např.
pomocí libely položené na základovou desku tenziometru
a nastavením stavěcích šroubů základnové desky.
Nastavení nuly:
Po upevnění prstence na aparatuře a před ponořením do
kapaliny je třeba nastavit nulu ukazatele tenziometru a
zkontrolovat rovnoběžnost prstence s hladinou kapaliny.
K tomu je možné použít hladiny kapaliny jako zrcadla.
Kalibrace:
Vlastní kalibraci před měřením je možné provést dvěma
postupy:
a) Použitím závaží: při tomto postupu se použijí
jezdce o známé hmotnosti od 0,1 g do 1,0 g, které
se umístí na prstenec. Kalibrační faktor fía,
kterým je třeba násobit všechny hodnoty odečtené
na přístroji, je možné určit podle rovnice (1):
rór
fía = ----
róa
kde:
mg
rór = ---- . (mN . m-1)
2b
m = hmotnost jezdce (g),
g = tíhové zrychlení (981 cm*s-2 na úrovni hladiny
moře),
b = střední obvod prstence (cm),
róa = odečtená hodnota na tenziometru po umístění
jezdců na prstenec (mN*m-1).
b) Použitím vody: při tomto postupu se použije čistá
voda, jejíž povrchové napětí má při 23 st.C hodnotu
72,3 mN*m-1. Tento postup lze provést rychleji
než kalibraci se závažími, ale existuje vždy
nebezpečí, že povrchové napětí vody je zkresleno
stopovým znečištěním povrchově aktivními látkami.
Kalibrační faktor fíb, kterým je třeba násobit
všechny hodnoty odečtené na přístroji, je možné
určit podle rovnice (2):
ró0
fíb = ---
róg
kde:
ró0 = hodnota povrchového napětí vody uvedená
v literatuře (mN*m-1),
róg = naměřená hodnota povrchového napětí vody
(mN*m-1),
obě při stejné teplotě.
V.1.6.4.3 Příprava vzorků
Připraví se vodné roztoky zkušebních látek o požadované
koncentraci, které nesmějí obsahovat nerozpuštěné
složky.
Roztoky musí být udržovány při konstantní teplotě
(+/-0,5 st.C). Protože se povrchové napětí roztoku v měřicí
nádobě v čase mění, provedou se měření v různých časech
a sestrojí se křivka závislosti povrchového napětí na
čase. Nedocházíli k žádným dalším změnám, bylo
dosaženo rovnovážného stavu.
Měření je ovlivňováno znečištěním prachem nebo plynnými
látkami. Práce musí být tedy prováděny pod ochranným
krytem.
V.1.6.5 Zkušební podmínky
Měření se provádí přibližně při +20 st.C a udržuje se
tolerance +/-0,5 st.C.
V.1.6.6 Postup zkoušky
Roztoky, které mají být měřeny, se převedou do pečlivě
vyčištěné měřicí nádoby, přičemž je třeba dbát na to,
aby nedošlo k pěnění, a nádoba se poté postaví na
stolek zkušební aparatury. Horní část stolku s měřicí
nádobou se vysune tak vysoko, aby se prstenec ponořil
pod povrch roztoku, který má být měřen. Horní část
stolku se následně postupně a rovnoměrně sníží
(rychlostí přibližně 0,5 cm·min
-1
), aby došlo
k oddělení prstence od povrchu, a to až do dosažení
maximální hodnoty síly. Film kapaliny lpící na prstenci
se od něho nesmí odtrhnout. Po ukončení měření se
prstenec opět ponoří pod povrch a postup se opakuje až
do dosažení konstantní hodnoty povrchového napětí. Při
každém stanovení se začne zaznamenávat čas v okamžiku
plnění roztoku do měřicí nádoby. Odečty se provedou
vždy v okamžiku, kdy je dosaženo maximální síly nutné
pro oddělení prstence od povrchu kapaliny. V.2 DATA
Za účelem výpočtu povrchového napětí se hodnota
odečtená na přístroji v mN·m
-1
nejprve vynásobí
kalibračním faktorem fía nebo fíb (podle použitého
postupu kalibrace). Získá se tak hodnota, která však
platí pouze přibližně, a vyžaduje proto korekci.
Harkins a Jordan (4) empiricky stanovili korekční
faktory pro hodnoty povrchového napětí měřeného
prstencovou metodou, které závisí na rozměrech
prstence, hustotě kapaliny a jejím povrchovém napětí.
Vzhledem k tomu, že je zdlouhavé stanovovat pro každé
jednotlivé měření korekční faktor z tabulek Harkinse a
Jordana, lze pro výpočet povrchového napětí vodných
roztoků použít zjednodušenou metodu, která spočívá
v odečtu korigovaných hodnot povrchového napětí přímo
z tabulky. (Pro odečtené hodnoty, které leží mezi
hodnotami uvedenými v tabulce, se provede interpolace.) TABULKA: KOREKCE NAMĚŘENÝCH HODNOT POVRCHOVÉHO NAPĚTÍ
Pouze pro vodné roztoky, ró = 1 g*cm-3
R = 9,55 mm (střední poloměr prstence)
r = 0,185 (poloměr drátu prstence)
------------------------------------------------------------
Experimentální hodnota Korigovaná hodnota (mN*m-1)
(mN*m-1) -----------------------------------
Kalibrace Kalibrace vodou
závažími (viz 1.6.4.2.2
(viz 1.6.4.2.2 písm. b))
písm. a))
------------------------------------------------------------
20 16,9 18,1
22 18,7 20,1
24 20,6 22,1
26 22,4 24,1
28 24,3 26,1
30 26,2 28,1
32 28,1 30,1
34 29,9 32,1
36 31,8 34,1
38 33,7 36,1
40 35,6 38,2
42 37,6 40,3
44 39,5 42,3
46 41,4 44,4
48 43,4 46,5
50 45,3 48,6
52 47,3 50,7
54 49,3 52,8
56 51,2 54,9
58 53,2 57
60 55,2 59,1
62 57,2 61,3
64 59,2 63,4
66 61,2 65,5
68 63,2 67,7
70 65,2 69,9
72 67,2 72
74 69,2 –
76 71,2 –
78 73,2 –
------------------------------------------------------------
Tabulka byla sestavena na základě korekcí podle
Harkinse a Jordana. Je obdobou tabulky podle normy
DIN 53914 pro vodu a vodné roztoky (hustota ró =
1 g*cm-3); platí pro běžný komerční prstenec o
rozměrech R = 9,55 mm (střední poloměr prstence) a
r = 0,185 mm (poloměr drátu prstence). Tabulka udává
korigované hodnoty pro měření povrchového napětí
získané po kalibraci závažími nebo vodou.
Jiným řešením je vypočítat povrchové bez předchozí
kalibrace podle rovnice:
f x F
ró = -------
4 pí R
kde
F = síla udaná měřicím systémem při oddělení filmu
R = poloměr prstence
f = korekční faktor (1)
V.3 ZPRÁVY
V.3.1 PROTOKOL O ZKOUŠCE
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— použitá metoda,
— druh vody nebo použitého roztoku,
— přesná specifikace látky (identifikace a
nečistoty),
— výsledky měření: povrchové napětí (odečtené
hodnoty) s uvedením jednotlivých odečtených
hodnot a jejich aritmetického průměru a rovněž
korigované střední hodnoty (přičemž se bere
v úvahu kalibrační faktor a tabulka korekcí),
— koncentrace roztoku,
— zkušební teplota,
— stáří použitého roztoku, zejména časový odstup
mezi přípravou roztoku a měřením,
— znázornění časové závislosti povrchového napětí
po převedení roztoku do měřicí nádoby,
— uvedou se všechny informace a poznámky, které
jsou důležité pro interpretaci výsledků, zejména
pokud jde o nečistoty a fyzikální stav látky.
V.3.2 INTERPRETACE VÝSLEDKŮ
Vzhledem k tomu, že povrchové napětí vody je
72,75 mN·m
-1
při 20 st.C, měly by být látky vykazující za
podmínek této metody povrchové napětí menší než
60 mN*m-1
považovány za povrchově aktivní materiály.V.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 115, Decision
of the Council C(81) 30 final.
(2) R. Weissberger (ed.). Technique of Organic
Chemistry, 3rd ed. Interscience Publ., New York,
1959, 1, Part I, Chapter XIV.
(3) Pure and Applied Chem., 48, 1976, 511.
(4) Harkins, W. D., Jordan, H. F., J. Amer. Chem.
Soc., 52, 1930, 1751.
VI. METODY PRO STANOVENÍ ROZPUSTNOSTI VE VODĚ – METODY
UVEDENÉ V BODU A.6 PŘÍLOHY SMĚRNICE 92/69/EHS
VI.1 METODA
Popsané metody jsou založeny na Pokynech OECD pro
zkoušení (1).
VI.1.1 ÚVOD
Rozpustnost zkušební látky ve vodě může být značně
ovlivněna přítomností nečistot.
Před provedením této zkoušky je vhodné mít k dispozici
předběžné informace o strukturním vzorci látky, o tenzi
par, disociační konstantě a o hydrolýze (jako funkci
pH).
Neexistuje jediná dostupná metoda pro celý rozsah
rozpustností ve vodě.
Dvě níže popsané metody pokrývají celý rozsah
rozpustnosti, nejsou však použitelné pro těkavé látky:
— první metoda, použitelná pro v podstatě čisté
látky s malou rozpustností (< 10
-2
g*l-1
), stálé
ve vodě; tato metoda se označuje jako „sloupcová
eluční metoda“, — druhá metoda, použitelná pro v podstatě čisté
látky s vyšší rozpustností (> 10
-2
g*l-1
), stálé
ve vodě; tato metoda se označuje jako „baňková
metoda“.VI.1.2 DEFINICE A JEDNOTKY
Rozpustnost látky ve vodě je definována hmotnostní
koncentrací jejího nasyceného roztoku ve vodě při dané
teplotě. Rozpustnost ve vodě se udává v jednotkách
hmotnosti na objem roztoku. Jednotkou v soustavě SI je
kg·m
-3
(může se také používat g*l-1
).VI.1.3 REFERENČNÍ LÁTKY
Při zkoušení nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
VI.1.4 PODSTATA ZKUŠEBNÍCH METOD
Přibližné množství vzorku a doba nutná pro dosažení
hmotnostní koncentrace nasyceného roztoku by měly být
stanoveny jednoduchou předběžnou zkouškou.
VI.1.4.1 Sloupcová eluční metoda
Tato metoda je založena na vymývání zkušební látky
vodou z mikrokolony, naplněné inertním nosičem, např.
skleněnými kuličkami nebo pískem, pokrytým přebytkem
zkušební látky. Rozpustnost ve vodě se stanoví, jsou-li
hmotnostní koncentrace eluátu konstantní. To se projeví
jako plató závislosti koncentrace na čase.
VI.1.4.2 Baňková metoda
V této metodě se látka (tuhé látky musí být ve formě
prášku) rozpustí ve vodě při teplotě, která je o něco
vyšší než teplota měření. Po dosažení nasycení se
roztok ochladí a udržuje se při teplotě měření, za
stálého míchání, dokud se nedosáhne rovnováhy. Jinou
možností je provést měření přímo při zkušební teplotě,
pokud je vhodným vzorkováním prokázáno, že je dosaženo
rovnovážného nasycení. Hmotnostní koncentrace látky ve
vodném roztoku, který nesmí obsahovat žádné
nerozpuštěné částice, se následně stanoví vhodnou
analytickou metodou.
VI.1.5 KRITÉRIA JAKOSTI
VI.1.5.1 Opakovatelnost
Při sloupcové eluční metodě je dosažitelná
opakovatelnost < 30 %; při baňkové metodě by mělo být
dosaženo opakovatelnosti < 15 %.
VI.1.5.2 Citlivost
Závisí na analytické metodě, lze však stanovit
hmotnostní koncentrace až do 10
-6
g*l-1
.VI.1.6 POPIS METOD
VI.1.6.1 Zkušební podmínky
Zkouška se provádí pokud možno při teplotě 20 +/- 0,5 st.C.
Předpokládá-li se závislost rozpustnosti ve vodě na
teplotě (> 3 % na 1 st.C), měla by být provedena měření
při dvou dalších teplotách, které jsou nejméně o 10 st.C
vyšší a nižší než původně zvolená teplota. V tomto
případě by měla být teplota udržována v toleranci
+/-0,1 st.C. Zvolenou teplotu je třeba udržovat ve všech
důležitých částech aparatury konstantní.
VI.1.6.2 Předběžná zkouška
K přibližně 0,1 g vzorku (tuhé látky musí být
v práškové formě) v 10ml odměrném válci uzavíratelném
skleněnou zátkou se přidává vzrůstající objem
destilované vody o laboratorní teplotě podle kroků
uvedených v následující tabulce:.
------------------------------------------------------------------------------- --------------- 0,1 g rozpuštěno 0,1 0,5 1 2 10 100 > 100 v „x“ ml vody ------------------------------------------------------------------------------- --------------- Přibližná > 1 000 1 000 až 200 200 až 100 100 až 50 50 až 10 10 až 1 < 1 rozpustnost (g*l-1) ------------------------------------------------------------------------------- ---------------
Po každém přidání množství vody uvedeného v tabulce se
směsí intenzivně třepe po dobu 10 min a vizuálně se
kontroluje obsah nerozpuštěných částic. Zůstaneli
vzorek nebo jeho část po přidání 10 ml vody
nerozpuštěný, experiment je nutno opakovat ve 100 ml
odměrném válci s větším objemem vody. Při nízkých
rozpustnostech může být doba potřebná k rozpuštění
látky podstatně delší (je vhodné vyčkat alespoň 24 h *).
Přibližná rozpustnost je uvedena v tabulce pod objemem
vody potřebným k úplnému rozpuštění vzorku. Není-li
látka ani poté úplně rozpuštěna, je vhodné vyčkat delší
dobu než 24 h (maximálně 96 h), nebo ředit dále, aby se
zjistilo, zda by měla být použita sloupcová eluční
metoda nebo baňková metoda.
---
* Pozn. překl. V německém originálu: „... až 24 hodin“.
VI.1.6.3 Sloupcová eluční metoda
VI.1.6.3.1 Nosič, rozpouštědlo a eluent
Nosič pro sloupcovou eluční metodu by měl být inertní.
Vhodnými materiály, které lze použít, jsou skleněné
kuličky a písek. K nanesení zkušební látky na nosič by
mělo být použito vhodné těkavé analyticky čisté
rozpouštědlo. Jako eluent by měla být použita voda
redestilovaná ve skleněné nebo křemenné aparatuře.
Poznámka:
Nesmí se použít voda získaná přímo z organického měniče
iontů.
VI.1.6.3.2 Nanášení na nosič
Odváží se přibližně 600 mg nosiče a převede se do 50ml
baňky s kulatým dnem.
Přiměřené odvážené množství zkušební látky se rozpustí
ve zvoleném rozpouštědle. Dostatečný podíl tohoto
roztoku se přidá k nosiči. Rozpouštědlo musí být
dokonale odpařeno, např. v rotační odparce, jinak se
nedosáhne úplného nasycení nosiče vodou kvůli
rozdělovacím efektům na povrchu nosiče.
Nanášení zkušební látky na nosič může být problematické
(chybné výsledky), sráží-li se zkušební látka na nosiči
jako olej nebo krystalická fáze. Problém by měl být
řešen experimentálně a podrobnosti by měly být
zaznamenány.
Nosič s nanesenou látkou se nechá 2 h botnat v asi 5 ml
vody a suspense se poté naplní do mikrokolony. Je také
možné naplnit mikrokolonu, která byla předtím naplněna
vodou, suchým nosičem s nanesenou látkou a poté nechat
během dvou hodin ustavit rovnováhu.
Zkušební postup:
Vymývání látky z nosiče lze provádět dvěma různými
způsoby:
— oběhovým čerpadlem (viz obrázek 1),
— vyrovnávací nádobou (viz obrázek 4).
VI.1.6.3.3 Vymývání kolony použitím oběhového čerpadla
Aparatura
Schematické uspořádání typického systému je znázorněno
na obrázku 1. Vhodná mikrokolona je znázorněna na
obrázku 2, přijatelná je ovšem i kterákoli jiná
velikost za předpokladu, že budou splněna kritéria
opakovatelnosti a citlivosti. Prostor hlavy kolony by
měl mít obsah nejméně pěti objemů sloupce a měl by být
schopný pojmout nejméně pět vzorků. Prostor hlavy
kolony může být menší, pokud se počátečních pět objemů
sloupce eluovaných s nečistotami nahradí čistým
rozpouštědlem.
Kolona by měla být připojena k oběhovému čerpadlu,
které zajišťuje konstantní průtok asi 25 ml·h
-1
.
Čerpadlo se připojí hadičkami z polytetrafluorethylenu
(PTFE), a/nebo skleněnými trubičkami. U aparatury
složené z kolony a čerpadla musí být možnost odběru
eluátu a vyrovnávání tlaku v hlavě kolony
s atmosférickým tlakem. Materiál v koloně se fixuje
malým (5 mm) smotkem skelné vaty, který současně slouží
k odfiltrování částeček. Lze použít např. peristaltické
nebo membránové čerpadlo (přitom je třeba dbát na to,
aby nedošlo ke znečištění materiálem hadičky a/nebo aby
nedošlo k absorpci tímto materiálem).Postup měření
Zahájí se vymývání kolony. Doporučuje se průtok asi
25 ml·h
-1
(to odpovídá u popsané kolony desetinásobku
objemu sloupce za hodinu). Nejméně prvních pět objemů
sloupce obsahujících nečistoty rozpustné ve vodě se
odstraní. Poté se nechá běžet oběhové čerpadlo až do
ustavení rovnováhy, které je dosaženo, neliší-li se
koncentrace pěti po sobě následujících vzorků při
náhodném výběru o více než +/-30 %, přičemž rozdíly jsou
nepravidelné. Tyto vzorky by se měly odebírat
v intervalech, během kterých kolonou projde objem
eluentu rovný nejméně desetinásobku objemu sloupce.VI.1.6.3.4 Vymývání kolony pomocí vyrovnávací nádoby
Aparatura (viz obrázek 3 a 4)
Vyrovnávací nádoba: je připojena zabroušeným spojem,
který je spojen hadičkou z PTFE. Doporučuje se použít
rychlost průtoku přibližně 25 ml·h
-1
. Podíly eluátu
následující po sobě se shromažďují a jejich koncentrace
se analyzují zvolenou metodou. Postup měření:
Pro stanovení rozpustnosti ve vodě se použijí
prostřední podíly eluátu, ve kterých zůstávají
koncentrace nejméně v pěti po sobě jdoucích vzorcích
konstantní (+/-30 %).
V obou případech (při použití oběhového čerpadla nebo
vyrovnávací nádoby) se druhé promytí provede při
poloviční průtokové rychlosti. Shodujíli se výsledky
obou pokusů, považuje se výsledek za uspokojivý; jeli
zdánlivá rozpustnost při nižší průtokové rychlosti
vyšší, je nutné průtok snižovat vždy na polovinu tak
dlouho, dokud dva po sobě následující měření
neposkytnou stejnou hodnotu rozpustnosti.
V obou případech (v případě oběhového čerpadla nebo
vyrovnávací nádoby) je nutné vzorky podrobit zkoušce na
koloidní částice pomocí Tyndallova jevu (rozptylem
světla). Přítomností takových částic je výsledek
znehodnocen a zkouška by měla být opakována po zlepšení
filtrační funkce kolony.
Mělo by být zaznamenáno pH každého vzorku. Druhé měření
je třeba provést při stejné teplotě.
VI.1.6.4 Baňková metoda
VI.1.6.4.1 Zařízení
Tato metoda vyžaduje následující vybavení:
— běžné laboratorní skleněné nádoby a pomůcky,
— zařízení pro třepání roztoků při regulovaných
konstantních teplotách,
— odstředivka (nejlépe termostatovaná), jeli
nezbytná v případě emulzí, a
— přístroje pro analytická stanovení.
VI.1.6.4.2 Postup měření
Množství materiálu potřebné pro nasycení požadovaného
objemu vody se odhadne z předběžného pokusu. Potřebný
objem vody závisí na analytické metodě a na rozsahu
rozpustnosti. Do tří skleněných nádobek opatřených
skleněnými zátkami (např. centrifugačních kyvet, baněk)
se naváží asi pětinásobek odhadnutého množství
materiálu. Do každé z nádobek se přidá zvolené množství
vody a nádobky se těsně uzavřou. Uzavřené nádobky se
poté třepou při 30 st.C. (K tomuto účelu by měla být
použita třepačka nebo míchačka pracující při konstantní
teplotě, např. magnetické míchání v termostatované
vodní lázni.) Po jednom dnu se jedna z nádobek vyjme a
nechá se za občasného míchání 24 h stát, aby se
ustálila rovnováha při teplotě měření. Poté se obsah
nádobky odstředí při teplotě měření a v čiré vodné fázi
se vhodnou analytickou metodou stanoví koncentrace
zkušební látky. Po dvou, resp. třech dnech se zbylé dvě
nádobky po předchozím ustavení rovnováhy nasycení při
30 st.C zpracují podobným způsobem. Odpovídají-li hodnoty
koncentrace alespoň u posledních dvou nádobek
požadované reprodukovatelnosti, je stanovení
uspokojivé. Pokud hodnoty koncentrací pro nádobky 1, 2
a 3 vykazují stoupající tendenci, mělo by být celé
stanovení opakováno s prodloužením doby pro ustavení
rovnováhy.
Měření může být provedeno i bez předběžné inkubace při
30 st.C. S cílem zjistit rychlost ustavení saturační
rovnováhy se odebírají vzorky do té doby, dokud doba
míchání ovlivňuje koncentraci měřeného roztoku.
Mělo by být zaznamenáno pH každého vzorku.
VI.1.6.5 Analýza
Pro tato stanovení se upřednostňuje analytická metoda
specifická pro danou látku, protože malá množství
rozpuštěných nečistot mohou způsobit velké chyby při
stanovení rozpustnosti ve vodě. Příklady těchto
analytických metod jsou plynová nebo kapalinová
chromatografie, titrační metody, fotometrické metody,
voltametrické metody.
VI.2 DATA
VI.2.1 SLOUPCOVÁ ELUČNÍ METODA
Pro každý pokus by měla být vypočtena střední hodnota
z nejméně pěti po sobě následujících vzorků vybraných
z oblasti po dosažení rovnovážného nasycení a rovněž by
měla být vypočtena směrodatná odchylka. Výsledky by
měly být uvedeny v jednotkách hmotnosti na jednotku
objemu roztoku.
Porovnají se střední hodnoty dvou zkoušek provedených
za různých rychlostí průtoku a jejich opakovatelnost by
měla být menší než 30 %.
VI.2.2 BAŇKOVÁ METODA
Výsledky pro každou ze tří baněk se uvedou samostatně a
jsouli ustálené (opakovatelnost je lepší než 15 %),
zprůměrují se a vyjádří se v jednotkách hmotnosti na
jednotku objemu roztoku. Jeli rozpustnost velmi vysoká
(> 100 g·l
-1
), může to vyžadovat přepočet hmotnostních
jednotek na objemové jednotky s využitím hustoty
roztoku.VI.3 ZPRÁVY
VI.3.1 SLOUPCOVÁ ELUČNÍ METODA
Protokol o zkoušce má pokud možno obsahovat následující
zdaje:
— výsledky předběžné zkoušky,
— přesná specifikace látky (identita a nečistoty),
— jednotlivé koncentrace, hodnoty rychlosti průtoku
a pH pro každý vzorek,
— střední hodnoty a směrodatné odchylky nejméně pro
pět vzorků z rovnovážné oblasti křivky nasycení
z každého pokusu,
— průměrná hodnota dvou po sobě následujících
přijatelných měření,
— teplota vody během procesu tvorby nasyceného
roztoku,
— použitá analytická metoda,
— druh použitého materiálu nosiče,
— způsob nanesení studované látky na nosič,
— použité rozpouštědlo,
— poznatky o jakékoli chemické nestálosti látky
během zkoušky a při použité analytické metodě,
— všechny informace, které mají význam pro
interpretaci výsledků, zvláště s ohledem na
nečistoty a fyzikální stav látky.
VI.3.2 BAŇKOVÁ METODA
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— výsledky předběžné zkoušky,
— přesná specifikace látky (identita a nečistoty),
— výsledky jednotlivých analytických stanovení a
průměrné hodnoty, pokud byla pro každou nádobku
stanovena více než jedna hodnota,
— hodnota pH každého vzorku,
— průměrná hodnota pro dvě různé nádobky, jejichž
výsledky jsou ve shodě,
— teplota při zkoušce,
— použitá analytická metoda,
— poznatky o jakékoli chemické nestabilitě látky
během zkoušky a při použité analytické metodě,
— všechny informace, které mají význam pro
interpretaci výsledků, zvláště s ohledem na
nečistoty a fyzikální stav látky.
VI.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 105, Decision
of the Council C(81) 30 final
(2) NF T 20045 (AFNOR) (Sept. 85). Chemical products
for industrial use – Determination of water
solubility of solids and liquids with low
solubility – Column elution method
(3) NF T 20-046 (AFNOR) (Sept. 85). Chemical products
for industrial use – Determination of water
solubility of solids and liquids with high
solubility – Flask method
DODATEK
Obrázek 1
Sloupcová eluční metoda s oběhovým čerpadlem
Obrázek 2
Typická mikrokolona
(všechny rozměry v mm)
Obrázek 3
Typická mikrokolona
(všechny rozměry v mm)
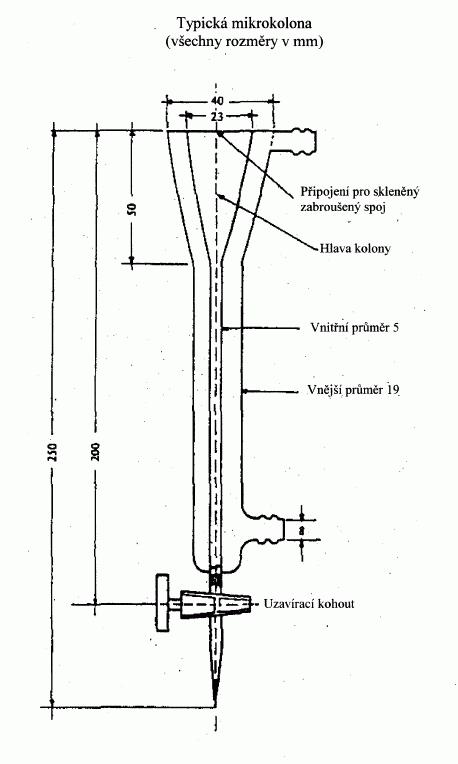
Obrázek 4
Sloupcová eluční metoda s vyrovnávací nádobou
1 = Vyrovnávací nádoba (např. baňka o obsahu 2,5 l)
2 = Kolona (viz obrázek 3)
3 = Sběrač frakcí
4 = Termostat
5 = Teflonová hadička
6 = Skleněný zabroušený spoj
7 = Hadice na vodu (mezi termostatem a kolonou, vnitřní
průměr asi 8 mm)
VII. METODY PRO STANOVENÍ ROZDĚLOVACÍHO KOEFICIENTU – METODY
UVEDENÉ V BODU A.8 PŘÍLOHY SMĚRNICE 92/69/EHS
VII.1. METODA
Popsaná metoda „třepací lahve“ je založena na Pokynech
OECD pro zkoušení (1).
VII.1.1 ÚVOD
Před provedením této zkoušky je vhodné mít k dispozici
předběžné informace o strukturním vzorci látky,
disociační konstantě, rozpustnosti ve vodě, hydrolýze,
rozpustnosti v noktanolu (oktan1olu) a o povrchovém
napětí.
U disociujících látek by měla být měření prováděna
pouze s nedisociovanou formou (volná kyselina nebo
volná báze), získanou při použití vhodného pufru o pH
nejméně o 1 nižším (volná kyselina) nebo vyšším (volná
báze) než pK.
Tato zkušební metoda zahrnuje dva samostatné postupy:
metodu třepací lahve a vysokoúčinnou kapalinovou
chromatografii (HPLC). První metodu lze použít, ležíli
hodnota log P
o/v
(definice viz níže) v rozmezí -2 až 4,
a druhou metodu, leží-li hodnota log Po/v
v rozmezí 0
až 6. Před provedením kteréhokoli z experimentálních
postupů by měl být nejdříve získán předběžný odhad
rozdělovacího koeficientu. Metoda třepací lahve je použitelná pouze pro v podstatě
čisté látky, které jsou rozpustné ve vodě a noktanolu.
Nelze ji použít pro povrchově aktivní látky (pro které
by měly být uvedeny hodnota získaná výpočtem nebo odhad
založený na příslušných rozpustnostech v noktanolu a
vodě).
Metoda HPLC není použitelná pro silné kyseliny a
zásady, komplexní sloučeniny kovů, povrchově aktivní
látky a látky, které reagují s eluentem. Pro tyto látky
by měly být uvedeny hodnota získaná výpočtem nebo odhad
založený na individuálních rozpustnostech v n-oktanolu
a vodě.
Metoda HPLC je méně citlivá na přítomnost nečistot ve
zkušební látce než metoda třepací lahve. Někdy však
mohou nečistoty ztížit interpretaci výsledků, protože
přiřazení píků se stává nejistým. U směsí, které dávají
nerozlišitelný pás, by měly být uvedeny spodní a horní
mez hodnoty log P.
VII.1.2 DEFINICE A JEDNOTKY
Rozdělovací koeficient (P) je definován jako poměr
rovnovážných koncentrací (ci) rozpuštěné látky ve
dvoufázovém systému tvořeném dvěma prakticky
nemísitelnými rozpouštědly. V případě n-oktanolu a vody
platí:
coktan-1-ol
Po/v = ------------
cvoda
Rozdělovací koeficient (P) je tedy podílem dvou
koncentrací a udává se obvykle ve formě svého
dekadického logaritmu (log P).
VII.1.3 REFERENČNÍ LÁTKY
Metoda třepací lahve
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provádění metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
Metoda HPLC
Za účelem korelace hodnot naměřených pro danou
sloučeninu metodou HPLC s její hodnotou P je nutné
sestrojit kalibrační graf závislosti log P na
chromatografických datech tvořený nejméně šesti
referenčními body. Vhodné referenční látky zvolí
uživatel. Pokud je to možné, měla by mít alespoň jedna
referenční látka P
o/v
vyšší než zkušební látka a jiná
referenční látka Po/v
nižší než zkušební látka. U
hodnot log P nižších než 4 může být kalibrace založena
na údajích získaných metodou třepací lahve. U hodnot
log P vyšších než 4 může být kalibrace založena na
ověřených hodnotách z literatury, pokud jsou v souladu
s vypočtenými hodnotami. Za účelem dosažení vyšší
přesnosti je vhodnější volit látky, které mají podobnou
strukturu jako zkušební látka. Rozsáhlé seznamy hodnot P
o/v
pro mnoho skupin
chemických látek jsou dostupné v literatuře (2, 3).
Nejsou-li k dispozici údaje o rozdělovacích
koeficientech látek s podobnou strukturou, lze použít
obecnější kalibraci s jinými referenčními látkami. Seznam doporučených referenčních látek a jejich hodnot
P
o/v
je uveden v doplňku 2.VII.1.4 PODSTATA METOD
VII.1.4.1 Metoda třepací lahve
Pro stanovení rozdělovacího koeficientu musí být
dosaženo rovnováhy mezi všemi vzájemně působícími
složkami systému a musí být stanoveny koncentrace látek
rozpuštěných v obou fázích. Ze studia literatury
vztahující se k této otázce vyplývá, že k řešení tohoto
problému lze použít několik různých postupů, např.
důkladné promíchání obou fází a jejich následné
oddělení za účelem stanovení rovnovážných koncentraci
vyšetřované látky.
VII.1.4.2 Metoda HPLC
HPLC se provádí na analytických kolonách plněných
komerčně dostupnou pevnou fází obsahující dlouhé
uhlovodíkové řetězce (např. C
8
, C18
) chemicky vázané na
oxid křemičitý. Chemické látky nastříknuté do této
kolony se v ní pohybují různou rychlostí v důsledku
různých stupňů rozdělení mezi mobilní fázi a
uhlovodíkovou stacionární fázi. Směsi chemikálií se
eluují v pořadí své hydrofobnosti, přičemž se látky
rozpustné ve vodě eluují jako první a látky rozpustné
v olejích jako poslední, úměrně svému rozdělovacímu
koeficientu uhlovodíkyvoda. To umožňuje určit vztah
mezi retenčním časem v této koloně (s reversními
fázemi) a rozdělovacím koeficientem noktan/voda.
Rozdělovací koeficient se odvodí z kapacitního faktoru
k, daného výrazem:
tR - to
k = -----------
to
v němž t
R
= retenční čas zkušební látky, to = průměrná
doba, kterou molekula rozpouštědla potřebuje k průchodu
kolonou (mrtvá doba). Kvantitativní analytické metody nejsou zapotřebí,
nezbytné je pouze stanovení elučních dob.
VII.1.5 KRITÉRIA JAKOSTI
VII.1.5.1 Opakovatelnost
Metoda třepací lahve
S cílem zaručit správnost hodnoty rozdělovacího
koeficientu se provedou opakovaná stanovení při třech
různých zkušebních podmínkách, přičemž lze měnit jak
množství dané látky, tak poměr objemů obou
rozpouštědel. Dekadické logaritmy stanovených hodnot
rozdělovacího koeficientu by měly ležet v rozmezí +/-0,3.
Metoda HPLC
S cílem zvýšit důvěryhodnost měření musí být provedena
opakovaná stanovení. Hodnoty log P získané
z jednotlivých měření by měly ležet v rozmezí +/-0,1.
VII.1.5.2 Citlivost
Metoda třepací lahve
Měřicí rozsah metody je určen mezí detekce analytické
metody. Ta by měla umožnit stanovení hodnot log P
o/v
v oblasti od -2 do 4 (pokud to podmínky dovolí, lze
tuto oblast rozšířit až do hodnoty log Po/v
rovné 5),
není-li koncentrace rozpuštěné látky v žádné z fází
vyšší než 0,01 mol*l-1
. Metoda HPLC
Metoda HPLC umožňuje stanovení rozdělovacích
koeficientů v rozsahu log P
o/v
od 0 do 6. Obvykle je možné určit rozdělovací koeficient dané
látky s přesností +/-1 řádu vzhledem k hodnotě získané
metodou třepací lahve. Typické korelace lze nalézt
v literatuře (4, 5, 6, 7, 8). Vyšší přesnosti lze
obvykle dosáhnout, jeli korelační závislost založena
na referenčních látkách podobné struktury (9).
VII.1.5.3 Specifičnost
Metoda třepací lahve
Nernstův rozdělovací zákon platí pro zředěné roztoky
jen při konstantní teplotě a konstantním tlaku a pH.
Platí pouze pro čistou látku rozdělenou mezi dvě čistá
rozpouštědla. Jeli současně v jedné nebo obou fázích
přítomno více rozpuštěných látek, může tím být výsledek
ovlivněn.
Disociace nebo asociace rozpuštěných molekul vede
k odchylkám od Nernstova rozdělovacího zákona. Tyto
odchylky se projevují tím, že se rozdělovací koeficient
stává závislým na koncentraci roztoku.
V důsledku existujících mnohonásobných rozdělovacích
rovnováh by tato metoda neměla být použita bez korekcí
na disociovatelné sloučeniny. Pro tyto sloučeniny by
mělo být zváženo použití pufračních roztoků namísto
vody; pH pufračního roztoku by se mělo lišit od pKa
látky nejméně o 1, přičemž se zohlední význam tohoto pH
s ohledem na životní prostředí.
VII.1.6 POPIS METODY
VII.1.6.1 Předběžný odhad rozdělovacího koeficientu
Hodnotu rozdělovacího koeficientu lze nejlépe odhadnout
na základě výpočtu (viz doplněk 1) nebo popřípadě
z poměru rozpustností zkušební látky v čistých
rozpouštědlech (10).
VII.1.6.2 Metoda třepací lahve
VII.1.6.2.1 Příprava
n-Oktanol: Stanovení rozdělovacího koeficientu by mělo
být provedeno s n-oktanolem (oktan1olem) čistoty p.a.
Voda: měla by být použita destilovaná voda nebo
redestilovaná voda ve skleněné nebo křemenné aparatuře.
V případě potřeby by měly být u disociovatelných látek
použity místo vody pufrační roztoky.
Poznámka:
Neměla by být použita voda pocházející přímo z měniče
iontů.
VII.1.6.2.1.1 Předběžné nasycení rozpouštědel
Před stanovením rozdělovacího koeficientu se fáze
rozpouštědlového systému vzájemně nasytí třepáním při
teplotě experimentu. K dosažení tohoto cíle je vhodné
24 h třepat na mechanické třepačce ve dvou velkých
zásobních lahvích vysoce čistý n-oktanol nebo vysoce
čistou vodu, obojí s dostatečným množstvím druhého
rozpouštědla, a poté nechat rozpouštědla stát tak
dlouho, dokud se obě fáze neoddělí a dokud není
dosaženo nasycení.
VII.1.6.2.1.2 Příprava zkoušky
Celkový objem dvoufázového systému by měl téměř
naplňovat zkušební nádobu. Tím se zamezí ztrátám látek
v důsledku odpařování. Poměry objemů a množství látek,
které mají být použity, jsou dány
— předběžným odhadem rozdělovacího koeficientu (viz
výše),
— minimálním množstvím zkušební látky nezbytným pro
postup analýzy, a
— omezením maximální koncentrace v každé fázi na
0,01 mol*l
-1
. Provedou se tři zkoušky. Při první se použije vypočtený
poměr objemů noktanolu a vody; při druhé se tento
poměr dělí dvěma a při třetí se tento poměr násobí
dvěma (např. 1 : 1, 1 : 2, 2 : 1).
VII.1.6.2.1.3 Zkušební látka
Připraví se zásobní roztok v n-oktanolu předem
nasyceném vodou. Koncentrace tohoto zásobního roztoku
by měla být před jeho použitím ke stanovení
rozdělovacího koeficientu přesně stanovena. Tento
roztok by měl být uchováván za podmínek, které zajistí
jeho stálost.
VII.1.6.2.2 Zkušební podmínky
Zkušební teplota by měla být konstantní (+/-1 st.C) a měla
by ležet v rozmezí 20 a 25 st.C
.VII.1.6.2.3 Postup měření
VII.1.6.2.3.1 Ustavení rovnováhy rozdělení
Pro každou ze zkušebních podmínek by měly být
připraveny dvě zkušební nádoby obsahující potřebná
přesně odměřená množství obou rozpouštědel spolu
s nezbytným množstvím zásobního roztoku.
Fáze n-oktanolu je nutné odměřit objemově. Zkušební
nádoby by měly být umístěny do vhodné třepačky, nebo by
měly být třepány ručně. Při použití centrifugační
kyvety spočívá doporučený postup v tom, že se kyveta
rychle otáčí kolem své příčné osy o 180°, takže
případný zachycený vzduch stoupá vzhůru oběma fázemi.
Ze zkušenosti vyplývá, že k ustavení rovnovážného
rozdělení obvykle stačí 50 takových otočení. Pro
jistotu se doporučuje 100 otočení během pěti minut.
VII.1.6.2.3.2 Oddělení fází
V případě potřeby lze oddělení fází provést odstředěním
směsi. Odstředění by mělo být provedeno laboratorní
odstředivkou udržovanou při laboratorní teplotě, nebo,
jeli použita odstředivka bez regulace teploty, by měly
být centrifugační kyvety za účelem ustavení rovnováhy
udržovány alespoň jednu hodinu před analýzou při
zkušební teplotě.
VII.1.6.2.4 Analýza
Za účelem stanovení rozdělovacího koeficientu je nutné
stanovit koncentrace zkušební látky v obou fázích. To
lze provést odebráním alikvotního podílu každé z obou
fází z každé kyvety a pro každou zkušební podmínku a
jejich analýzou zvoleným postupem. Celkové množství
látky přítomné v obou fázích by mělo být vypočteno a
porovnáno s původně dodaným množstvím látky.
Odběr vzorku z vodné fáze je nutné provést postupem
minimalizujícím riziko znečištění stopami n-oktanolu:
k odběru vzorků vodné fáze lze použít skleněnou
injekční stříkačku s vyměnitelnou jehlou. Stříkačka se
nejprve částečně naplní vzduchem. Vzduch se při
průchodu jehly vrstvou n-oktanolu opatrně vypudí. Do
stříkačky se natáhne dostatečný objem vodné fáze.
Stříkačka se z roztoku rychle vytáhne a jehla se sejme.
Obsah stříkačky lze poté použít jako vzorek vodné fáze.
Koncentrace v obou od sebe oddělených fázích by měla
být stanovena nejlépe metodou, která je specifická pro
danou látku. Příklady možných vhodných analytických
metod jsou
— fotometrické metody,
— plynová chromatografie,
— vysokoúčinná kapalinová chromatografie.
VII.1.6.3 Metoda HPLC
VII.1.6.3.1 Příprava
Aparatura
Nezbytným vybavením je kapalinový chromatograf vybavený
bezpulzním čerpadlem a vhodným detekčním zařízením.
Doporučuje se používat nástřikový ventil se
vstřikovacími smyčkami. Přítomnost polárních skupin ve
stacionární fázi může závažně zhoršit účinnost kolony
HPLC. Stacionární fáze by proto měla mít minimální
podíl polárních skupin (11). Lze použít komerční
mikročásticové náplně s reversními fázemi nebo hotové
kolony s náplní. Mezi nástřikem a analytickou kolonou
může být umístěna ochranná předkolona.
Mobilní fáze
K přípravě elučního rozpouštědla se použije methanol
čistoty pro HPLC a voda čistoty pro HPLC, které se před
použitím odplyní. Měla by být provedena isokratická
eluce. Doporučuje se použít směsi methanol/voda
s minimálním obsahem vody 25 %. Obvykle vyhovuje pro
eluci sloučenin o log P = 6 během jedné hodiny při
průtokové rychlosti 1 ml·min
-1
směs methanol / voda
3 : 1 (obj.). U sloučenin s vysokou hodnotou log P může
být nutné zkrátit eluční dobu (stejně tak u
referenčních látek) snížením polarity mobilní fáze nebo
délky kolony. Látky s velmi nízkou rozpustností v noktanolu mají
tendenci při použití metody HPLC vykazovat abnormálně
nízké hodnoty log P
o/v
; píky těchto sloučenin někdy
doprovázejí čelo rozpouštědla. Je to pravděpodobně
způsobeno tím, že proces rozdělení je příliš pomalý,
než aby bylo dosaženo rovnováhy za dobu, po kterou
obvykle trvá dělení metodou HPLC. Pro dosažení
spolehlivé hodnoty může být v takovém případě účinné
snížení průtokové rychlosti nebo snížení poměru
methanol/voda. Zkušební i referenční látka by měly být rozpustné
v mobilní fázi v dostatečných koncentracích
umožňujících jejich detekci. Pouze ve výjimečných
případech mohou být u směsi methanol/voda použita
aditiva, neboť aditiva mění vlastnosti kolony.
V případě chromatogramů získaných při použití aditiv,
musí být použita samostatná kolona téhož typu.
Nevyhovuje-li směs methanolvoda, lze použít směsi
jiných organických rozpouštědel s vodou, např.
ethanolvoda nebo acetonitrilvoda.
Pro disociovatelné látky je kritické pH eluentu. Mělo
by ležet v pracovní oblasti pH kolony, která je obvykle
2 až 8. Doporučuje se použití pufračních roztoků. Je
nezbytné dbát na to, aby nedošlo ke srážení solí a
narušení kolony, ke kterému dochází u některých směsí
organické fáze s pufračním roztokem. Měření pomocí HPLC
se stacionárními fázemi na bázi oxidu křemičitého při
pH vyšším než 8 se nedoporučuje, neboť použití
alkalické mobilní fáze může způsobit rychlé narušení
činnosti kolony.
Rozpouštěné látky
Referenční látky by měly mít nejvyšší dostupnou
čistotu. Sloučeniny, které se mají používat pro
zkoušení nebo kalibraci, se pokud možno rozpustí
v mobilní fázi.
Zkušební podmínky
Teplota by během měření neměla kolísat o více než +/-2 K.
VII.1.6.3.2 Měření
Výpočet mrtvé doby t
0
Mrtvou dobu t
0
je možné stanovit buď pomocí homologické
řady (např. nalkylmethylketonů) nebo nezadržovaných
organických sloučenin (např. thiomočoviny nebo
formamidu). Pro výpočet mrtvé doby t0
s použitím
homologické řady se nastříkne sada alespoň sedmi členů
homologické řady a stanoví se příslušné retenční časy.
Neupravené retenční časy tr(nc+1)
se vynesou jako funkce a
stanoví se absolutní člen a a směrnice b regresní
rovnice:
tr(nc + 1) = a +btr(nc)
(nc = počet atomů uhlíku). Mrtvá doba t0 je dána
vztahem:
t0 = a/(1-b)
Kalibrační křivka
Následujícím krokem je sestrojení korelační závislosti
hodnot log k na log P pro příslušné referenční látky.
V praxi se současně nastříkne soubor 5 až 10
standardních referenčních látek, jejichž log P leží
v očekávané oblasti, a stanoví se retenční časy,
nejlépe zapisovacím integrátorem napojeným na detekční
systém. Vypočtou se příslušné logaritmy kapacitních
faktorů, log k, a vynesou se jako funkce hodnot log P
stanovených metodou třepací lahve. Kalibrace se provádí
v pravidelných intervalech nejméně jednou denně, aby
bylo možné zohlednit případné změny činnosti kolony.
Stanovení kapacitního faktoru zkušební látky
Zkušební látka se nastříkne v co nejmenším množství
mobilní fáze. Stanoví se retenční čas (dvakrát),
umožňující výpočet kapacitního faktoru k. Z korelační
křivky referenčních látek je možné interpolací získat
rozdělovací koeficient zkušební látky. U velmi nízkých
a velmi vysokých rozdělovacích koeficientů je nutná
extrapolace. V těchto případech je nutno věnovat
zvláštní pozornost intervalům spolehlivosti regresní
křivky.
VII.2 DATA
Metoda třepací lahve
Spolehlivost stanovených hodnot P je možné prověřit
srovnáním středních hodnot z opakovaných stanovení
s celkovou střední hodnotou.
VII.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— přesnou specifikaci látky (identitu a nečistoty),
— nejsou-li metody použitelné (např. u povrchově
aktivní látky), měla by být uvedena vypočtená
hodnota nebo odhad založený na individuálních
rozpustnostech látky v noktanolu a vodě,
— všechny informace a poznámky, které mají význam
pro interpretaci výsledků, zvláště s ohledem na
nečistoty a fyzikální stav látky.
Pro metodu třepací lahve:
— výsledek předběžného odhadu, pokud existuje,
— teplotu stanovení,
— údaje o analytických postupech použitých ke
stanovení koncentrací,
— dobu a rychlost odstřeďování, pokud se použilo,
— koncentrace naměřené při každém stanovení v obou
fázích (tzn. uvede se celkem 12 koncentrací),
— hmotnost zkušební látky, objem každé fáze použité
v každé zkušební nádobě a vypočtené celkové
množství zkušební látky, obsažené v jednotlivých
fázích po dosažení rovnováhy,
— vypočtené hodnoty rozdělovacího koeficientu (P) a
střední hodnotu je nutné uvést pro každý soubor
zkušebních podmínek, stejně tak střední hodnotu
ze všech stanovení. Pokud existují náznaky
závislosti rozdělovacího koeficientu na
koncentraci, mělo by to být uvedeno ve zprávě,
— měla by být uvedena směrodatná odchylka
jednotlivých hodnot P od střední hodnoty,
— měl by být také uveden dekadický logaritmus
střední hodnoty P ze všech stanovení,
— vypočtená teoretická hodnota P
o/v
, byla-li
stanovena nebo jeli naměřená hodnota > 104
, — pH použité vody a vodné fáze během experimentu,
— pokud byly použity pufry, zdůvodnění jejich
použití místo vody, jejich složení, koncentrace a
pH, pH vodné fáze před a po experimentu.
Pro metodu HPLC:
— výsledek předběžného odhadu, pokud existuje,
— zkušební látka a referenční látky, jejich
čistota,
— teplotní rozmezí při stanoveních,
— pH, při kterém se prováděla stanovení,
— podrobnosti o analytické a ochranné koloně, o
mobilní fázi a o způsobu detekce,
— retenční data a hodnoty log P z literatury pro
referenční látky použité ke kalibraci,
— podrobnosti o proložené regresní přímce (log k
versus log P),
— průměrná retenční data a interpolovaná hodnota
log P pro zkušební sloučeninu,
— popis zařízení a pracovních podmínek,
— eluční křivky,
— množství zkušební látky a referenčních látek
zavedených do kolony,
— mrtvý čas a způsob jeho měření.
VII.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 107. Decision
of the Council C(81) 30 final.
(2) C. Hansch, A. J. Leo. Substituent Constants for
Correlation Analysis in Chemistry and Biology.
John Wiley, New York, 1979.
(3) Log P and Parameter Database, A tool for the
quantitative prediction of bioactivity (C.
Hansch, chairman, A. J. Leo, dir.): Dostupné:
Pomona College Medical Chemistry Project 1982,
Pomona College, Claremont, California 91711.
(4) L. Renberg, G. Sundström, K. SundhNygärd.
Chemosphere, 1980, 80, 683.
(5) H. Ellgehausen, C. D' Hondt, R. Fuerer. Pestic.
Sci., 1981, 12, 219 (1981).
(6) B. McDuffie. Chemosphere, 1981, vol 10, 73.
(7) W. E. Hammers et al., J. Chromatogr. 1982, 247,
1.
(8) J. E. Haky, A. M. Young. J. Liq. Chromat., 1984,
7. 675.
(9) S. Fujisawa, E. Masuhara. J. Biomed. Mat. Res.,
1981, 15, 787.
(10) O. Jubermann. Verteilen und Extrahieren. V:
Methoden der Organischen Chemie (Houben Weyl),
Allgemeine Laboratoriumspraxis (ed. E. Muller),
Georg Thieme Verlag, Stuttgart, 1958, Band I/1,
223-339.
(11) R. F. Rekker, H. M. de Kort. Euro. J. Med. Chem.
1979, vol 14, 479.
(12) A. Leo, C. Hansch, D. Elkins. Partition
coefficients and their uses. Chem. Rev., 1971,
71, 525.
(13) R. F. Rekker. The Hydrophobic Fragmental
Constant. Elsevier, Amsterdam, 1977.
(14) NF T 20043 AFNOR (1985). Chemical products for
industrial use – Determination of partition
coefficient – Flask shaking method.
(15) C. V. Eadsforth, P. Moser. Chemosphere, 1983, 12,
1459.
(16) A. Leo, C. Hansch, D. Elkins. Chem. Rev., 1971,
71, 525.
(17) C. Hansch, A. Leo, S. H. Unger, K. H. Kim,
D. Nikaitani, E. J. Lien, J. Med Chem. 1973, 16,
1207.
(18) W. B. Neely, D. R. Branson, G. E. Blau. Environ.
Sci. Technol. 1974, 8, 1113.
(19) D. S. Brown, E. W. Flagg. J. Environ. Qual. 1981,
10, 382.
(20) J. K. Seydel, K. J. Schaper. Chemische Struktur
und biologische Aktivität von Wirkstoffen. Verlag
Chemie, Weinheim, New York 1979.
(21) R. Franke. Theoretical Drug Design Methods.
Elsevier, Amsterdam 1984.
(22) Y. C. Martin. Quantitative Drug Design. Marcel
Dekker, New York, Basel 1978.
(23) N. S. Nirrlees, S. J. Noulton, C. T. Murphy,
P. J. Taylor. J. Med. Chem. 1976, 19, 615.
DODATEK 1
Metody výpočtu nebo odhadu
ÚVOD
Obecný úvod do výpočtových metod, data a příklady jsou uvedeny
v příručce Handbook of Chemical Property Estimation Methods
(a).
Vypočtené hodnoty P
o/v
lze použít— k rozhodnutí, která z experimentálních metod je vhodná
(rozsah u třepací lahve: log P
o/v
: -2
až 4, rozsah u
HPLC: log Po/v
: 0 až 6),— k volbě vhodných zkušebních podmínek (např. referenčních
látek pro postupy HPLC, poměr objemů noktanol/voda pro
metodu třepací lahve),
— jako vnitřní laboratorní kontrolu možných
experimentálních chyb,
— k získání odhadu P
o/v
v případech, kdy zkušební metody
nelze z technických důvodů použít.METODA ODHADU
Předběžný odhad rozdělovacího koeficientu
Hodnotu rozdělovacího koeficientu je možné odhadnout
s použitím rozpustnosti zkušební látky v čistých
rozpouštědlech:
Pro tento případ platí:
nasycení coktan-1-ol
Podhad = -----------------------
nasycení cvoda
VÝPOČTOVÉ METODY
Podstata výpočtových metod
Všechny výpočtové metody jsou založeny na formálním dělení
molekul do vhodných podstruktur, pro něž jsou známy spolehlivé
hodnoty přírůstků log P
o/v
. Hodnota log Po/v
celé molekuly se
poté vypočte jako součet hodnot pro příslušné fragmenty plus
součet korekčních členů pro intramolekulární interakce.
Existují seznamy konstant fragmentů a korekčních členů (b, c,
d, e). Některé se pravidelně aktualizují (b).Kritéria jakosti
Spolehlivost výpočtové metody obecně klesá s rostoucí
složitostí zkoumané sloučeniny. V případě jednoduchých molekul
s nízkou molekulovou hmotností a jednou nebo dvěma funkčními
skupinami lze očekávat, že odchylky hodnot log P
o/v
získaných
různými fragmentačními metodami od naměřené hodnoty budou
v rozmezí od 0,1 do 0,3. U složitějších molekul může být
rozpětí chyby větší. Závisí to na spolehlivosti a dostupnosti
konstant pro fragmenty a rovněž na schopnosti zjistit
intramolekulární interakce (např. vodíkové vazby) a na
správném používání korekčních členů (což není obtížné při
použití počítačového programu CLOGP3) (b). V případě
disociujících látek je důležité správně zohlednit náboj nebo
stupeň disociace.Postupy výpočtu
Hanschova pímetoda
Původní konstanta hydrofobnosti substituentu pí zavedená
Fujitou et al. (f) je definována jako
pí
x
= log Po/v
(PhX) - log Po/v
(PhH)
kde P
o/v
(PhX) je rozdělovací koeficient aromatického derivátu
a Po/v
(PhH) rozdělovací koeficient výchozí sloučeniny
(např. pí Cl = log Po/v
(C6
H5
Cl) -
log Po/v
(C6
H6
) = 2,84 - 2,13 = 0,71).Ze své definice je pímetoda použitelná především u
aromatických substituentů. Hodnoty pí byly pro velký počet
substituentů uspořádány do tabulek (b, c, d). Používají se
k výpočtu log P
o/v
aromatických molekul nebo substruktur.
Rekkerova metoda
Podle Rekkera (g) se hodnota log P
o/v
vypočte takto:log Po/v= suma aifi+ suma (interakční člen) i j
kde f
i
představuje konstanty různých molekulárních fragmentů a
ai četnost jejich výskytu ve vyšetřované molekule. Korekční
členy je možné vyjádřit jako souhrnný násobek jediné konstanty
Cm (tzv. „magické konstanty“). Konstanty pro molekulární
fragmenty fi a Cm byly stanoveny ze seznamu 1 054
experimentálních hodnot Po/v
(pro 825 sloučenin) pomocí
vícenásobné regresní analýzy (c, h). Interakční členy se určí
podle stanovených pravidel popsaných v literatuře (e, h, i).Hanschova-Leova metoda
Podle Hansche a Lea (c) se hodnota log P
o/v
vypočte z výrazu:logPo/v= suma aifi+ suma bjFji j
kde f
i
představuje konstanty různých molekulárních fragmentů,
Fj
korekční členy a ai
, bj
odpovídající četnosti výskytů. Na
základě experimentálních hodnot Po/v
byl pokusně sestaven
seznam hodnot pro atomové a skupinové fragmenty a seznam
korekčních členů Fj
(tzv. „faktorů“). Korekční členy byly
setříděny do několika různých tříd (a, c). Zohlednění všech
pravidel a korekčních členů je poměrně složité a časově
náročné. Byly vyvinuty sady softwaru (b).Kombinovaná metoda
Výpočet log P
o/v
složitých molekul lze značně zdokonalit,
jestliže se molekula rozdělí do větších podstruktur, pro něž
existují spolehlivé hodnoty pocházející buď z tabulek (b, c),
nebo z vlastních měření. Tyto fragmenty (např. heterocykly,
antrachinon, azobenzen) lze poté kombinovat s Hanschovými -
hodnotami nebo s Rekkerovými nebo Leovými konstantami pro
fragmenty.Poznámky
i) Výpočetní metody lze použít pro částečně nebo úplně
disociované sloučeniny pouze tehdy, lzeli vzít v úvahu
nezbytné korekční faktory.
ii) Pokud lze předpokládat přítomnost intramolekulárních
vodíkových vazeb, je nutné přičíst odpovídající korekční
členy (přibližně 0,6 až 1,0 logaritmu P
o/v
) (a). O
přítomnosti těchto vazeb lze usuzovat z prostorových
modelů nebo ze spektroskopických dat molekuly.iii) Může-li existovat několik tautomerních forem, měla by být
jako základ pro výpočet použita nejpravděpodobnější
forma.
iv) Pečlivě by měly být sledovány přepracované seznamy
konstant fragmentů.
Protokol o zkoušce
Při použití výpočtové metody nebo metody odhadu by měl
protokol o zkoušce pokud možno obsahovat následující údaje:
— popis látky (směs, nečistoty atd.),
— známky přítomnosti intramolekulárních vodíkových vazeb,
disociace, nábojů a dalších neobvyklých efektů (např.
tautomerie),
— popis výpočtové metody,
— označení nebo uvedení databáze,
— zvláštnosti při volbě fragmentů,
— vyčerpávající dokumentaci výpočtů.
LITERATURA
(a) W. J. Lyman, W. F. Reehl, D. H. Rosenblatt (ed). Handbook
of Chemical Property Estimation Methods. McGraw-Hill, New
York, 1983.
(b) Log P Database and Med. Chem. Software (Program CLOGP-3).
Pomona College. Medicinal Chemistry Project, Claremont,
California 91711, USA.
(c) C. Hansch, A. J. Leo. Substituent Constants for
Correlation Analysis in Chemistry and Biology. John
Wiley, New York, 1979.
(d) A. Leo, C. Hansch, D. Elkins. Chem. Rev. 1971, 71, 525
(e) R. F. Rekker, H. M. de Kort.
Eur. S. Med. Chem. – Chim. Ther. 1979, 14, 479.
(f) T. Fujita, J. Iwasa, C. Hansch. J. Amer. Chem. Soc.,
1964, 86, 5175.
(g) R. F. Rekker. The Hydrophobic Fragmental Constant,
Pharmacochemistry Library. Elsevier, New York, 1977, 1.
(h) C. V. Eadsforth, P. Moser. Chemosphere, 1983, 12, 1459.
(i) R. A. Scherrer, ACS, American Chemical Society,
Washington D.C., 1984, Symposium Series 255, 225.
DODATEK 2
Doporučené referenční látky pro metodu HPLC
------------------------------------- ----------------------------------- Číslo Referenční látka log Po/vpKa------------------------------------- ----------------------------------- 1 butan2on 0,3 2 4acetylpyridin 0,5 3 anilin 0,9 4 acetanilid 1,0 5 benzylalkohol 1,1 6 4-methoxyfenol 1,3 pKa= 10,26 7 kyselina fenoxyoctová 1,4 pKa= 3,12 8 fenol 1,5 pKa= 9,92 9 2,4dinitrofenol 1,5 pKa= 3,96 10 benzonitril 1,6 11 fenylacetonitril 1,6 12 4methylbenzylalkohol 1,6 13 acetofenon 1,7 14 2nitrofenol 1,8 pKa= 7,17 15 kyselina 3nitrobenzoová 1,8 pKa= 3,47 16 4chloranilin 1,8 pKa= 4,15 17 nitrobenzen 1,9 18 3fenylpropan2ol 1,9 19 kyselina benzoová 1,9 pKa= 4,19 20 pkresol 1,9 pKa= 10,17 21 kyselina skořicová 2,1 pKa= 3,89 cis 4,44 trans 22 anisol 2,1 23 methylbenzoát 2,1 24 benzen 2,1 25 kyselina 3methylbenzoová 2,4 pKa= 4,27 26 4chlorfenol 2,4 pKa= 9,1 27 trichlorethylen 2,4 28 atrazin 2,6 29 ethylbenzoát 2,6 30 2,6dichlorbenzonitril 2,6 31 kyselina 3chlorbenzoová 2,7 pKa= 3,82 32 toluen 2,7 33 naftalen1ol 2,7 pKa= 9,34 34 2,3dichloranilin 2,8 35 chlorbenzen 2,8 36 allylfenylether 2,9 37 brombenzen 3,0 38 ethylbenzen 3,2 39 benzofenon 3,2 40 4fenylfenol 3,2 pKa= 9,54 41 thymol 3,3 42 1,4dichlorbenzen 3,4 43 difenylamin 3,4 pKa= 0,79 44 naftalen 3,6 45 fenylbenzoát 3,6 46 isopropylbenzen 3,7 47 2,4,6trichlorfenol 3,7 pKa= 6 48 bifenyl 4,0 49 benzylbenzoát 4,0 50 2,4dinitro6sekbutylfenol 4,1 51 1,2,4trichlorbenzen 4,2 52 kyselina dodekanová 4,2 53 difenylether 4,2 54 nbutylbenzen 4,5 55 fenanthren 4,5 56 fluoranthen 4,7 57 dibenzyl 4,8 58 2,6difenylpyridin 4,9 59 trifenylamin 5,7 60 DDT 6,2 ------------------------------------- ----------------------------------- Jiné referenční látky s nízkou hodnotou log Po/v------------------------------------- ----------------------------------- 1 kyselina nikotinová -0,07 ------------------------------------- -----------------------------------
VIII. METODA PRO STANOVENÍ VÝBUŠNÝCH VLASTNOSTÍ – METODA A.14
PODLE PŘÍLOHY SMĚRNICE 92/69/EHS
VIII.1 METODA
VIII.1.1 ÚVOD
Metoda pro zjišťování výbušnosti látky stanovuje
zkušební postup pro zjištění, zda látka je z hlediska
výbuchu citlivá na působení tepla, na náraz nebo na
tření, a to za podmínek uvedených v této metodě.
Metoda poskytuje údaje pro ohodnocení možnosti
vyvolání výbuchu působením uvedených podnětů; neslouží
však ke zjištění, zda je látka schopna vybuchovat za
jakýchkoliv podmínek.
Látka se podrobí následujícím zkouškám
a) zkoušce citlivosti na působení tepla,
b) zkoušce citlivosti na náraz,
c) zkoušce citlivosti na tření,
Při uvedených zkouškách lze použít i alternativní
přístroje, a to za podmínky, že jsou mezinárodně
uznávané a že jimi získané výsledky odpovídají
výsledkům získaným na přístrojích uvedených v příloze.
Zkoušky se neprovádějí, lze-li u látky na základě
odborného posouzení vyslovit jednoznačný závěr, že se
látka nemůže rychle rozkládat za vývoje plynů a
uvolňování tepla a nepředstavuje tedy nebezpečí
výbuchu.
VIII.1.2 DEFINICE A REFERENČNÍ LÁTKY
Pro účely této vyhlášky se považuje za výbušnou látku
taková chemická látka nebo chemický přípravek, která je
schopna vybuchnout působením tepla nebo která z
hlediska možnosti vybuchnout je citlivá na náraz nebo
na tření v přístroji uvedeném v příloze nebo je
citlivější na náraz nebo na tření než 1,3-dinitrobenzen
v alternativním přístroji,
Za referenční látku se považuje
a) krystalický 1,3-dinitrobenzen, který prochází sítem
o velikosti oka 0,5 mm, a to pro zkoušení citlivosti na
náraz a na tření,
b) perhydro-1,3,5-trinitro-1,3,5-triazin (označovaný
jako RDX nebo hexogen nebo cyklonit - CAS 121-82-4)
rekrystalovaný z vodného cyklohexanonu, prosátý za
mokra na sítě 250 mikrom a zachycený na sítě 150 mikrom, sušený
při 103 +/- 2 st. C po dobu 4 hodin, pro druhou sérii
zkoušek.
VIII.1.3 PRINCIP METODY
VIII.1.3.1 Předběžná zkouška
Před provedením zkoušek se pro zajištění bezpečnosti
provádí předběžná zkouška.
Předběžná zkouška se provádí s velmi malými vzorky
látky, přibližně 10 mg, a to zahříváním neuzavřené
látky v plameni plynového hořáku, nárazem v jakémkoliv
zařízení a třením za použití paličky proti podložce
nebo v jiném zařízení pro zkoušení citlivosti na tření.
Účelem předběžné zkoušky je zjistit, zda látka není tak
citlivá a výbušná, že předepsanou zkoušku citlivosti,
zvláště zkoušku citlivosti na působení tepla, je nutné
provádět za použití ochranných opatření, která by
zamezila poranění osoby provádějící zkoušku.
Výsledky předběžné zkoušky neslouží k hodnocení
výbušnosti látky.
VIII.1.3.2 Zkouška citlivosti na působení tepla
Při této zkoušce se látka zahřívá v ocelové trubce
uzavřené clonami. Při této zkoušce se zjišťuje, zda je
látka náchylná k výbuchu za podmínek intenzivního
zahřívání a předepsaného utěsnění.
VIII.1.3.3 Zkouška citlivosti na náraz
Při této zkoušce se látka zkouší závažím předepsané
hmotnosti, které se spouští z předepsané výšky.
VIII.1.3.4 Zkouška citlivosti na tření
Při této zkoušce se pevná nebo pastovitá látka zkouší
třením mezi standardními povrchy za předepsaných
podmínek zatížení a vzájemného pohybu. U kapalin se
zkouška třením neprovádí.
VIII.1.4 POPIS METODY
VIII.1.4.1 Zkouška citlivosti na působení tepla
VIII.1.4.1.1 Zařízení
Zařízení je tvořeno ocelovou trubkou k jednomu
použití se znovupoužitelným uzavíracím zařízením
(obrázek 1) instalovanou v ohřívacím a ochranném
zařízení. Každá trubka je hlubokotažená z ocelového
plechu. Její vnitřní průměr je 24 mm, délka 75 mm a
tloušťka stěny 0,5 mm. Na otevřeném konci trubky je
příruba sloužící k uzavření trubky sestavou clony.
Sestava je tvořena clonou se středovým otvorem
odolnou vůči tlaku připevněnou k trubce pomocí
dvoudílného šroubového spoje (matice a závitová
příruba). Matice a závitová příruba jsou
zhotoveny z chrom-manganové oceli, která je do
800 st. C nejiskřivá. Clony mají tloušťku 6 mm, jsou
vyrobeny ze žáruvzdorné oceli a tvoří řadu podle
velikosti otvorů.
VIII.1.4.1.2 Podmínky zkoušky
Látka se obvykle zkouší ve stavu, v jakém je
dodána. V některých případech, např. když je lisovaná,
litá nebo jiným způsobem zhutněná, může být zkoušena po
rozdrcení.
U pevných látek se hmotnost látky použité v každé
zkoušce určí ve dvou etapách. V první etapě se zvážená
trubka naplní 9 cm
3
látky a po celém průřezu trubky
se látka stlačí silou 80 N. Z bezpečnostních důvodů
nebo v případech, kdy stlačováním může dojít ke změně
fyzikální formy vzorku, lze použít jiný způsob plnění;
například je-li látka velmi citlivá na tření, není
vhodné její stlačování. Je-li látka stlačitelná, přidá
se další množství této látky a stlačuje se, až je
trubka zaplněna do vzdálenosti 55 mm od horního okraje.
Zjistí se celkové množství látky použité pro naplnění
do úrovně 55 mm od horního okraje a přidají se další
2 podíly látky, přičemž každý se stlačí silou 80 N.
Látka se pak podle potřeby bud' přidá a stlačí, nebo
odebere tak, aby trubka byla naplněna do úrovně 15 mm
od horního okraje. Zjištěná celková hmotnost látky je
základem pro provedení druhé etapy. Při ní se
nejprve vnese do trubky třetina z hmotnosti zjištěné v
první etapě a stlačí se. Vnesou se další 2 podíly,
stlačí se silou 80 N a podle potřeby se přidá nebo
odebere látka v trubce na úroveň 15 mm od horního
okraje trubky. Množství pevné látky zjištěné ve druhé
etapě se použije pro každý pokus; naplnění se
provede se 3 stejnými množstvími a každé z nich se
stlačí na objem 9 cm3
bez ohledu na to, jaké síly
bude zapotřebí. Pro usnadnění lze k tomu použít
rozpěrné kroužky. Kapaliny a gely se naplní do trubky do výšky 60 mm.
Zvláštní pozornost je třeba věnovat gelům, aby
nedošlo k tvorbě dutin. Zezdola se na trubku navleče
závitová příruba, vloží se vhodná clona a po nanesení
mazadla na bázi disulfidu molybdeničitého se matice
utáhne. Je nutné se přesvědčit, zda nějaká látka
nezůstala zachycena mezi přírubou a clonou nebo v
závitech.
Naplněná a uzavřená trubka se zahřívá propanem
odebíraným přes průtokoměr z průmyslové tlakové
láhve s regulátorem tlaku seřízeným na rozmezí 6
až 7 kPa. Propan se rozděluje rozdělovacím
potrubím stejnoměrně do 4 hořáků, což se ověří
vizuálně pozorováním plamenů hořáků. Hořáky jsou
umístěny kolem zkušební trubky (obrázek 1). 4 hořáky
mají celkovou spotřebu přibližně 43,2 dm
3
propanu za
minutu. Lze použít alternativní palivo a hořáky, avšak
rychlost ohřevu musí být stejná, jak je uvedeno na
obrázku 3. U všech zařízení se musí pravidelně
kontrolovat rychlost ohřevu za použití trubek
naplněných dibutylftalátem (obrázek 3).VIII.1.4.1.3 Provedení zkoušky
Každá zkouška se provádí do roztržení trubky nebo
až doba ohřevu dosáhne 5 minut. Nejprve se provede
série 3 zkoušek s clonou o průměru otvoru 6 mm, a
pokud nedojde k výbuchu, provede se druhá série 3
zkoušek s clonou o průměru otvoru 2 mm. Dojde-li
k výbuchu u kterékoliv zkušební série, nevyžadují se
další zkoušky.
Projevem výbuchu je roztržení trubky na 3 nebo více
částí, z nichž některé mohou být vzájemně spojeny
úzkými proužky kovu (obrázek 2). Zkouška, při níž
se vytvoří méně částí nebo nevzniknou žádné části,
se považuje za zkoušku, při níž nedošlo k výbuchu.
VIII.1.4.1.4 Vyhodnocení zkoušky
Zkouška se považuje za pozitivní, pokud dojde
k výbuchu u kterékoliv zkušební série.
VIII.1.4.2 Zkouška citlivosti na náraz
VIII.1.4.2.1 Zařízení
Základními částmi obvyklých zařízení s padacím kladivem
je blok z šedé litiny s podstavcem, podložka
(kovadlina), sloup, vodicí lišty, padací závaží
(kladivo), zadržovací a uvolňovací zařízení a
držák vzorku (obrázek 4). Ocelová podložka
(kovadlina) o průměru 100 mm a výšce 70 mm je
přišroubována k horní straně ocelo-litinového bloku o
délce 230 mm, šířce 250 mm a výšce 200 mm se
základovou (litinovou) deskou o délce 450 mm, šířce
450 mm a výšce 60 mm. Sloup tvořený bezešvou taženou
ocelovou trubkou je připevněn držákem přišroubovaným na
zadní stranu ocelo-litinového bloku. 4 šrouby ukotvují
zařízení k betonovému bloku o rozměrech 60 x 60 x
60 cm takovým způsobem, že vodicí lišty jsou přesně
kolmo a padací závaží padá volně. Vhodné je použít
závaží o hmotnosti 5 a 10 kg z pevné oceli. Úderová
hlava každého závaží je z tvrzené oceli HRC 60 až 63 o
minimálním průměru 25 mm.
Zkoušený vzorek se uzavře do zkušebního přípravku
tvořeného 2 souosými ocelovými válci umístěnými
nad sebou a vodicím pouzdrem tvořeným dutým
ocelovým válcem. Plné ocelové válce o průměru mezi
10 - 0,003 mm a 10 - 0,005 mm a výšce 10 mm mají
vyleštěné plochy, zakulacené hrany s poloměrem
zakřivení 0,5 mm a tvrdost HRC 58 až 65. Dutý
válec musí mít vnější průměr 16 mm, vyleštěný
vyvrtaný otvor o průměru mezi 10 + 0,005 mm a
10 + 0,010 mm a výšku 13 mm. Sestavený zkušební
přípravek se umístí na výměnnou mezipodložku o průměru
26 mm a výšce 26 mm, který je vystředěn středícím
kroužkem s otvory pro odvod dýmů.
VIII.1.4.2.2 Podmínky zkoušky
Objem vzorku činí 40 mm
3
nebo takový objem, který je
vhodný pro alternativní zařízení. Pevné látky se
zkoušejí v suchém stavu a připravují se následujícím
způsobem: a) práškové látky se prosejí sítem o velikosti
oka 0,5 mm; ke zkoušení se použije veškerý podíl,
který projde sítem,
b) lisované, lité nebo jiným způsobem zhutněné
látky se rozdrtí na malé kousky a prosejí; pro
zkoušení látky se jako reprezentativní vzorek
původní látky použije prosetý podíl o velikosti
částic od 0,5 mm do 1 mm.
Látky dodávané ve formě pasty se zkoušejí pokud možno
v suchém stavu nebo po odstranění nejvýše možného
množství ředidla. Kapalné látky se zkoušejí s mezerou
1 mm mezi horním a dolním ocelovým válcem.
VIII.1.4.2.3 Provedení zkoušky
U série 6 zkoušek se pustí závaží o hmotnosti 10 kg
z výšky 0,40 m (40 J). Dojde-li během těchto 6
zkoušek při 40 J k výbuchu, musí se provést další
série 6 zkoušek s puštěním závaží o hmotnosti 5 kg z
výšky 0,15 m (7,5 J). V jiných zařízeních se vzorek
porovnává se zvolenou referenční látkou za použití
stanoveného postupu (např. postup up-and-down).
VIII.1.4.2.4 Vyhodnocení zkoušky
Výsledek se považuje za pozitivní, jestliže se při
kterékoliv zkoušce nejméně jednou zaznamená výbuch
(třesk nebo plamen), nebo při zkouškách v jiných
zařízeních je zkoušená látka citlivější než 1,3-
dinitrobenzen nebo RDX.
VIII.1.4.3 Zkouška citlivosti na tření
VIII.1.4.3.1 Provedení
Třecí zařízení (obrázek 5) je tvořeno základovou deskou
z lité oceli, na které je upevněno třecí
zařízení. To je tvořeno nepohyblivým porcelánovým
kolíkem a pohyblivou porcelánovou destičkou.
Porcelánová destička je upevněna na saních vedených 2
vodícími lištami. Saně jsou připojeny k elektromotoru
ojnicí, excentrickou vačkou a vhodným ozubeným
převodem tak, že porcelánová destička vykonává pod
porcelánovým kolíkem pohyb tam a zpět na délce
dráhy 10 mm. Porcelánový kolík se může zatížit silou
buď 120 N, nebo 360 N.
Rovné porcelánové destičky jsou vyrobeny z bílého
technického porcelánu o drsnosti 9 až 32 mikrom o délce
25 mm, šířce 25 mm a výšce 5 mm. Válcový
porcelánový kolík je rovněž vyroben z bílého
technického porcelánu a má délku 15 mm a průměr 10 mm
a zdrsněné kulové plochy s poloměrem zakřivení 10 mm.
VIII.1.4.3.2 Podmínky zkoušky
Objem vzorku činí 10 mm
3
nebo takový objem, který je
vhodný pro alternativní zařízení. Pevné látky se
zkoušejí v suchém stavu a připravují se následujícím
způsobem: a) práškové látky se prosejí sítem o velikosti
oka 0,5 mm; ke zkoušení se použije veškerý podíl,
který projde sítem,
b) lisované, lité nebo jiným způsobem zhutněné látky se
rozdrtí na malé kousky a prosejí; pro zkoušení
látky se použije prosetý podíl o velikosti částic
menší než 0,5 mm.
Látky dodávané ve formě pasty se zkoušejí pokud možno
v suchém stavu. Není-li možné připravit látku v suchém
stavu, zkouší se pasta, a to po odstranění nejvýše
možného množství ředidla, ve formě proužku o tloušťce
0,5 mm, šířce 2 mm a délce 10 mm připraveného v
tvarovací formě.
VIII.1.4.3.3 Provedení zkoušky
Porcelánový kolík se přiloží na zkoušený vzorek a
zatíží se. Při provádění zkoušky musí být rýhy v
porcelánové destičce příčně ke směru pohybu. Je nutné
dbát na to, aby kolík zůstal na vzorku, aby pod
kolíkem zůstalo ležet dostatečné množství vzorku a
také aby se destička pohybovala správně pod kolíkem. U
pastovitých látek se pro nanesení látky na destičku
používá měrka 0,5 mm silná s otvorem 2 x 10 mm.
Porcelánová destička se musí pohybovat pod
porcelánovým kolíkem po dráze 10 mm tam a zpět za
0,44 s. Každá část povrchu destičky a kolíku se smí
použít pouze jednou; 2 konce každého kolíku slouží pro
2 pokusy a každá ze 2 stran destičky slouží pro 3
pokusy.
Série 6 zkoušek se provádí se zatížením 360 N.
Získá-li se pozitivní výsledek během těchto 6
zkoušek, musí se provést další série 6 zkoušek se
zatížením 120 N. U jiných zařízení se vzorek
porovnává se zvolenou referenční látkou za použití
stanoveného postupu (např. postup up-and-down).
VIII.1.4.3.4 Vyhodnocení zkoušky.
Výsledek se považuje za pozitivní, jestliže se nejméně
jednou zaznamená výbuch (třesk, praskání, jiskření nebo
plamen) při kterékoliv zkoušce nebo zkoušená látka
splňuje ekvivalentní kritéria v jiných zkouškách.
VIII.2 DATA
Zkoušená látka se považuje za výbušnou ve smyslu
zákona, pokud se při její zkoušce citlivosti na
působení tepla, náraz nebo tření získá pozitivní
výsledek.
VIII.3 ZPRÁVA
Zpráva o zkoušce obsahuje, pokud je to možné, zejména
následující informace:
a) identifikaci, chemické složení, čistotu a
vlhkost zkoušené látky,
b) fyzikální formu vzorku a informace, zda se
vzorek drtil, mlel nebo proséval,
c) údaje zjištěné při zkoušce citlivosti na
působení tepla, například hmotnost vzorku a počet
úlomků,
d) pozorované jevy při zkoušce citlivosti na náraz
nebo při zkoušce citlivosti na tření, například
tvorba značného množství dýmu nebo úplný rozklad,
plameny, jiskry, třesk nebo praskání,
e) výsledky každého typu zkoušky,
f) zdůvodnění použití alternativního přístroje a
důkaz srovnatelnosti získaných výsledků s výsledky
získanými s přístrojem uvedeným v této metodě,
g) poznámky, které mohou mít význam pro správné
hodnocení výsledků, například odkazy na zkoušky
podobných látek,
h) další poznámky, které mají vztah k interpretaci
výsledků.
Ve zprávě o zkoušce se uvádí také všechny výsledky,
které jsou považovány za chybné, anomální nebo
nereprezentativní. Jestliže byly některé hodnoty
vyřazeny, je nutné podat vysvětlení a uvést všechny
výsledky náhradních nebo doplňkových zkoušek. Pokud
není možno anomální výsledek kvalifikovaně vysvětlit,
je třeba jej přijmout tak, jak byl dosažen, a látku
ohodnotit způsobem odpovídajícím dosaženému výsledku.
VIII.4 LITERATURA
(1) Recommendations on the Transport of Dangerous
Goods: Tests and criteria, 1990, United Nations, New
York.
(2) Bretherick, L., Handbook of Reactive Chemical
Hazards, 4th edition, Butterworths, London, ISBN 0-
750-60103-5, 1990.
(3) Koenen, H., Ide, K.H. and Swart, K.H.,
Explosivstoffe, 1961, vol. 3, 6 – 13 a 30 – 42.
(4) NF T 20-038 (Sept. 85). Chemical products for
industrial use – Determination of explosive risk.
Obrázek 1
Zařízení na zkoušku citlivosti na působení tepla
(všechny rozměry v mm)
Obrázek 2
Zkoušku citlivosti na působení tepla
Příklady roztržení trubky
Obrázek 3
Kalibrace rychlosti ohřevu pro zkoušku citlivosti na působení tepla
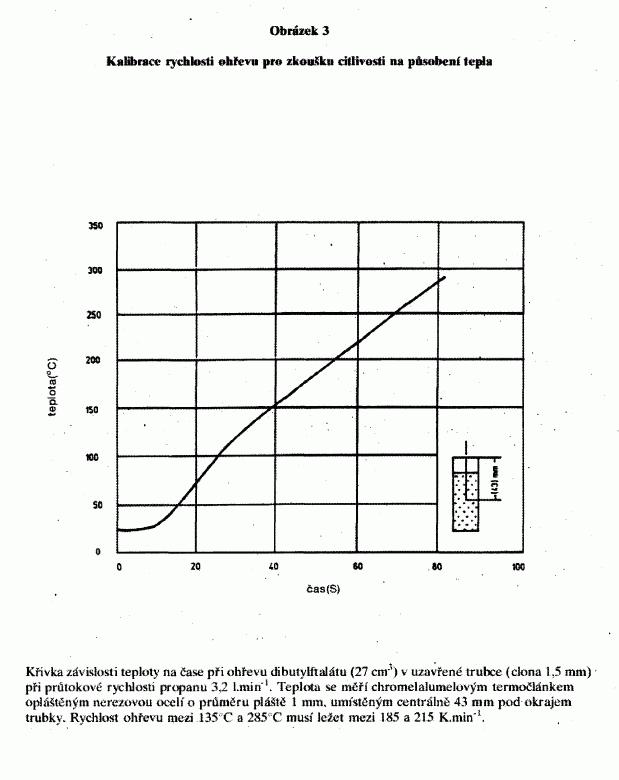
Obrázek 4
Přístroj pro zkoušku citlivosti na náraz
(všechny rozměry v mm)
Obrázek 5
Přístroj pro zkoušku citlivosti na tření
IX. METODA PRO STANOVENÍ ČÍSELNĚ STŘEDNÍ MOLEKULOVÉ
HMOTNOSTI A DISTRIBUCE MOLEKULOVÉ HMOTNOSTI POLYMERŮ –
METODA A.18 PODLE PŘÍLOHY SMĚRNICE KOMISE 98/73/ES ZE DNE
18. ZÁŘÍ 1998, KTEROU SE PO ČTYŘIADVACÁTÉ PŘIZPŮSOBUJE
TECHNICKÉMU POKROKU SMĚRNICI RADY 67/548/EHS O SBLIŽOVÁNÍ
PRÁVNÍCH A SPRÁVNÍCH PŘEDPISŮ TÝKAJÍCÍCH SE KLASIFIKACE,
BALENÍ A OZNAČOVÁNÍ NEBEZPEČNÝCH LÁTEK (DÁLE JEN
„SMĚRNICE 98/73/ES“)
IX.1. METODA
Tato metoda gelové permeační chromatografie je
replikou metody OECD TG 118 (1996). Základní
principy a další technické informace jsou uvedeny
v odkaze 1.
IX.1.1 Úvod
Vlastnosti polymerů jsou tak rozdílné, že je
nemožné popsat jedinou metodu a stanovit přesně
podmínky separace a hodnocení, které by pokryly
všechny eventuality a specifika vyskytující se
při separaci polymerů. Zejména pro komplexní
polymerní systémy není gelová permeační
chromatografie (GPC) vždy vhodná. Neníli GPC
použitelná, může být molekulová hmotnost
stanovena jinými metodami (viz příloha).
V takových případech by měly být uvedeny veškeré
podrobnosti a zdůvodnění použité metody.
Popsaná metoda je založena na normě DIN 55672
(1). Podrobné informace o provádění experimentů a
o hodnocení dat lze nalézt v uvedené normě DIN.
V případě, že jsou nezbytné úpravy
experimentálních podmínek, musí být změny
zdůvodněny. Mohou být použity jiné normy, jsouli
uvedeny kompletní odkazy na ně. V popsané metodě
jsou ke kalibraci použity vzorky polystyrenu o
známé polydisperzitě a metoda může být upravena
tak, aby byla vhodná pro určité polymery, např.
vodorozpustné větvené polymery s dlouhým
řetězcem.
IX.1.2 Definice a jednotky
Číselně střední molekulová hmotnost M
n
a
hmotnostně střední molekulová hmotnost Mw
se
stanoví pomocí následujících rovnic:
kde Hije výška signálu detektoru nad základnou pro retenční objem Vi, Mije molekulová hmotnost frakce polymeru pro retenční objem Vi, a n je počet dat.
Šířka distribuce molekulové hmotnosti, která je
mírou disperzity systému, je dána poměrem M
w
/Mn
.IX.1.3 Referenční látky
Vzhledem k tomu, že GPC je relativní metoda, musí
být provedena kalibrace. K tomuto účelu se
obvykle používá lineární polystyrenový standard
s úzkou distribucí se známými středními
molekulovými hmotnostmi M
n
a Mw
a se známým
rozdělením molekulové hmotnosti. Kalibrační
křivka může být pro stanovení molekulové
hmotnosti neznámého vzorku použita pouze tehdy,
bylyli podmínky separace vzorku a standardů
identické. Pevný vztah mezi molekulovou hmotností
a elučním objemem je platný pouze za specifických
podmínek určitého experimentu. Podmínky zahrnují
především teplotu, rozpouštědlo (nebo směs
rozpouštědel), chromatografické podmínky a
separační kolonu nebo systém separačních kolon. Molekulové hmotnosti stanovené tímto způsobem
jsou relativními hodnotami a označují se jako
„molekulární hmotnosti polystyrenového
ekvivalentu“. To znamená, že se molekulová
hmotnost bude v závislosti na strukturních a
chemických rozdílech mezi vzorkem a standardem od
absolutní hodnoty více či méně lišit. Použijíli
se jiné standardy, např. polyethylenglykol,
polyethylenoxid, polymethylmethakrylát,
polyakrylová kyselina, musí být použití
zdůvodněno.
IX.1.4 Princip zkušební metody
Rozdělení molekulové hmotnosti vzorku i střední
molekulové hmotnosti (M
n
, Mw
) lze stanovit
metodou GPC. GPC je speciální typ kapalinové
chromatografie, při němž je vzorek rozdělen podle
hydrodynamických objemů jeho jednotlivých složek
(2). Separace probíhá při průchodu vzorku kolonou
naplněnou porézním materiálem, obvykle organickým
gelem. Malé molekuly proniknou póry, zatímco
velké molekuly jsou zadrženy. Průchod velkých
molekul je tedy kratší a jsou eluovány nejdříve.
Středně velké molekuly pronikají některými póry a
jsou eluovány později. Nejmenší molekuly se
středním hydrodynamickým poloměrem menším než
velikost pórů gelu pronikají všemi póry. Tyto
molekuly jsou eluovány nakonec.
V ideálním případě závisí separace pouze na
velkosti molekul, ale v praxi je obtížné vyhnout
se alespoň některým rušivým absorpčním jevům.
Nestejnoměrná náplň kolony a mrtvé objemy mohou
situaci zhoršit (2).
Detekce se provádí například prostřednictvím
měření indexu lomu nebo absorpce UV a dává
jednoduchou distribuční křivku. Máli být však
křivce přiřazena skutečná molekulová hmotnost, je
nezbytné kalibrovat kolonu průchodem polymerů o
známé molekulové hmotnosti a v ideálním případě
s v podstatě podobnou strukturou, např. různé
polystyrenové standardy. Křivka má zpravidla
gaussovský tvar, někdy deformovaný prodloužením
na straně nízké molekulové hmotnosti, přičemž
svislá osa udává hmotnostní podíl různých
molekulových hmotnostní a na vodorovné ose jsou
vynesen logaritmus molekulové hmotnosti.
IX.1.5 Kritéria kvality
Opakovatelnost (relativní směrodatná odchylka:
RSD) elučního objemu by měla být lepší než 0,3 %.
Požadovaná opakovatelnost musí být zajištěna
korekcí prostřednictvím standardů, jeli
chromatogram hodnocen jako funkce času a
neodpovídá výše uvedenému kritériu (1).
Polydisperzity jsou závislé na molekulových
hmotnostech standardů. V případě polystyrenových
standardů jsou typickými hodnotami
Mp < 2 000 Mw/Mn < 1,20
2 000 = Mp = 106 Mw/Mn < 1,05
Mp > 106 Mw/Mn < 1,20
(Mp je molekulová hmotnost standardu v maximu
píku)
IX.1.6 Popis zkušební metody
IX.1.6.1 Příprava standardních roztoků polystyrénu
Polystyrenové standardy se rozpustí opatrným
smícháním se zvoleným elučním činidlem. Při
přípravě roztoků se musí zohlednit doporučení
výrobce.
Koncentrace zvolených standardů závisí na různých
faktorech, např. na vstřikovaném objemu,
viskozitě roztoku a citlivosti analytického
detektoru. Maximální vstřikovaný objem musí být
přizpůsoben délce kolony, aby nedošlo
k přesycení. Typické vstřikované objemy pro
analytickou separaci pomocí GPC s kolonou o
rozměrech 30×7,8 mm jsou obvykle 40 až 100 µl.
Větší objemy jsou možné, ale neměly by překročit
250 µl. Optimální poměr mezi vstřikovaným objemem
a koncentrací musí být stanoven před vlastní
kalibrací kolony.
IX.1.6.2 Příprava roztoku vzorku
Stejné požadavky platí v zásadě pro přípravu
roztoků vzorku. Vzorek se opatrným protřepáním
rozpustí ve vhodném rozpouštědle, např.
v tetrahydrofuranu (THF). V žádném případě by
neměl být rozpuštěn pomocí ultrazvukové lázně.
Jeli to nezbytné, přečistí se roztok vzorku
filtrací přes membránový filtr o velikosti pórů
0,2 až 2 µm.
Přítomnost nerozpuštěných částic musí být
zaznamenána v konečném protokolu, neboť mohou
pocházet z frakcí s vysokou molekulovou
hmotností. Pro stanovení hmotnostního podílu
nerozpuštěných částic vyjádřeného v procentech by
měla být použita vhodná metoda. Roztoky by měly
být použity do 24 hodin.
IX.1.6.3 Přístroje a pomůcky
— zásobník rozpouštědla,
— odplynovací zařízení (podle potřeby),
— čerpadlo,
— tlumič rázů (podle potřeby),
— vstřikovací systém,
— chromatografické kolony,
— detektor,
— průtokoměr (podle potřeby),
— zapisovač,
— nádoba na odpad.
Musí být zajištěno, aby byl GPC systém inertní
k použitým rozpouštědlům (např. použitím
ocelových kapilár pro THF).
IX.1.6.4 Vstřikování a systém dávkování rozpouštědla
Definovaný objem roztoku vzorku se nanáší na
kolonu buď ručně, nebo dávkovačem do ostře
ohraničené zóny. Příliš rychlý pohyb pístu vzad
nebo vpřed (při ručním nanášení) může způsobit
změny v pozorovaném rozdělení molekulové
hmotnosti. Dávkovač rozpouštědla by pokud možno
neměl působit rázy a v ideálním případě by měl
být osazen tlumičem rázů. Průtok je řádově
1 ml/min.
IX.1.6.5 Kolona
Podle typu vzorku se polymer charakterizuje
použitím jednoduché kolony nebo několika za sebou
řazenými kolonami. Komerčně je dostupná řada
porézních materiálů definovaných vlastností
(např. velikost pórů, meze zadržení).Výběr
separačního gelu nebo délky kolony závisí jak na
vlastnostech vzorku (hydrodynamický objem,
distribuce molekulové hmotnosti), tak na
specifických podmínkách separace, jako jsou
rozpouštědlo, teplota a průtok (1), (2), (3).
IX.1.6.6 Teoretická patra
Použitá kolona nebo kombinace kolon musí být
charakterizována počtem teoretických pater.
V případě použití THF jako elučního činidla to
znamená nanesení roztoku ethylbenzenu nebo jiného
vhodného nepolárního roztoku na kolonu známé
délky. Počet teoretických pater je dán
následující rovnicí
kde N je počet teoretických pater, Veje eluční objem v maximu píku, W šířka základny píku, W1/2šířka píku v polovině výšky.
IX.1.6.7 Separační účinnost
Vedle počtu teoretických pater, který je
veličinou určující šířku pásu, hraje roli také
separační účinnost, která se stanoví ze strmosti
kalibrační křivky. Separační účinnost kolony se
získá z následujícího vztahu:
kde Ve,Mxje eluční objem pro polystyren s molekulovou hmotností Mx, Ve,(10Mx) je eluční objem pro polystyren s 10krát větší molekulovou hmotností. Rozlišení systému je obecně definováno tímto vztahem: kde Ve1, Ve2jsou eluční objemy dvou standardů polystyrénu v maximu píku, W1, W2jsou šířky základen píků, M1, M2molekulové hmotnosti odpovídající maximu píků (měly by se lišit faktorem 10). Hodnota R pro kolonový systém by měla být větší než 1,7 (4).
IX.1.6.8 Rozpouštědla
Všechna rozpouštědla musí mít vysokou čistotu (v
případě THF 95% čistoty). Zásobník rozpouštědla
(v případě potřeby pod inertní atmosférou) musí
být dostatečně velký pro kalibraci kolony a pro
několik analýz vzorku. Z rozpouštědla musí být
před jeho nanesením čerpadlem na kolonu
odstraněny plyny.
IX.1.6.9 Kontrola teploty
Teplota kritických vnitřních součástí
(vstřikovací smyčky, kolon, detektoru a potrubí)
by měla být konstantní a měla by být sladěna
s volbou rozpouštědla.
IX.1.6.10 Detektor
Detektor slouží ke kvantitativnímu zaznamenávání
koncentrace vzorku eluovaného z kolony. Nemáli
dojít ke zbytečnému rozšíření píků, musí být
objem kyvety detekční cely co nejmenší. Neměl by
být větší než 10 µl, s výjimkou detektorů
k měření rozptylu světla a viskozity. K detekci
se obvykle používají diferenciální refraktometry.
Vyžadujíli si to však specifické vlastnosti
vzorku nebo elučního rozpouštědla, lze použít
jiné typy detektorů, např. UV/VIS, IR detektory a
detektory viskozity atd.
IX.2 DATA A ZPRÁVY
IX.2.1 Data
Pokud jde o podrobná kritéria hodnocení a o
požadavky týkající se registrace a zpracování
dat, měla by být použita norma DIN (1).
Pro každý vzorek musí být provedeny dva nezávislé
experimenty. Analýzy musí být provedeny
samostatně.
Pro každé měření musí být uvedeny hodnoty M
n
, Mw
,
Mw
/Mn
a Mp
. Je nezbytné výslovně uvést, že
naměřené hodnoty jsou relativními hodnotami
odpovídajícími molekulové hmotnosti použitého
standardu. Po stanovení retenčních objemů nebo retenčních
časů (případně korigovaných za použití vnitřního
standardu) se proti těmto veličinám vynesou do
grafu hodnoty log M
p
(přičemž Mp
je výška maxima
píku kalibračního standardu). Na jednu dekádu
hodnot molekulární hmotnosti jsou nezbytné
alespoň dva kalibrační body a pro celou křivku,
která by měla pokrýt odhadovanou molekulovou
hmotnost vzorku, se požaduje alespoň pět
naměřených bodů. Poslední bod kalibrační křivky
na straně nízkých molekulových hmotností se
definuje nhexylbenzenem nebo jiným vhodným
nepolárním rozpouštědlem. Číselně střední a
hmotnostně střední molekulová hmotnost se obecně
stanoví elektronickým zpracováním dat založeným
na vzorcích v bodě 1.2. V případě manuálního
hodnocení lze použít metodu ASTM D 353691 (3). Distribuční křivka musí být vyvedena ve formě
tabulky nebo graficky (diferenciální četnost nebo
kumulativní četnost v procentech proti log M).
V případě grafické prezentace by měla mít jedna
dekáda molekulární hmotnosti délku 4 cm a výška
maxima píku by měla být asi 8 cm. V případě
integrálních distribučních křivek by měla být
vzdálenost mezi 0 a 100 % na ordinátě přibližně
10 cm.
IX.2.2 Protokol o zkoušce
Protokol o zkoušce musí obsahovat následující
informace:
IX.2.2.1 Zkušební látka
— dostupné informace o zkušební látce
(identita, přísady, nečistoty),
— popis zpracování vzorku, pozorované
skutečnosti, problémy.
IX.2.2.2 Vybavení
— zásobník elučního činidla, inertní plyn,
odstranění plynu z elučního činidla,
složení elučního činidla, nečistoty,
— čerpadlo, tlumič rázů, vstřikovací systém,
— separační kolony (výrobce, všechny
informace o charakteristikách kolon, jako
jsou velikost pórů, druh separačního
materiálu atd., počet, délka a pořadí
použitých kolon),
— počet teoretických pater kolony (nebo
kombinace kolon), separační účinnost
(rozlišení systému),
— informace o symetrii píků,
— teplota kolony, způsob kontroly teploty,
— detektor (princip měření, typ, objem
kyvety),
— průtokoměr, jeli použit (výrobce, princip
měření),
— systém pro zaznamenávání a zpracování dat
(hardware a software).
IX.2.2.3 Kalibrace systému
— podrobný popis metody použité pro sestrojení
kalibrační křivky,
— informace o kritériích kvality této metody
(např. korelační koeficient, chyba součtu
čtverců atd.),
— informace o všech extrapolacích,
předpokladech a aproximacích provedených
během experimentálního postupu a při
hodnocení a zpracování dat,
— všechny naměřené hodnoty použité při
konstrukci kalibrační křivky musí být
dokumentovány v tabulce, která musí pro
každý kalibrační bod obsahovat následující
informace:
— název vzorku,
— výrobce vzorku,
— charakteristické hodnoty standardů M
p
,
Mn
, Mw
a Mw
/Mn
, jak jsou poskytnuty
výrobcem nebo jak jsou zjištěny
z následných měření, společně
s podrobnostmi o metodě stanovení, — vstříknutý objem a vstříknutá
koncentrace,
— hodnota M
p
použitá po kalibraci, — eluční objem nebo korigovaný retenční
čas měřený v maximu píku,
— hodnota M
p
vypočtená pro maximum píku, — chyba vypočtené hodnoty M
p
a
kalibrační hodnoty Mp
vyjádřená
v procentech.IX.2.2.4 Hodnocení
— hodnocení na základě časové závislosti:
metody použité pro zajištění požadované
reprodukovatelnosti (metoda korekce,
vnitřní standard atd.),
— informace o tom, zda hodnocení bylo
provedeno na základě elučního objemu nebo
retenčního času,
— informace o omezeních hodnocení v případě,
že pík nebyl kompletně analyzován,
— popis metody hlazení, byloli použito,
— příprava a postupy předběžné úpravy vzorku,
— popřípadě přítomnost nerozpuštěných částic,
— vstříknutý objem (µl) a vstříknutá
koncentrace (mg/ml),
— pozorované skutečnosti, které vedou
k odchylkám od ideálních charakteristik
metody GPC,
— podrobný popis všech změn zkušebních
postupů,
— podrobnosti o rozsahu chyb,
— jakékoliv další informace a pozorování
relevantní pro interpretaci výsledků.
IX.3 LITERATURA
(1) DIN 55672 (1995).
Gelpermeationschromatographie (GPC) mit
Tetrahydrofuran (THF) als Elutionsmittel,
Teil 1.
(2) Yau, W. W., Kirkland, J. J., Bly, D. D.
eds, (1979). Modern Size Exclusion Liquid
Chromatography, J. Wiley and Sons.
(3) ASTM D 353691, (1991). Standard Test
Method for Molecular Weight Averages and
Molecular Weight Distribution by Liquid
Exclusion Chromatography (Gel Permeation
ChromatographyGPC). American Society for
Testing and Materials, Philadelphia,
Pennsylvania.
(4) ASTM D 529692, (1992). Standard Test
Method for Molecular Weight Averages and
Molecular Weight Distribution of
Polystyrene by High Performance
SizeExclusion Chromatography. American
Society for Testing and Materials,
Philadelphia, Pennsylvania.
PŘÍLOHA
Příklady jiných metod stanovení číselně střední
molekulové hmotnosti (M
n
) polymerůGelová permeační chromatografie (GPC) je přednostní
metodou stanovení Mn, zejména tehdy, jeli k dispozici
sada standardů, jejichž struktura je srovnatelná se
strukturou polymeru. Vyskytnouli se praktické obtíže při
použití GPC nebo očekáváli se, že látka nevyhoví
regulačním kritériím na Mn (což je třeba potvrdit), jsou
k dispozici alternativní metody, jako jsou:
1. Použití koligativních vlastností
1.1 Ebulioskopie/kryoskopie: spočívá v měření zvýšení
bodu varu (ebulioskopie) nebo snížení bodu tuhnutí
(kryoskopie) rozpouštědla po přidání polymeru.
Metoda je založena na skutečnosti, že vliv
rozpuštěného polymeru na bod varu/bod tuhnutí
závisí na molekulové hmotnosti polymeru (1), (2).
Použitelnost: M
n
< 20 000.1.2 Snížení tlaku par: spočívá v měření tlaku par
zvolené referenční kapaliny před přidáním a po
přidání známého množství polymeru (1), (2).
Použitelnost: M
n
< 20 000 (teoretická; v praxi však
má omezený význam).1.3 Membránová osmometrie: spočívá na principu osmózy,
tj. přirozené snahy molekul rozpouštědla proniknout
polopropustnou membránou ze zředěného do
koncentrovaného roztoku a ustavit rovnováhu. Při
zkoušce je koncentrace zředěného roztoku nulová,
zatímco koncentrovaný roztok obsahuje polymer.
Pronikáním rozpouštědla membránou dochází ke
tlakovému rozdílu, který závisí na koncentraci a
molekulové hmotnosti polymeru (1), (3), (4).
Použitelnost: M
n
od 20 000 do 200 000.1.4 Osmometrie tlak páry: spočívá ve srovnání
rychlosti vypařování čistého rozpouštědla s alespoň
třemi aerosoly obsahujícími polymer v různých
koncentracích (1), (5), (6).
Použitelnost: M
n
< 20 000.2. Analýza koncových skupin
Použití této metody vyžaduje znalost jak celkové
struktury polymeru, tak povahy koncových skupin
řetězce (které musí být odlišitelné od hlavního
řetězce například metodou NMR nebo
titrací/derivatizací). Stanovení počtu koncových
skupin polymeru může vést k hodnotě molekulové
hmotnosti (7), (8), (9).
Použitelnost: M
n
až do 50 000 (s klesající
spolehlivostí).LITERATURA
(1) Billmeyer, F.W. Jr., (1984). Textbook of Polymer
Science, 3rd Edn, John Wiley, New York.
(2) Glover C.A., (1975). Absolute Colligative Property
Methods. Chapter 4. In: Polymer Molecular Weights,
Part I, P.E Slade, Jr. ed., Marcel Dekker, New
York.
(3) ASTM D 375079, (1979). Standard Practice for
Determination of NumberAverage Molecular Weight of
Polymers by Membrane Osmometry. American Society
for Testing and Materials, Philadelphia,
Pennsylvania.
(4) Coll, H. (1989). Membrane Osmometry. In:
Determination of Molecular Weight, A.R.Cooper ed.,
J. Wiley and Sons, pp. 25 to 52.
(5) ASTM 359277, (1977). Standard Recomended Practice
for Determination of Molecular Weight by Vapour
Pressure, American Society for Testing and
Materials, Philadelphia, Pennsylvania.
(6) Morris, C.E.M., (1989). Vapour Pressure Osmometry.
In: Determination of Molecular Weight, A.R.Cooper
ed., J. Wiley and Sons.
(7) Schröder, E., Müller, G., Arndt, KF., (1989).
Polymer Characterisation, Carl Hanser Verlag,
Munich.
(8) Garmon, R.G., (1975). EndGroup Determinations,
Chapter 3. In: Polymer Molecular Weights, Part I,
P.E. Slade, Jr. ed. Marcel Dekker, New York.
(9) Amiya, S., et al. (1990). Pure and Applied
Chemistry, 62, 21392146.
X. METODA PRO STANOVENÍ OBSAHU MOLEKUL O NÍZKÉ HMOTNOSTI
V POLYMERECH – METODA A.19 PODLE PŘÍLOHY SMĚRNICE
98/73/ES
X.1 METODA
Tato metoda gelové permeační chromatografie je
replikou metody OECD TG 119 (1996). Základní
principy a další technické informace jsou uvedeny
v odkazech.
X.1.1 Úvod
Vlastnosti polymerů jsou tak rozdílné, že je
nemožné popsat jedinou metodu a stanovit přesně
podmínky separace a hodnocení, které by pokryly
všechny eventuality a specifika vyskytující se
při separaci polymerů. Zejména pro komplexní
polymerní systémy není gelová permeační
chromatografie (GPC) vždy vhodná. Neníli GPC
použitelná, může být molekulová hmotnost
stanovena jinými metodami (viz příloha).
V takových případech by měly být uvedeny veškeré
podrobnosti a zdůvodnění použité metody.
Popsaná metoda je založena na normě DIN 55672
(1). Podrobné informace o provádění experimentů a
o hodnocení dat lze nalézt v uvedené normě DIN.
V případě, že jsou nezbytné úpravy
experimentálních podmínek, musí být změny
zdůvodněny. Mohou být použity jiné normy, jsouli
uvedeny kompletní odkazy na ně. V popsané metodě
jsou ke kalibraci použity vzorky polystyrenu o
známé polydisperzitě a metoda může být upravena
tak, aby byla vhodná pro určité polymery, např.
vodorozpustné větvené polymery s dlouhým
řetězcem.
X.1.2 Definice a jednotky
Nízká molekulová hmotnost je účelově definována
jako molekulová hmotnost pod 1 000 daltonů.
Číselně střední molekulová hmotnost Mn a
hmotnostně střední molekulová hmotnost Mw se
stanoví pomocí následujících rovnic:
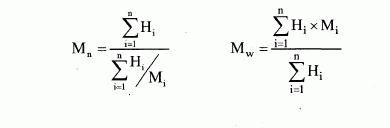
kde
Hi je výška signálu detektoru nad základnou pro
retenční objem Vi,
Mi je molekulová hmotnost frakce polymeru pro
retenční objem Vi, a
n je počet dat.
Šířka distribuce molekulové hmotnosti, která je
mírou disperzity systému, je dána poměrem Mw/Mn.
X.1.3 Referenční látky
Vzhledem k tomu, že GPC je relativní metoda, musí
být provedena kalibrace. K tomuto účelu se
obvykle používá lineární polystyrenový standard
s úzkou distribucí se známými středními
molekulovými hmotnostmi M
n
a Mw
a se známým
rozdělením molekulové hmotnosti. Kalibrační
křivka může být pro stanovení molekulové
hmotnosti neznámého vzorku použita pouze tehdy,
bylyli podmínky separace vzorku a standardů
identické. Pevný vztah mezi molekulovou hmotností
a elučním objemem je platný pouze za specifických
podmínek určitého experimentu. Podmínky zahrnují
především teplotu, rozpouštědlo (nebo směs
rozpouštědel), chromatografické podmínky a
separační kolonu nebo systém separačních kolon. Molekulové hmotnosti stanovené tímto způsobem
jsou relativními hodnotami a označují se jako
„molekulární hmotnosti polystyrenového
ekvivalentu“. To znamená, že se molekulová
hmotnost bude v závislosti na strukturních a
chemických rozdílech mezi vzorkem a standardem od
absolutní hodnoty více či méně lišit. Použijíli
se jiné standardy, např. polyethylenglykol,
polyethylenoxid, polymethylmethakrylát,
polyakrylová kyselina, musí být použití
zdůvodněno
.X.1.4 Princip zkušební metody
Rozdělení molekulové hmotnosti vzorku i střední
molekulové hmotnosti (M
n
, Mw
) lze stanovit
metodou GPC. GPC je speciální typ kapalinové
chromatografie, při němž je vzorek rozdělen podle
hydrodynamických objemů jeho jednotlivých složek
(2). Separace probíhá při průchodu vzorku kolonou
naplněnou porézním materiálem, obvykle organickým
gelem. Malé molekuly proniknou póry, zatímco
velké molekuly jsou zadrženy. Průchod velkých
molekul je tedy kratší a jsou eluovány nejdříve.
Středně velké molekuly pronikají některými póry a
jsou eluovány později. Nejmenší molekuly se
středním hydrodynamickým poloměrem menším než
velikost pórů gelu pronikají všemi póry. Tyto
molekuly jsou eluovány nakonec.
V ideálním případě závisí separace pouze na
velkosti molekul, ale v praxi je obtížné vyhnout
se alespoň některým rušivým absorpčním jevům.
Nestejnoměrná náplň kolony a mrtvé objemy mohou
situaci zhoršit (2).
Detekce se provádí například prostřednictvím
měření indexu lomu nebo absorpce UV a dává
jednoduchou distribuční křivku. Máli být však
křivce přiřazena skutečná molekulová hmotnost, je
nezbytné kalibrovat kolonu průchodem polymerů o
známé molekulové hmotnosti a v ideálním případě s
v podstatě podobnou strukturou, např. různé
polystyrenové standardy. Křivka má zpravidla
gaussovský tvar, někdy deformovaný prodloužením
na straně nízké molekulové hmotnosti, přičemž
svislá osa udává hmotnostní podíl různých
molekulových hmotnostní a na vodorovné ose jsou
vynesen logaritmus molekulové hmotnosti.
X.1.5 Kritéria kvality
Opakovatelnost (relativní směrodatná odchylka:
RSD) elučního objemu by měla být lepší než 0,3 %.
Požadovaná opakovatelnost musí být zajištěna
korekcí prostřednictvím standardů, jeli
chromatogram hodnocen jako funkce času a
neodpovídá výše uvedenému kritériu (1).
Polydisperzity jsou závislé na molekulových
hmotnostech standardů. V případě polystyrenových
standardů jsou typickými hodnotami
Mp < 2 000 Mw/Mn < 1,20
2 000 = Mp = 106 Mw/Mn < 1,05
Mp > 106 Mw/Mn < 1,20
(Mp je molekulová hmotnost standardu v maximu
píku)
X.1.6 Popis zkušební metody
X.1.6.1 Příprava standardních roztoků polystyrénu
Polystyrenové standardy se rozpustí opatrným
smícháním se zvoleným elučním činidlem. Při
přípravě roztoků se musí zohlednit doporučení
výrobce.
Koncentrace zvolených standardů závisí na různých
faktorech, např. na vstřikovaném objemu,
viskozitě roztoku a citlivosti analytického
detektoru. Maximální vstřikovaný objem musí být
přizpůsoben délce kolony, aby nedošlo
k přesycení. Typické vstřikované objemy pro
analytickou separaci pomocí GPC s kolonou o
rozměrech 30×7,8 mm jsou obvykle 40 až 100 µl.
Větší objemy jsou možné, ale neměly by překročit
250 µl. Optimální poměr mezi vstřikovaným objemem
a koncentrací musí být stanoven před vlastní
kalibrací kolony.
X.1.6.2 Příprava roztoku vzorku
Stejné požadavky platí v zásadě pro přípravu
roztoků vzorku. Vzorek se opatrným protřepáním
rozpustí ve vhodném rozpouštědle, např.
v tetrahydrofuranu (THF). V žádném případě by
neměl být rozpuštěn pomocí ultrazvukové lázně.
Jeli to nezbytné, přečistí se roztok vzorku
filtrací přes membránový filtr o velikosti pórů
0,2 až 2 µm.
Přítomnost nerozpuštěných částic musí být
zaznamenána v konečném protokolu, neboť mohou
pocházet z frakcí s vysokou molekulovou
hmotností. Pro stanovení hmotnostního podílu
nerozpuštěných částic vyjádřeného v procentech by
měla být použita vhodná metoda. Roztoky by měly
být použity do 24 hodin.
X.1.6. 3 Korekce na obsah nečistot a přísad
Korekce obsahu frakce s M < 1 000 v důsledku
příspěvku od přítomných nepolymerních
specifických složek (např. nečistot a/nebo
přísad) je obvykle nezbytná, neníli naměřený
obsah < 1 %. Dosáhne se toho přímou analýzou
roztoku polymeru nebo eluátu GPC.
V případech, kdy je eluát po průchodu kolonou pro
další analýzu příliš zředěný, musí být
zkoncentrován. Může být nezbytné odpařit eluát do
sucha a opět jej rozpustit. Zkoncentrování eluátu
musí být provedena za podmínek, při nichž je
zajištěno, že nedojde ke změnám v eluátu.
Zpracování eluátu po GPC závisí na analytické
metodě použité ke kvantitativnímu stanovení.
X.1.6.4Přístroje a pomůcky
Aparatura pro GPC sestává z následujících
součástí:
— zásobník rozpouštědla,
— odplynovací zařízení (podle potřeby),
— čerpadlo,
— tlumič rázů (podle potřeby),
— vstřikovací systém,
— chromatografické kolony,
— detektor,
— průtokoměr (podle potřeby),
— zapisovač,
— nádoba na odpad.
Musí být zajištěno, aby byl GPC systém inertní
k použitým rozpouštědlům (např. použitím
ocelových kapilár pro THF).
X.1.6.5 Vstřikování a systém dávkování rozpouštědla
Definovaný objem roztoku vzorku se nanáší na
kolonu buď ručně, nebo dávkovačem do ostře
ohraničené zóny. Příliš rychlý pohyb pístu vzad
nebo vpřed (při ručním nanášení) může způsobit
změny v pozorovaném rozdělení molekulové
hmotnosti. Dávkovač rozpouštědla by pokud možno
neměl působit rázy a v ideálním případě by měl
být osazen tlumičem rázů. Průtok je řádově
1 ml/min.
X.1.6.6 Kolona
Podle typu vzorku se polymer charakterizuje
použitím jednoduché kolony nebo několika za sebou
řazenými kolonami. Komerčně je dostupná řada
porézních materiálů definovaných vlastností
(např. velikost pórů, meze zadržení).Výběr
separačního gelu nebo délky kolony závisí jak na
vlastnostech vzorku (hydrodynamický objem,
distribuce molekulové hmotnosti), tak na
specifických podmínkách separace, jako jsou
rozpouštědlo, teplota a průtok (1), (2), (3).
X.1.6.7 Teoretická patra
Použitá kolona nebo kombinace kolon musí být
charakterizována počtem teoretických pater.
V případě použití THF jako elučního činidla to
znamená nanesení roztoku ethylbenzenu nebo jiného
vhodného nepolárního roztoku na kolonu známé
délky. Počet teoretických pater je dán
následující rovnicí

kde
N je počet teoretických pater,
Ve je eluční objem v maximu píku,
W šířka základny píku,
W1/2 šířka píku v polovině výšky.
X.1.6.8 Separační účinnost
Vedle počtu teoretických pater, který je
veličinou určující šířku pásu, hraje roli také
separační účinnost, která se stanoví ze strmosti
kalibrační křivky. Separační účinnost kolony se
získá z následujícího vztahu:
kde Ve, Mxje eluční objem pro polystyren s molekulovou hmotností Mx, Ve,(10Mx)je eluční objem pro polystyren s 10krát větší molekulovou hmotností. Rozlišení systému je obecně definováno tímto vztahem:
kde Ve1, Ve2jsou eluční objemy dvou standardů polystyrénu v maximu píku, W1,W2jsou šířky základen píků, M1,M2molekulové hmotnosti odpovídající maximu píků (měly by se lišit faktorem 10). Hodnota R pro kolonový systém by měla být větší než 1,7 (4).
X.1.6.9 Rozpouštědla
Všechna rozpouštědla musí mít vysokou čistotu (v
případě THF 95% čistoty). Zásobník rozpouštědla
(v případě potřeby pod inertní atmosférou) musí
být dostatečně velký pro kalibraci kolony a pro
několik analýz vzorku. Z rozpouštědla musí být
před jeho nanesením čerpadlem na kolonu
odstraněny plyny.
X.1.6.10 Kontrola teploty
Teplota kritických vnitřních součástí
(vstřikovací smyčky, kolon, detektoru a potrubí)
by měla být konstantní a měla by být sladěna
s volbou rozpouštědla.
X.1.6.11 Detektor
Detektor slouží ke kvantitativnímu zaznamenávání
koncentrace vzorku eluovaného z kolony. Nemáli
dojít ke zbytečnému rozšíření píků, musí být
objem kyvety detekční cely co nejmenší. Neměl by
být větší než 10 µl, s výjimkou detektorů
k měření rozptylu světla a viskozity. K detekci
se obvykle používají diferenciální refraktometry.
Vyžadujíli si to však specifické vlastnosti
vzorku nebo elučního rozpouštědla, lze použít
jiné typy detektorů, např. UV/VIS, IR detektory a
detektory viskozity atd.
X.2 DATA A ZPRÁVY
X.2.1 Data
Pokud jde o podrobná kritéria hodnocení a o
požadavky týkající se registrace a zpracování
dat, měla by být použita norma DIN (1).
Pro každý vzorek musí být provedeny dva nezávislé
experimenty. Analýzy musí být provedeny
samostatně. Ve všech případech je důležité
stanovit také data ze slepých pokusů zpracovaných
za stejných podmínek jako vzorek.
Je nezbytné výslovně uvést, že naměřené hodnoty
jsou relativními hodnotami odpovídajícími
molekulové hmotnosti použitého standardu.
Po stanovení retenčních objemů nebo retenčních
časů (případně korigovaných za použití vnitřního
standardu) se proti těmto veličinám vynesou do
grafu hodnoty log M
p
(přičemž Mp
je výška maxima
píku kalibračního standardu). Na jednu dekádu
hodnot molekulární hmotnosti jsou nezbytné
alespoň dva kalibrační body a pro celou křivku,
která by měla pokrýt odhadovanou molekulovou
hmotnost vzorku, se požaduje alespoň pět
naměřených bodů. Poslední bod kalibrační křivky
na straně nízkých molekulových hmotností se
definuje nhexylbenzenem nebo jiným vhodným
nepolárním rozpouštědlem. Při stanovení se část
křivky odpovídající molekulovým hmotnostem nižším
než 1 000 podle potřeby koriguje na nečistoty a
přísady. Eluční křivky se obvykle hodnotí pomocí
elektronického zpracování dat. V případě
manuálního hodnocení lze použít metodu ASTM D
353691 (3). Jestliže je v koloně zachycen nerozpustný
polymer, je jeho molekulová hmotnost
pravděpodobně vyšší než molekulová hmotnost
rozpuštěné frakce a pokud by to nebylo
zohledněno, vedlo by to k nadhodnocení obsahu
molekul o nízké hmotnosti. Návod na korigování
obsahu molekul o nízké hmotnosti na obsah
nerozpuštěného polymeru je uveden v příloze.
Distribuční křivka musí být vyvedena ve formě
tabulky nebo graficky (diferenciální četnost nebo
kumulativní četnost v procentech proti log M).
V případě grafické prezentace by měla mít jedna
dekáda molekulární hmotnosti délku 4 cm a výška
maxima píku by měla být asi 8 cm. V případě
integrálních distribučních křivek by měla být
vzdálenost mezi 0 a 100 % na ordinátě přibližně
10 cm.
X.2.2 Protokol o zkoušce
Protokol o zkoušce musí obsahovat následující
informace:
X.2.2.1 Zkušební látka
— dostupné informace o zkušební látce
(identita, přísady, nečistoty),
— popis zpracování vzorku, pozorované
skutečnosti, problémy.
X.2.2.2 Vybavení
— zásobník elučního činidla, inertní plyn,
odstranění plynu z elučního činidla,
složení elučního činidla, nečistoty,
— čerpadlo, tlumič rázů, vstřikovací systém,
— separační kolony (výrobce, všechny
informace o charakteristikách kolon, jako
jsou velikost pórů, druh separačního
materiálu atd., počet, délka a pořadí
použitých kolon),
— počet teoretických pater kolony (nebo
kombinace kolon), separační účinnost
(rozlišení systému),
— informace o symetrii píků,
— teplota kolony, způsob kontroly teploty,
— detektor (princip měření, typ, objem
kyvety),
— průtokoměr, jeli použit (výrobce, princip
měření),
— systém pro zaznamenávání a zpracování dat
(hardware a software).
X.2.2.3 Kalibrace systému
— podrobný popis metody použité pro sestrojení
kalibrační křivky,
— informace o kritériích kvality této metody
(např. korelační koeficient, chyba součtu
čtverců atd.),
— informace o všech extrapolacích,
předpokladech a aproximacích provedených
během experimentálního postupu a při
hodnocení a zpracování dat,
— všechny naměřené hodnoty použité při
konstrukci kalibrační křivky musí být
dokumentovány v tabulce, která musí pro
každý kalibrační bod obsahovat následující
informace:
— název vzorku,
— výrobce vzorku,
— charakteristické hodnoty standardů M
p
,
Mn
, Mw
a Mw
/Mn
, jak jsou poskytnuty
výrobcem nebo jak jsou zjištěny
z následných měření, společně
s podrobnostmi o metodě stanovení, — vstříknutý objem a vstříknutá
koncentrace,
— hodnota M
p
použitá po kalibraci, — eluční objem nebo korigovaný retenční
čas měřený v maximu píku,
— hodnota M
p
vypočtená pro maximum píku, — chyba vypočtené hodnoty M
p
a
kalibrační hodnoty Mp
vyjádřená
v procentech.X.2.2.4 Informace o obsahu podílu s nízkou molekulovou
hmotností v polymeru
— popis metod použitých v analýze a způsobu,
jakým byly experimenty provedeny,
— informace o obsahu podílu s nízkou
molekulovou hmotností vyjádřeném
v procentech celkového vzorku (m/m),
— informace o nečistotách, přísadách a jiných
nepolymerních podílech vyjádřených
v procentech celkového vzorku (m/m).
X.2.2.5 Hodnocení
— hodnocení na základě časové závislosti:
metody použité pro zajištění požadované
reprodukovatelnosti (metoda korekce,
vnitřní standard atd.),
— informace o tom, zda hodnocení bylo
provedeno na základě elučního objemu nebo
retenčního času,
— informace o omezeních hodnocení v případě,
že pík nebyl kompletně analyzován,
— popis metody hlazení, byloli použito,
— příprava a postupy předběžné úpravy vzorku,
— popřípadě přítomnost nerozpuštěných částic,
— vstříknutý objem (µl) a vstříknutá
koncentrace (mg/ml),
— pozorované skutečnosti, které vedou
k odchylkám od ideálních charakteristik
metody GPC,
— podrobný popis všech změn zkušebních
postupů,
— podrobnosti o rozsahu chyb,
— jakékoliv další informace a pozorování
relevantní pro interpretaci výsledků.
X.3 LITERATURA
(1) DIN 55672 (1995).
Gelpermeationschromatographie (GPC) mit
Tetrahydrofuran (THF) als Elutionsmittel,
Teil 1.
(2) Yau, W. W., Kirkland, J. J., Bly, D. D.
eds, (1979). Modern Size Exclusion Liquid
Chromatography, J. Wiley and Sons.
(3) ASTM D 353691, (1991). Standard Test
Method for Molecular Weight Averages and
Molecular Weight Distribution by Liquid
Exclusion Chromatography (Gel Permeation
ChromatographyGPC). American Society for
Testing and Materials, Philadelphia,
Pennsylvania.
(4) ASTM D 529692, (1992). Standard Test
Method for Molecular Weight Averages and
Molecular Weight Distribution of
Polystyrene by High Performance
SizeExclusion Chromatography. American
Society for Testing and Materials,
Philadelphia, Pennsylvania.
PŘÍLOHA
Návod na korigování obsahu molekul o nízké hmotnosti na
obsah nerozpuštěného polymeru
Jeli ve vzorku přítomen nerozpuštěný polymer, vede to ke
ztrátě hmotnosti během analýzy GPC. Nerozpuštěné polymery
jsou nevratně zachyceny v koloně nebo na filtru při
filtrování vzorku, zatímco rozpustný podíl vzorku kolonou
projde. V případě, že lze odhadnout nebo změřit přírůstek
indexu lomu (dn/dc) polymeru, lze odhadnou ztrátu
hmotnosti vzorku na koloně. V takovém případě se korekce
provede pomocí externí kalibrace standardním materiálem o
známé koncentraci a známé hodnotě dn/dc, čímž se provede
kalibrace refraktometru. V příkladě uvedeném dále je jako
standard použit polymethylmethakrylát (pMMA).
Při externí kalibraci pro analýzu polyakrylátů se
analyzuje metodou GPC standard pMMA známé koncentrace
v tetrahydrofuranu a výsledná data se použijí pro
nalezení konstanty refraktometru podle rovnice:
K = R/(C × V × dn/dc)
kde
K je konstanta refraktometru (µVs/ml),
R je odečet pro standard pMMA (µVs),
C je koncentrace standardu pMMA (mg/ml),
V je nastříknutý objem (ml) a
dn/dc je přírůstek indexu lomu pro pMMA
v tetrahydrofuranu (ml/mg).
Pro standard pMMA jsou typická následující data:
R = 2 937 891
C = 1,07 mg/ml
V = 0,1 ml
dn/dc = 9×10-5 ml/mg.Výsledná hodnota K, 3,05×10
11
se =poté použije pro
výpočet teoretické odezvy detektoru v případě, že
detektorem prošlo 100 % vstřiknutého polymeru.XI. METODA PRO STANOVENÍ CHOVÁNÍ POLYMERŮ PŘI ROZPOUŠTĚNÍ
/ EXTRAKCI VE VODĚ – METODA A.20 PODLE PŘÍLOHY SMĚRNICE
98/73/ES
XI.1. METODA
Popsaná metoda je replikou revidované verze
metody OECD TG 120 (1997). Další technické
informace jsou uvedeny v odkaze (1).
XI.1.1 Úvod
V případě určitých polymerů, např. emulzních
polymerů, může být před použitím dále popsané
metody nezbytná předběžná úprava. Tato metoda
není použitelná pro kapalné polymery a pro
polymery, které za zkušebních podmínek reagují
s vodou.
Neníli metoda použitelná nebo proveditelná, je
možné zkoumat chování polymerů při rozpouštění a
extrakci jinými metodami. V takových případech by
měly být uvedeny všechny podrobnosti použité
metody a její zdůvodnění.
XI.1.2 Referenční látky
Nejsou.
XI.1.3 Princip zkušební metody
Chování polymerů při rozpouštění/extrakci ve
vodném prostředí se zjišťuje baňkovou metodou
(viz A.6, rozpustnost ve vodě, baňková metoda)
s úpravou uvedeno dále.
XI.1.4 Kritéria kvality
Nejsou.
XI.1.5 Popis zkušební metody
XI.1.5.1 Zařízení
Pro provedení metody je nezbytné následující
zařízení:
— drticí zařízení, např. mlýnek pro přípravu
částic o známé velikosti,
— třepačka s možností kontroly teploty,
— membránový filtrační systém,
— vhodné analytické vybavení,
— normalizovaná síta.
XI.1.5.2 Příprava vzorku
Reprezentativní vzorek musí být nejdříve omezen
za použití vhodného síta na velikost částic 0,125
až 0,25 mm. Kvůli stálosti vzorku nebo kvůli
procesu drcení může být nezbytné chlazení.
Gumovité materiály mohou být drceny při teplotě
kapalného dusíku (1).
Nelzeli požadované velikosti částic dosáhnout,
mělo by se postupovat tak, aby byla velikost
částic zmenšena co nejvíce, a výsledky by měly
být uvedeny. Ve zprávě je nezbytné uvést, jak byl
nadrcený vzorek uchován do provedení zkoušky.
XI.1.5.3 Postup
Do každé ze tří nádob opatřených skleněnými
zátkami se naváží po 10 gramech zkušební látky a
přidá se po 1 000 ml vody. Ukáželi se zpracování
10 g polymeru neschůdným, mělo by být použito
nejbližší vyšší množství, které lze zpracovat, a
objem vody by měl být odpovídajícím způsobem
upraven. Nádoby se těsně zazátkují a poté se
třepou při 20 st.C. Měly by být použita třepačka
nebo míchačka schopná pracovat při konstantní
teplotě. Po 24 hodinách se obsah každé nádoby
odstředí nebo zfiltruje a v čiré vodné fázi se
vhodnou analytickou metodou stanoví koncentrace
polymeru. Nejsouli k dispozici vhodné analytické
metody pro vodnou fázi, lze celkovou
rozpustnost/extrahovatelnost zhodnotit
z hmotnosti suchého zbytku na filtru nebo ze
usazeniny po odstředění.
Obvykle je nezbytné kvantitativně rozlišit
nečistoty a přísady na jedné straně, a podíl o
nízké molekulové hmotnosti na druhé straně.
V případě vážkového stanovení je také důležité
provést slepý pokus bez použití zkušební látky,
s cílem zohlednit zbytky pocházející
z experimentálního postupu.
Chování při rozpouštění/extrakci polymerů ve vodě
při 37 st.C a pH 2 a 9 může být stanoveno způsobem
popsaným v případě provádění experimentu při
20 st.C. Hodnot pH lze dosáhnout přidáním buď
vhodných tlumivých roztoků, nebo vhodných kyselin
nebo zásad, např. kyseliny chlorovodíkové,
kyseliny octové, hydroxidu sodného nebo
draselného analytické čistoty nebo NH
3
. V závislosti na použité metodě by měla být
provedena jedna nebo dvě zkoušky. jsouli
k dispozici dostatečně specifické metody pro
přímou analýzu vodné fáze na obsah polymeru, měla
by stačit jedna zkouška, jak je uvedena výše.
Nejsouli však takové metody k dispozici a
zjištění chování polymeru při
rozpouštění/extrakci je omezeno na přímou analýzu
stanovením celkového obsahu organického uhlíku
(TOC) ve vodném extraktu, měla by být provedena
dodatečná zkouška. Zkouška by měla být rovněž
provedena třikrát, přičemž se použije 10krát
menší množství vzorků polymeru a stejné množství
vody jako v první zkoušce.
XI.1.5.4 Analýza
XI.1.5.4.1 Zkouška s jednou velikostí vzorku
Je možné, že jsou k dispozici metody pro přímou
analýzu složek polymeru ve vodné fázi. V opačném
případě lze také zvážit nepřímou analýzu
rozpuštěných/extrahovaných složek polymeru
stanovením celkového obsahu rozpustných složek a
provedením korekce na obsah složek, které nejsou
specifické pro polymer.
Analýza vodné fáze na obsah celkového polymerního
podílu je možná buď dostatečně citlivou metodou,
např.
— stanovením celkového obsahu organického
uhlíku (TOC) rozkladem peroxodisíranem nebo
dichromanem za účelem uvolnění CO
2
a
následnou IR analýzou nebo chemickou
analýzou, — atomovou absorpční spektrometrií (AAS) nebo
jejím protějškem spektrometrií s indukčně
vázanou plazmou (ICP) v případě silikonu
nebo polymerů obsahujících kov,
— UV absorpcí nebo spektrofluorimetrií
v případě arylových polymerů,
— kapalinovou chromatografií s hmotovým
spektrometrem (LCMS) v případě vzorků
s nízkou molekulovou hmotností,
nebo vakuovým odpařením vodného extraktu do sucha
a spektroskopickou (IR nebo UV atd.) nebo AAS/ICP
analýzou zbytku.
Neníli analýza vodné fáze jako takové možná, měl
by být vodný extrakt extrahován s vodou
nemísitelným organickým rozpouštědlem, např.
chlorovaným uhlovodíkem. Rozpouštědlo se poté
odpaří a zbytek se analyzuje způsobem popsaným
výše pro obsah polymeru. Jakékoliv složky, které
jsou identifikovány jako nečistoty nebo přísady
se odečtou, aby byl stanoven stupeň rozpustnosti
samotného polymeru.
Jsouli přítomny relativně velká množství
takových materiálů, může být nezbytné analyzovat
zbytek například HPLC nebo GC, aby se odlišily
nečistoty od přítomného monomeru nebo derivátů
monomeru a aby tak mohl být stanoven skutečný
obsah monomeru nebo jeho derivátů.
V některých případech může být dostačující pouhé
odpaření organického rozpouštědla do sucha a
zvážení suchého zbytku.
XI.1.5.4.2 Zkouška se dvěma různými velikostmi vzorku
Všechny vodné extrakty se analyzují na celkový
obsah organického uhlíku.
Provede se vážkové stanovení
nerozpuštěného/neextrahovaného podílu vzorku.
Zůstávajíli po odstředění nebo filtraci obsahu
každé nádoby usazeny na stěnách nádoby zbytky
polymeru, měla by být nádoba oplachována
filtrátem, dokud není vyčištěna od všech
viditelných zbytků. Poté se filtrát opět odstředí
nebo zfiltruje. Zbytky, které zůstanou na filtru
nebo v centrifugační kyvetě se vysuší za vakua
při 40 st.C a zváží. Sušení se provádí do
konstantní hmotnosti.
XI.2 DATA
XI.2.1 Zkouška s jednou velikostí vzorku
Po každou ze tří baněk by měly být uvedeny
jednotlivé výsledky a průměrné hodnoty vyjádřené
v jednotkách hmotnosti vztažené na objem roztoku
(obvykle mg/l) nebo v jednotkách hmotnosti
vztažené na hmotnost vzorku polymeru (obvykle
mg/g). Kromě toho by měla být uvedena ztráta
hmotnosti vzorku (vypočtená jako hmotnost
rozpuštěné látky dělená hmotností výchozího
vzorku). Měly by být vypočteny relativní
směrodatné odchylky (RSD). Měla by být uvedena
jednotlivá čísla pro celkovou látku (polymer +
hlavní přísady atd.) a pro samotný polymer (tj.
po odečtení příspěvku od těchto přísad).
XI.2.2 Zkouška se dvěma různými velikostmi vzorku
Pro každý experiment by měly být uvedeny
jednotlivé hodnoty TOC ve vodných extraktech obou
trojitých experimentů a průměrné hodnoty
vyjádřené v jednotkách hmotnosti vztažené na
objem roztoku (obvykle mg C/l) a rovněž
v jednotkách hmotnosti vztažené na hmotnost
výchozího vzorku (obvykle mg C/g).
Neníli mezi výsledky pro vysoké a nízké poměry
vzorek/voda rozdíl, může to znamenat, že všechny
extrahovatelné složky byly skutečně
vyextrahovány. V takovém případě nebývá přímá
analýza obvykle nezbytná.
Měly by být uvedeny jednotlivé hmotnosti zbytků
vyjádřené v procentech výchozích hmotností
vzorků. Měly by být vypočteny průměrné hodnoty za
celý experiment Rozdíly mezi 100 % a zjištěnými
hodnotami v procentech představují množství
rozpustného a extrahovatelného materiálu
v původním vzorku vyjádřené v procentech.
XI.3 ZPRÁVY
XI.3.1 Protokol o zkoušce
Protokol o zkoušce musí obsahovat následující
informace:
XI.3.1.1 Zkušební látka
— dostupné informace o zkušební látce
(identita, přísady, nečistoty, obsah podílu
o nízké molekulové hmotnosti).
XI.3.1.2 Experimentální podmínky
— popis použitých postupů a experimentálních
podmínek,
— popis analytických a detekčních metod.
XI.3.1.3 Výsledky
— výsledky rozpustnosti/extrahovatelnosti
v mg/l; jednotlivé a střední hodnoty pro
extrakční zkoušky v různých rozpouštědlech,
rozepsané podle obsahu polymeru, nečistot,
přísad atd.,
— výsledky rozpustnosti/extrahovatelnosti
v mg/g polymeru,
— hodnoty TOC ve vodných extraktech, hmotnost
rozpuštěné látky a vypočtené procentuální
hodnoty (bylali stanovena),
— hodnota pH každého vzorku,
— informace o hodnotách pro slepý pokus,
— podle potřeby upozornění na chemickou
nestabilitu zkušební látky během zkušebních
postupů a analytických postupů,
— všechny informace, které jsou důležité pro
interpretaci výsledků.
XI.4 LITERATURA
(1) DIN 53733 (1976) Zerkleinerung von
Kunststofferzeugnissen für Prüfzwecke.
Příl.2
METODY PRO ZKOUŠENÍ VLASTNOSTÍ NEBEZPEČNÝCH PRO ŽIVOTNÍ
PROSTŘEDÍ
I. METODA PRO STANOVENí AKUTNÍ TOXICITY PRO RYBY –
metoda c.1 podle přílohy směrnice komise 92/69/EHS ze dne
31. července 1992, kterou se po sedmnácté přizpůsobuje
technickému pokroku směrnice Rady 67/548/EHS o sbližování
správních a právních púředpúsů týkajících se klasifikace,
balení a označování nebezpečných látek (dále jen
„směrnice 92/69/EHS“)
I.1. METODA
I.1.1 ÚVOD
Účelem této zkoušky je stanovit akutní letální
toxicitu látek pro sladkovodní ryby. Pro
usnadnění výběru nejvhodnější zkušební metody
(statické, semistatické nebo průtokové) s cílem
zajistit dostatečně konstantní koncentrace
zkušební látky po celou dobu experimentu je
žádoucí mít pokud možno k dispozici údaje o
rozpustnosti látky ve vodě, o tenzi par, chemické
stabilitě, disociačních konstantách a o
biologické rozložitelnosti látky.
Další informace (např. strukturní vzorec, stupeň
čistoty, povaha a podíl významných nečistot
v procentech, přítomnost a množství přísad a
rozdělovací koeficient noktanol/voda) je třeba
vzít v úvahu při plánování zkoušky i při
interpretaci výsledků.
I.1.2 DEFINICE A JEDNOTKY
Akutní toxicitou se rozumí zřetelný nepříznivý
účinek, který je v krátké době (řádově ve dnech)
v organismu vyvolán expozicí látce. V této
zkoušce se akutní toxicita vyjadřuje
prostřednictvím střední letální koncentrace
(LC
50
), tj. takové koncentrace látky ve vodě,
která během nepřetržité expozice po určitou dobu
způsobí úhyn 50 % jedinců ve zkušební skupině
ryb. Všechny koncentrace zkušební látky se udávají
v hmotnosti na jednotku objemu (mg·l
1
). Mohou se
také vyjádřit v hmotnostních podílech (mg*kg1
).I.1.3 REFERENČNÍ LÁTKY
Zkoušky s referenčními látkami mohou být
provedeny s cílem prokázat, že se reakce
zkušebních druhů za laboratorních zkušebních
podmínek podstatně nezměnila.
Referenční látky nejsou pro tuto zkoušku
stanoveny.
I.1.4 PODSTATA ZKUŠEBNÍ METODY
Může být provedena limitní zkouška s koncentrací
100 mg·l
1
, s cílem prokázat, že LC50
je vyšší
než tato koncentrace. Ryby se vystaví účinku různým koncentracím
zkušební látky přidané do vody po dobu 96 h. Úhyn
se zaznamenává nejméně každých 24 h a je-li to
možné, vypočtou se při každém pozorování
koncentrace, které způsobí úhyn 50 % ryb (LC
50
).I.1.5 KRITÉRIA JAKOSTI
Kritéria jakosti se vztahují jak na limitní
zkoušku, tak na úplný zkušební postup.
Mortalita v kontrolních skupinách nesmí být na
konci zkoušky větší než 10 % (nebo jednu rybu,
pokud se použije méně než deset ryb).
Koncentrace rozpuštěného kyslíku musí být po
celou dobu zkoušky vyšší než 60 % hodnoty
nasycení vzduchem.
Koncentrace zkušební látky nesmí po celou zkoušky
klesnout pod 80 % původních hodnot koncentrací.
U látek, které se ve zkušebním médiu lehce
rozpouštějí a dávají stabilní roztoky,
tj. v podstatné míře netěkají, nerozkládají se,
nehydrolyzují nebo se neadsorbují, lze počáteční
koncentraci pokládat za ekvivalentní s nominální
koncentrací. Musí být potvrzeno, že byly
koncentrace po celou zkoušku udrženy a že
kritéria jakosti byla dodržena.
U látek, které
i) jsou ve zkušebním médiu špatně rozpustné, nebo
ii) mohou vytvářet stabilní emulze nebo disperse,
nebo
iii) jsou ve vodných roztocích nestabilní,
musí být počáteční koncentrace brána jako
koncentrace naměřená v roztoku (nebo, neníli to
technicky možné, ve vodním sloupci) na začátku
zkoušky. Koncentrace se stanoví po určité době
jejího ustálení, avšak před nasazením testovacích
ryb.
Ve všech uvedených případech musí být během
zkoušky provedena další měření s cílem potvrdit
skutečné expoziční koncentrace nebo dodržení
kritérií jakosti.
pH by se nemá změnit o více než 1.
I.1.6 POPIS ZKUŠEBNÍ METODY
Mohou být použity tři postupy:
Statická zkouška:
Zkouška, při níž zkušební roztok neprotéká.
(Roztoky se během celé zkoušky nemění.)
Semistatická metoda:
Zkouška, při níž zkušební roztok neprotéká, ale
je pravidelně po delších časových úsecích (např.
po 24 h) zcela vyměňován.
Průtoková metoda:
Zkouška toxicity, při níž se voda ve zkušebních
nádržích neustále obměňuje, přičemž se zkušební
látka přivádí s vodou, kterou se zkušební médium
obnovuje.
I.1.6.1 Činidla
I.1.6.1.1 Roztoky zkušebních látek
Zásobní roztoky o požadované koncentraci se
připraví rozpuštěním látky v deionizované vodě
nebo ve vodě podle bodu 1.6.1.2.
Zvolené zkušební koncentrace se připraví ředěním
zásobního roztoku. Jsouli zkoušeny vysoké
koncentrace látky, lze látku rozpustit přímo
v ředicí vodě.
Látky se obvykle zkouší až do meze jejich
rozpustnosti. U některých látek (např. u látek
s nízkou rozpustností ve vodě nebo vysokou
hodnotou P
o/v
, nebo u látek, které ve vodě
vytvářejí spíše stabilní disperse než pravé
roztoky) je možné provést zkoušku při koncentraci
vyšší, než je mez rozpustnosti, aby bylo
zajištěno, že je dosaženo maximální koncentrace
odpovídající maximální rozpustnosti/stabilitě. Je
ovšem nutné, aby tato koncentrace jinak
nenarušovala zkušební systém (např. vytvořením
filmu na hladině bránícímu okysličení vody atd.).
Pro přípravu zásobních roztoků látek s nízkou
rozpustností ve vodě nebo pro usnadnění
rozptýlení látky ve zkušebním médiu lze použít
ultrazvukovou dispergaci, organická rozpouštědla
či emulgátory nebo dispergátory. Použijíli se
takové pomocné látky, měly by všechny zkušební
koncentrace obsahovat stejné množství těchto
pomocných látek a stejné koncentraci pomocné
látky jako ve zkušebních sériích by měly být
exponovány další kontrolní ryby. Koncentrace
pomocných látek by měla být minimální a v žádném
případě by neměla překročit 100 mg na l
zkušebního média. Zkouška se provede bez úpravy pH. Existujíli
známky toho, že dochází k výrazné změně pH,
doporučuje se zkoušku opakovat s úpravou pH a
výsledky zaznamenat. V takovém případě se upraví
pH zásobního roztoku na pH vody k ředění, pokud
proti tomu neexistuji specifické důvody. Při
úpravě pH se dává přednost HCl a NaOH. Úprava pH
se provede tak, aby nebyla koncentrace zkušební
látky v zásobním roztoku v podstatné míře
změněna. Dojdeli úpravou ve zkušebním médiu
k chemické reakci nebo ke srážení, skutečnosti se
zaznamenají.
I.1.6.1.2 Voda pro chov ryb a ředění
Může být použita pitná voda (nekontaminovaná
potenciálně škodlivými koncentracemi chloru,
těžkých kovů nebo jiných látek), kvalitní
přírodní voda nebo upravená voda (viz doplněk 1).
Upřednostňuje se voda o celkové tvrdosti od 10 do
250 mg·l
-1
(vztaženo na CaCO3
) a pH od 6,0 do
8,5.I.1.6.2 Přístroje
Veškeré přístroje musí být vyrobeny z chemicky
inertního materiálu:
— systém pro automatické ředění (pro průtokovou
metodu),
— přístroj pro měření koncentrace kyslíku,
— vybavení pro stanovení tvrdosti vody,
— vhodný přístroj pro měření teploty,
— pHmetr.
I.1.6.3 Testovací ryby
Ryby by měly být zdravé a bez zjevných
malformací.
Použitý druh by měl být zvolen podle praktických
kritérií, jako je jejich dostupnost po celý rok,
snadný chov, vhodnost pro zkoušení, relativní
citlivost k chemickým látkám a jakékoli další
významné ekonomické a biologické faktory. Při
výběru druhu ryb by měla být také zohledněna
potřeba srovnatelnosti získaných dat a
mezinárodní harmonizace (1).
Seznam doporučených druhů ryb pro provedení této
zkoušky je uveden v doplňku 2; dává se přednost
druhům danio pruhované a pstruh duhový.
I.1.6.3.1 Chov
Ryby by měly pocházet pokud možno z jednoho chovu
a měly by být stejné délky a stejného stáří. Ryby
musí být chovány nejméně 12 dní v následujících
podmínkách:
Obsádka:
Vhodná vzhledem k metodě (metoda s recirkulací
nebo průtoková metoda) a druhu ryb.
Voda:
Viz 1.6.1.2.
Osvětlení:
Osvětlení 12 až 16 h denně.
Koncentrace rozpuštěného kyslíku:
Nejméně 80 % hodnoty nasycení vzdušným kyslíkem.
Krmení:
Třikrát týdně nebo jednou za den; vysazení krmení
24 h před začátkem zkoušky.
I.1.6.3.2 Mortalita
Po 48hodinové aklimatizaci se zaznamená mortalita
a použijí se následující kritéria:
— mortalita vyšší než 10 % populace za 7 dní:
celá obsádka ryb se vyřadí,
— mortalita 5 až 10 % populace:
v chovu se pokračuje dalších 7 dní.
Nedojdeli k dalším případům úhynu, obsádka
se použije, v opačném případě musí být
vyřazena,
— mortalita menší než 5 % populace:
obsádka je pro zkoušku použitelná.
I.1.6.4 Aklimatizace
Všechny ryby musí být nejméně na 7 dnů před
použitím ve zkoušce nasazeny do vody stejné
kvality a stejné teploty, jaká se použije při
zkoušce.
I.1.6.5 Zkušební postup
Před vlastní zkouškou může být provedena
předběžná zkouška s cílem získat informace o
rozsahu koncentrací, které mají být použity
v hlavní zkoušce.
Kromě sérií zkoušek se provede kontrolní zkouška
bez zkušební látky a podle potřeby kontrolní
zkouška s pomocnou látkou.
V závislosti na fyzikálních a chemických
vlastnostech zkušební látky se zvolí statická,
semistatická nebo průtoková zkouška, aby byla
splněna kritéria jakosti.
Ryby se exponují zkušební látce za níže uvedených
podmínek:
— délka expozice: 96 h;
— počet ryb: nejméně 7 na každou koncentraci;
— nádrže: vhodný objem vzhledem k doporučené
obsádce;
— obsádka: pro statickou a semistatickou zkoušku
se doporučuje 1,0 g na litr; v průtokovém
systému je přijatelná vyšší obsádka;
— zkušební koncentrace: nejméně pět koncentrací,
které jsou odstupňovány faktorem
nepřevyšujícím 2,2 a které pokrývají rozsah
mortality od 0 % do 100 %;
— voda: viz 1.6.1.2;
— osvětlení: osvětlení 12 až 16 h denně;
— teplota: podle druhu ryb (doplněk 2), avšak
v rámci dané zkoušky kolísající v toleranci
+/-1 st.C;
— koncentrace rozpuštěného kyslíku: ne nižší než
60 % hodnoty nasycení vzdušným kyslíkem při
dané teplotě;
— krmení: žádné.
Ryby se kontrolují po prvních 2 až 4 h a dále
nejméně každých 24 h. Ryby se považují za mrtvé,
jestliže při dotyku ocasní ploutve nedochází
k žádné reakci a nejsou-li patrné žádné dýchací
pohyby. Mrtvé ryby se odstraní, jakmile jsou
zpozorovány, a úhyn se zaznamená.
Zaznamenají se všechny zjevné abnormality (např.
ztráta rovnováhy, změny v plavání, chování,
v dýchací funkci, v pigmentaci atd.).
Měření pH, obsahu rozpuštěného kyslíku a teploty
se provádí denně.
Limitní zkouška
S využitím postupů popsaných v této metodě může
být provedena limitní zkouška s koncentrací
100 mg·l
1
s cílem prokázat, že LC50
je vyšší než
tato koncentrace. Jeli povaha zkušební látky taková, že ve vodě
nelze dosáhnout koncentrace 100 mg·l
-1
, provede
se limitní zkouška při koncentraci odpovídající
rozpustnosti této látky v použitém médiu (nebo
při maximální koncentraci, kdy látka vytváří
stabilní disperzi) (viz také bod 1.6.1.1). Limitní zkouška se provede se 7 až 10 rybami a se
stejným počtem ryb v kontrole (kontrolách).
(Podle teorie binomického rozdělení je při
použití 10 ryb a při nulové mortalitě 99,9%
pravděpodobnost, že je LC
50
větší než 100 mg*l1
.
Při 7, 8 nebo 9 rybách znamená nulová mortalita
nejméně 99% pravděpodobnost, že je LC50
větší než
koncentrace použitá v limitní zkoušce.)Dojdeli k úhynům, musí se provést celá studie.
Jsou-li pozorovány subletální účinky, zaznamenají
se.
I.2 DATA A HODNOCENÍ
Na pravděpodobnostní logaritmický papír se pro
každé období, kdy byla prováděna pozorování (24,
48, 72 a 96 h), vynese pro každou expoziční dobu
mortalita v procentech proti koncentraci.
Pokud je to možné, odhadnou se standardními
postupy pro každou délku expozice hodnoty LC
50
a
meze spolehlivosti (p = 0,05); tyto hodnoty se
zaokrouhlí na jednu, nebo nejvýše na dvě platné
číslice (příklad zaokrouhlení na dvě platné
číslice: 173,5 se zaokrouhlí na 170, 0,127 na
0,13, 1,21 na 1,2). V případech, kdy je sklon křivky závislosti
mortality v procentech na koncentraci látky
příliš strmý, aby umožnil výpočet hodnoty LC
50
,
postačuje grafický odhad této hodnoty.
Jestliže dvě po sobě jdoucí koncentrace lišící se
faktorem 2,2 vyvolají mortalitu 0 a 100 %, jsou
dostatečnou informací o tom, že se LC50
nachází
mezi těmito hodnotami. Zjistíli se, že není možné udržet stabilitu nebo
homogenitu zkušební látky, uvede se to ve zprávě
a výsledky se interpretují s opatrností.
I.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat
následující údaje:
— údaje o testovacích rybách (vědecký název,
kmen, dodavatel, veškerá předchozí
ošetření, velikost a počet ryb použitých
při každé zkušební koncentraci);
— zdroj ředicí vody a hlavní chemické
charakteristiky (pH, tvrdost, teplota);
— u látek s malou rozpustností ve vodě údaj o
metodě přípravy zásobních a zkušebních
roztoků;
— koncentrace všech pomocných látek;
— přehled použitých koncentrací a veškeré
dostupné informace o stabilitě zkušební
látky ve zkušebním roztoku při použitých
koncentracích;
— jestliže byly provedeny chemické analýzy, údaje
o použitých metodách a získané výsledky;
— výsledek limitní zkoušky, pokud byla provedena;
— důvody pro volbu použitého zkušebního postupu a
podrobnosti o něm (např. statický,
semistatický, dávkování, průtoková
rychlost, zda byla voda provzdušňována
obsádka ryb atd.);
— popis zkušebního zařízení;
— světelný režim;
— koncentrace rozpuštěného kyslíku, hodnoty pH,
teplota zkušebních roztoků každých 24 h;
— důkaz, že byla splněna kritéria jakosti;
— tabulka kumulativních hodnot mortality při
každé koncentraci a při kontrolní zkoušce
(a popřípadě při kontrolní zkoušce
s pomocnou látkou) při každé z doporučených
dob pozorování;
— graf křivky závislosti účinku, vyjádřeného
v procentech, na koncentraci na konci
zkoušky;
— podle možnosti hodnoty LC
50
při každé
z doporučených dob pozorování (při 95%
intervalu spolehlivosti); — použité statistické metody stanovení hodnot
LC
50
; — při použití referenční látky a údaj o získaných
výsledcích;
— nejvyšší zkušební koncentrace, která nevyvolala
za dobu zkoušky úhyn ryb;
— nejnižší zkušební koncentrace, která vyvolala
za dobu zkoušky 100 % mortalitu.
I.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 203,
Decision of the Council C(81) 30 final and
updates.
(2) AFNOR – Determination of the acute toxicity
of a substance to Brachydanio rerio –
Static and Flow Through methods
–NFT 90303, June 1985.
(3) AFNOR – Determination of the acute toxicity
of a substance to Salmo gairdneri – Static
and FlowThrough methods – NFT 90305, June
1985.
(4) ISO 7346/1, /2, /3 – Water Quality –
Determination of the acute lethal toxicity
of substances to a fresh water fish
(Brachydanio rerio Hamilton-Buchanan –
Teleostei, Cyprinidae). Part 1: Static
method. Part : Semi-static method.
Part 3: Flowthrough method.
(5) Eidgenössisches Department des Innern,
Schweiz: Richtlinien für Probenahme und
Normung von Wasseruntersuchungsmethoden –
Part II 1974.
(6) DIN Testverfahren mit Wasserorganismen, 38
412 (L1) und L (15).
(7) JIS K 0102, Acute toxicity test for fish.
(8) NEN 6506 – Water – Bepaling van de akute
toxiciteit met behulp van Poecilia
reticulata, 1980.
(9) Environmental Protection Agency, Methods for
the acute toxicity tests with fish,
macroinvertebrates and amphibians. The
Committee on Methods for Toxicity Tests
with Aquatic Organisms, Ecological Research
Series EPA66075009, 1975.
(10) Environmental Protection Agency,
Environmental monitoring and support
laboratory, Office of Research and
Development, EPA600/478012, January
1978.
(11) Environmental Protection Agency, Toxic
Substance Control, Part IV, 16 March 1979.
(12) Standard methods for the examination of
water and wastewater, 14th ed.,
APHAAWWAWPCF, 1975.
(13) Commission of the European Communities,
Interlaboratory test programme concerning
the study of the ecotoxicity of a chemical
substance with respect to the fish.
EEC Study D.8368, 22 March 1979.
(14) Verfahrensvorschlag des Umweltbundesamtes
zum akuten Fisch-Test. Rudolph, P.,
Boje, R. Ökotoxikologie, Grundlagen für die
ökotoxikologische Bewertung von
Umweltchemikalien nach dem
Chemikaliengesetz, ecomed 1986.
(15) Litchfield, J. T., Wilcoxon, F. A simplified
method for evaluating dose effects
experiments. J. Pharm, Exp. Therap., 1949,
96, 99.
(16) Finney, D. J. Statistical Methods in
Biological Assay. Griffin, Weycombe, U.K.,
1978.
(17) Sprague, J. B. Measurement of pollutant
toxicity to fish. Bioassay methods for
acute toxicity. Water Res., 1969, 3, 793-
821.
(18) Sprague, J. B. Measurement of pollutant
toxicity to fish. II Utilising and applying
bioassay results. Water Res. 1970, 4, 3-32.
(19) Stephan, C. E. Methods for calculating an
LC
50
. In Aquatic Toxicology and Hazard
Evaluation (F. I. Mayer, J. L. Hamelink
(eds.)). American Society for Testing and
Materials, ASTM STP 634, 1977, 65-84. (20) Stephan, C. E., Busch, K. A., Smith, R.,
Burke, J., Andrews, R. W. A computer
program for calculating an LC
50
. US EPA. DODATEK 1
Upravená voda
Příklad vhodné ředicí vody
Všechny chemikálie musí být čistoty p.a.
Voda musí být kvalitní destilovaná nebo
deionizovaná s vodivostí menší než 5 µS*cm
-1
. Destilační přístroj nesmí obsahovat žádné měděné
části.
Zásobní roztoky:
CaCl
2
*2H2
O (chlorid vápenatý dihydrát) 11,76 g
se rozpustí ve vodě a doplní vodou na 1 litr. MgSO
4
*7H2
O (síran hořečnatý heptahydrát) 4,93 g
se rozpustí ve vodě a doplní vodou na 1 litr. NaHCO
3
(hydrogenuhličitan sodný) 2,59 g
se rozpustí ve vodě a doplní vodou na l litr. KCl (chlorid draselný) 0,23 g
se rozpustí ve vodě a doplní vodou na 1 litr.
Upravená ředicí voda
Smísí se po 25 ml všech čtyř zásobních roztoků a
doplní vodou na 1 litr.
Provzdušňuje se, dokud koncentrace rozpuštěného
kyslíku neodpovídá koncentraci nasycení vzdušným
kyslíkem.
pH musí být 7,8 +/- 0,2.
Podle potřeby se pH upraví pomocí NaOH (hydroxid
sodný) nebo HCl (kyselina chlorovodíková).
Tato ředicí voda se nechá 12 h stát a nesmí být
dále provzdušňována.
Koncentrace úhrnu iontů Ca a Mg v tomto roztoku
je 2,5 mmol*l
-1
. Poměr množství iontů Ca : Mg je
4 : 1 a poměr množství iontů Na : K je 10 : 1.
Celková koncentrace alkalických kovů v tomto
roztoku je 0,8 mmol*l-1
. Jakákoli odchylka v přípravě vody k ředění nesmí
změnit složení ani vlastnosti vody.
DODATEK 2
Druhy ryb doporučené pro zkoušení
=================================================================== =============================
Doporučený druh Doporučený Doporučená celková délka ryb
rozsah teplot (cm)
při zkoušce
(st.C)
=================================================================== =============================
Brachydanio rerio (Teleostei, Cyprinidae) 20 až 24 3,0 +/- 0,5
(Hamilton - Buchanan), danio pruhované
Pimephales promelas (Teleostei, Cyprinidae) 20 až 24 5,0 +/- 2,0
(Rafinesque), střevle
Cyprinus carpio (Teleostei Cyprinidae) (Linneanus 20 až 24 6,0 +/- 2,0
1758), kapr obecný
Oryzias latipes (Teleostei, Poeciliidae) (Tomminck 20 až 24 3,0 +/- 1,0
a Schlegel 1850), halančík japonský
Poecilia reticulata (Teleostei, Poeciliidae) 20 až 24 3,0 +/- 1,0
(Peters 1859), živorodka duhová
Lepomis macrochirus (Teleostei, Centrarchidae) 20 až 24 5,0 +/- 2,0
(Rafinesque, Linneanus 1758), slunečnice modrá
Onchorhynchus mykiss (Teleostei, Salmonidae) 12 až 17 6,0 +/- 2,0
(Walbaum 1988), pstruh duhový
Leuciscus idus (Teleostei, Cyprinidae) (Linneanus 20 až 24 6,0 +/- 2,0
1758), jelec jesen
=================================================================== =============================
Opatřování ryb
Ryby uvedené v seznamu se snadno chovají nebo
jsou dobře dostupné po celý rok. Lze je množit a
chovat buď v rybích farmách, nebo v laboratoři za
kontrolovaných zdravotních a parazitologických
podmínek tak, aby ryby byly zdravé a byly známého
původu. Tyto ryby jsou dostupné v mnoha částech
světa.
DODATEK 3
Příklad křivky závislosti úmrtnosti, vyjádřené
v procentech, na koncentraci
Příklad stanovení LC
50
na pravděpodobnostním
logaritmickém papíruII. METODA PRO STANOVENÍ AKUTNÍ TOXICITY PRO DAFNIE –
METODA C.2 PODLE PŘÍLOHY SMĚRNICE 92/69/EHS
II.1 METODA
II.1.1 ÚVOD
Účelem této zkoušky je stanovit střední účinnou
koncentraci látky pro imobilizaci (EC
50
) dafnií
ve sladkovodním prostředí. Před započetím zkoušky
je žádoucí mít pokud možno k dispozici údaje o
rozpustnosti látky ve vodě, o tenzi par, chemické
stabilitě, disociačních konstantách a o
biologické rozložitelnosti látky. Další informace (např. strukturní vzorec, stupeň
čistoty, povaha a podíl významných nečistot
v procentech, přítomnost a množství přísad a
rozdělovací koeficient noktanol/voda) je třeba
vzít v úvahu při plánování zkoušky i při
interpretaci výsledků.
II.1.2 DEFINICE A JEDNOTKY
Požadavek směrnice stanovit LC
50
pro dafnie se
považuje za splněný stanovením EC50
, jak je
popsáno v této zkušební metodě. Akutní toxicita se v této zkoušce vyjadřuje
střední účinnou koncentrací látky pro imobilizaci
(EC
50
) dafnií. Je to koncentrace (rozumí se
výchozí koncentrace), která během nepřetržité
expozice po určitou stanovenou dobu imobilizuje
50 % dafnií ve zkušební skupině během doby
působení (doby expozice). Imobilizace:
Dafnie, které nejsou schopné do 15 s po lehkém
zatřepání zkušební nádrží začít plavat, se
považují za imobilizované.
Všechny koncentrace zkušební látky se udávají
v hmotnosti na jednotku objemu (mg·l
1
). Mohou se
také vyjádřit v hmotnostních podílech (mg*kg1
).II.1.3 REFERENČNÍ LÁTKY
Zkoušky s referenčními látkami mohou být
provedeny s cílem prokázat, že se reakce
zkušebních druhů za laboratorních zkušebních
podmínek podstatně nezměnila.
Souhrn výsledků okružního testu laboratoří EHS
s použitím čtyř různých látek je uveden
v doplňku 2.
II.1.4 PODSTATA ZKUŠEBNÍ METODY
Může být provedena limitní zkouška s koncentrací
100 mg·l
1
, s cílem prokázat, že EC50
je vyšší
než tato koncentrace. Dafnie se 48 h exponují zkušební látce přidané
v různých koncentracích do vody. Použije-li se
kratší doba, zdůvodní se ve zprávě.
Za jinak stejných experimentálních podmínek a
v přiměřeném rozmezí koncentrací zkušební látky
působí různé koncentrace zkušební látky na
schopnost plavání dafnií rozdílně. Různé
koncentrace mají za následek skutečnost, že na
konci zkoušky ztrácí různý procentuální podíl
dafnií schopnost plavat. Koncentrace, které
nezpůsobují žádnou imobilizaci nebo způsobují
100% imobilizaci, se zjistí přímo pozorováním,
zatímco hodnota 48hodinová EC
50
se stanoví podle
možnosti výpočtem. Při této metodě se používá statický systém,
zkušební roztoky se tedy během doby expozice
neobnovují.
II.1.5. KRITÉRIA JAKOSTI
Kritéria jakosti se vztahují jak na limitní
zkoušku, tak na úplný zkušební postup.
Imobilizace v kontrolních zkouškách nesmí být na
konci zkoušky větší než 10 %.
Dafnie se v kontrolních zkouškách nesmí trvale
zdržovat u hladiny.
Koncentrace rozpuštěného kyslíku ve zkušební
nádrži musí být po celou dobu zkoušky vyšší než
3 mg·l
1
. Koncentrace kyslíku však nesmí v žádném
případě klesnout pod 2 mg*l1
. Koncentrace zkušební látky nesmí po celou zkoušky
klesnout pod 80 % původní hodnoty koncentrace.
U látek, které se ve zkušebním médiu lehce
rozpouštějí a dávají stabilní roztoky,
tj. v podstatné míře netěkají, nerozkládají se,
nehydrolyzují nebo se neadsorbují, lze počáteční
koncentraci pokládat za ekvivalentní s nominální
koncentrací. Musí být potvrzeno, že byly
koncentrace po celou zkoušku udrženy a že
kritéria jakosti byla dodržena.
U látek, které
i) jsou ve zkušebním médiu špatně rozpustné, nebo
ii) mohou vytvářet stabilní emulze nebo disperse,
nebo
iii) jsou ve vodných roztocích nestabilní,
musí být počáteční koncentrace brána jako
koncentrace naměřená v roztoku (nebo, neníli to
technicky možné, ve vodním sloupci) na začátku
zkoušky. Koncentrace se stanoví po určité době
jejího ustálení, avšak před nasazením testovacích
organismů.
Ve všech uvedených případech musí být během
zkoušky provedena další měření s cílem potvrdit
skutečné expoziční koncentrace nebo dodržení
kritérií jakosti.
pH by se nemělo změnit o více než 1.
II.1.6 POPIS ZKUŠEBNÍ METODY
II.1.6.1 Činidla
II.1.6.1.1 Roztoky zkušebních látek
Zásobní roztoky o požadované koncentraci se
připraví rozpuštěním látky v deionizované vodě
nebo ve vodě podle bodu 1.6.1.2.
Zvolené zkušební koncentrace se připraví ředěním
zásobního roztoku. Jsouli zkoušeny vysoké
koncentrace látky, lze látku rozpustit přímo
v ředicí vodě.
Látky se obvykle zkoušejí až do meze jejich
rozpustnosti. U některých látek (např. u látek
s nízkou rozpustností ve vodě nebo vysokou
hodnotou P
o/v
, nebo u látek, které ve vodě
vytvářejí spíše stabilní disperse než pravé
roztoky) je možné provést zkoušku při koncentraci
vyšší, než je mez rozpustnosti, aby bylo
zajištěno, že je dosaženo maximální koncentrace
odpovídající maximální rozpustnosti/stabilitě. Je
ovšem nutné, aby tato koncentrace jinak
nenarušovala zkušební systém (např. vytvořením
filmu na hladině bránícímu okysličení vody atd.). Pro přípravu zásobních roztoků látek s nízkou
rozpustností ve vodě nebo pro usnadnění
rozptýlení látky ve zkušebním médiu lze použít
ultrazvukovou dispergaci, organická rozpouštědla
či emulgátory nebo dispergátory. Použijíli se
takové pomocné látky, měly by všechny zkušební
koncentrace obsahovat stejné množství těchto
pomocných látek a stejné koncentraci pomocné
látky jako ve zkušebních sériích by měly být
exponovány další kontrolní dafnie. Koncentrace
pomocných látek by měly být minimální a v žádném
případě by neměla překročit 100 mg/l zkušebního
média.
Zkouška se provede bez úpravy pH. Existujíli
známky toho, že dochází k výrazné změně pH,
doporučuje se zkoušku opakovat s úpravou pH a
výsledky zaznamenat. V takovém případě se upraví
pH zásobního roztoku na pH vody k ředění, pokud
proti tomu neexistuji specifické důvody. Při
úpravě pH se dává přednost HCl a NaOH. Úprava pH
se provede tak, aby nebyla koncentrace zkušební
látky v zásobním roztoku v podstatné míře
změněna. Dojdeli úpravou ve zkušebním médiu
k chemické reakci nebo ke srážení, skutečnosti se
zaznamenají ve zprávě.
II.1.6.1.2 Zkušební voda
Pro tuto zkoušku se použije upravená voda (viz
doplněk 1 a odkaz (2): ISO 6341).
Aby nebylo nutné aklimatizovat dafnie před
zkouškou, doporučuje se, aby byla voda pro
kultivaci podobné jakosti (pH, tvrdost), jako
voda pro zkoušku.
II.1.6.2 Přístroje
Použijí se běžné laboratorní přístroje a
zařízení. Zařízení, které přijde do styku se
zkušebními roztoky, by mělo být nejlépe skleněné:
— přístroj pro měření koncentrace kyslíku
(s mikroelektrodou, nebo jiný vhodný
přístroj na měření koncentrace rozpuštěného
kyslíku ve vzorcích malého objemu),
— vhodný přístroj pro měření teploty,
— pHmetr,
— vybavení pro stanovení tvrdosti vody.
II.1.6.3 Testovací organismy
Přednost se dává druhu Daphnia magna, ačkoliv se
připouští také druh Daphnia pulex. Testovací
dafnie musí být na začátku zkoušky mladší než
24 h, musí být laboratorně odchované, bez
zjevných nemocí a musí být známého původu (např.
chov, předchozí ošetření, atd.).
II.1.6.4 Zkušební postup
Před vlastní zkouškou může být provedena
předběžná zkouška s cílem získat informace o
rozsahu koncentrací, které mají být použity
v hlavní zkoušce.
Kromě sérií zkoušek se provede kontrolní zkouška
bez zkušební látky a podle potřeby kontrolní
zkouška s pomocnou látkou.
Dafnie se exponují zkušební látce následujícím
způsobem:
— délka expozice: 48 h,
— počet dafnií: nejméně 20 na každou zkušební
koncentraci, nejlépe rozdělených na čtyři
skupiny po pěti dafniích nebo na dvě
skupiny po 10 dafniích,
— obsádka: na každou dafnii by měly připadat 2 ml
zkušebního roztoku,
— zkušební koncentrace: zkušební roztok se
připraví bezprostředně před nasazením
dafnií, nejlépe bez použití jiného
rozpouštědla než vody. Připraví se
koncentrace tvořící geometrickou řadu,
přičemž poměr mezi koncentracemi nesmí být
vyšší než 2,2. Zároveň s kontrolami se
zkoušejí koncentrace dostatečné pro to, aby
po 48 h vyvolaly nulovou nebo a 100%
imobilizaci, a dále mezilehlé koncentrace
umožňující výpočet 48hodinové EC
50
, — voda: viz 1.6.1.2,
— osvětlení: střídání světla a tmy je libovolné,
— teplota: zkušební teplota by měla být 18 až
22 st.C, avšak v rámci dané zkoušky
kolísající v tomto rozmezí maximálně o +/-
1 st.C,
— provzdušňování: zkušební roztok nesmí být
provzdušňován probubláváním,
— krmení: žádné.
Měření pH a obsahu rozpuštěného kyslíku
v kontrolních skupinách a u všech zkušebních
koncentrací se provede na konci zkoušky; pH
zkušebního roztoku nesmí být měněno.
Těkavé sloučeniny se zkoušejí v hermeticky
uzavřených nádobách naplněných po okraj,
dostatečně velkých, aby nedošlo k nedostatku
kyslíku.
Prohlídka dafnií se provede nejpozději po 24 h a
znovu po 48 h.
Limitní zkouška
S využitím postupů popsaných v této metodě může
být provedena limitní zkouška s koncentrací
100 mg·l
1
s cílem prokázat, že EC50
je vyšší než
tato koncentrace.Jeli povaha zkušební látky taková, že ve vodě
nelze dosáhnout koncentrace 100 mg·l
-1
, provede
se limitní zkouška při koncentraci odpovídající
rozpustnosti této látky v použitém médiu (nebo
při maximální koncentraci, kdy látka vytváří
stabilní disperzi) (viz také bod 1.6.1.1). Limitní zkouška se provede s 20 dafniemi
rozdělenými do dvou nebo čtyř skupin a se stejným
počtem v kontrolní skupině (v kontrolních
skupinách). Dojdeli k imobilizaci, musí se
provést celá studie.
II.2 DATA A HODNOCENÍ
Na pravděpodobnostní logaritmický papír se pro
každé období, kdy byla prováděna pozorování (24 a
48 h), vynese mortalita v procentech proti
koncentraci.
Pokud je to možné, odhadnou se pro každé
pozorovací období EC
50
a meze spolehlivosti
(p = 0,05); tyto hodnoty se zaokrouhlí na jednu,
nebo nejvýše na dvě platné číslice (příklad
zaokrouhlení na dvě platné číslice: 173,5 se
zaokrouhlí na 170, 0,127 na 0,13, 1,21 na 1,2). V případech, kdy je sklon křivky závislosti
mortality v procentech na koncentraci látky
příliš strmý, aby umožnil výpočet hodnoty EC
50
,
postačuje grafický odhad této hodnoty.
Jestliže dvě po sobě jdoucí koncentrace lišící se
faktorem 2,2 vyvolají nulovou a 100% imobilizaci,
jsou dostatečnou informací o rozpětí, ve kterém
EC50
leží. Zjistíli se, že není možné udržet stabilitu nebo
homogenitu zkušební látky, uvede se to ve zprávě
a výsledky se interpretují s opatrností.
II.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat
následující údaje:
— údaje o testovacím organismu (vědecký název,
kmen, dodavatel nebo původ, veškerá
předchozí ošetření, metoda chovu – včetně
původu, druhu a množství potravy, frekvence
krmení);
— zdroj ředicí vody a hlavní chemické
charakteristiky (pH, teplota, tvrdost);
— u látek s malou rozpustností ve vodě údaj o
metodě přípravy zásobních a zkušebních
roztoků;
— koncentrace všech pomocných látek;
— přehled použitých koncentrací a veškeré
dostupné informace o stabilitě zkušební
látky ve zkušebním roztoku při použitých
koncentracích;
— jestliže byly provedeny chemické analýzy, údaje
o použitých metodách a získané výsledky;
— výsledek limitní zkoušky, pokud byla provedena;
— popis zkušebního zařízení;
— světelný režim;
— koncentrace rozpuštěného kyslíku, hodnoty pH,
teplota zkušebních roztoků;
— důkaz, že byla splněna kritéria jakosti;
— tabulka kumulativních hodnot imobility při
každé koncentraci a při kontrolní zkoušce
(a popřípadě při kontrolní zkoušce
s pomocnou látkou) při každé z doporučených
dob pozorování (24 a 48 h);
— graf křivky závislosti účinku, vyjádřeného
v procentech, na koncentraci na konci
zkoušky;
— podle možnosti hodnoty EC
50
při každé
z doporučených dob pozorování (při 95%
intervalu spolehlivosti) — použité statistické metody stanovení hodnot
EC
50
; — při použití referenční látky údaj o získaných
výsledcích;
— nejvyšší zkušební koncentrace, která nevyvolala
za dobu zkoušky imobilizaci;
— nejnižší zkušební koncentrace, která vyvolala
za dobu zkoušky 100% imobilizaci.
II.4 LITERATURA
(1) OECD, Paris, 1981, Test Guidelines 202,
Decision of the Council C(81) 30 final and
updates.
(2) International Standard ISO, Water Quality –
Determination of inhibition of mobility of
Daphnia magna Straus, ISO 6341-1989.
(3) AFNOR Inhibition of mobility of Daphnia magna
Straus (Cladocera – crustacea) NFT 90 301
(January 1983).
(4) Verfahrensvorschlag des Umweltbundesamtes zum
akuten Daphnien-Test. Rudolph, P., Boje, R.
Ökotoxikologie, Grundlagen für die
ökotoxikologische Bewertung von
Umweltchemikalien nach dem
Chemikaliengesetz, ecomed 1986.
(5) DIN Testverfahren mit Wasserorganismen 38412
(L1) und (L11).
(6) Finney, D. J. Statistical Methods in
Biological Assay. Griffin, Weycombe, U.K.,
1978.
(7) Litchfield, J. T., Wilcoxon, F. A simplified
method of evaluating doseeffect
experiments. J. Pharmacol. Exper. Ther.,
1949, 96, 99-113.
(8) Sprague, J. B. Measurement of pollutant
toxicity to fish. I Bioassay methods for
acute toxicity. Water Res., 1969, 3,
793821.
(9) Sprague, J. B. Measurement of pollutant
toxicity to fish. II Utilising and applying
bioassay results. Water Res. 1970, 4, 3-32.
(10) Stephan, C. E. Methods for calculating an
LC
50
. In Aquatic Toxicology and Hazard
Evaluation (F. I. Mayer, J. L. Hamelink
(eds.)). American Society for Testing and
Materials. ASTM, 1977, STP 634, 65-84.(11) Stephan, C. E., Busch, K. A., Smith, R.,
Burke, J., Andrews, R. W. A computer
program for calculating an LC
50
. US EPA.DODATEK 1
Upravená voda
Příklad vhodné ředicí vody (podle ISO 6341)
Všechny chemikálie musí být čistoty p.a.
Voda musí být kvalitní destilovaná nebo
deionizovaná s vodivostí menší než 5 µS*cm
-1
.Destilační přístroj nesmí obsahovat žádné měděné
části.
Zásobní roztoky:
CaCl
2
*2H2
O (chlorid vápenatý dihydrát) 11,76 g
se rozpustí ve vodě a doplní vodou na 1 litr. MgSO
4
*7H2
O (síran hořečnatý heptahydrát) 4,93 g
se rozpustí ve vodě a doplní vodou na 1 litr. NaHCO
3
(hydrogenuhličitan sodný) 2,59 g
se rozpustí ve vodě a doplní vodou na l litr. KCl (chlorid draselný) 0,23 g
se rozpustí ve vodě a doplní vodou na 1 litr.
Upravená ředicí voda
Smísí se po 25 ml všech čtyř zásobních roztoků a
doplní vodou na 1 litr.
Provzdušňuje se, dokud koncentrace rozpuštěného
kyslíku neodpovídá koncentraci nasycení vzdušným
kyslíkem.
pH musí být 7,8 +/- 0,2.
Podle potřeby se pH upraví pomocí NaOH (hydroxid
sodný) nebo HCl (kyselina chlorovodíková).
Tato ředicí voda se nechá 12 h stát a nemusí být
dále provzdušňována.
Koncentrace úhrnu iontů Ca a Mg v tomto roztoku
je 2,5 mmol*l
-1
. Poměr množství iontů Ca : Mg je
4 : 1 a poměr množství iontů Na : K je 10 : 1.
Celková koncentrace alkalických kovů v tomto
roztoku je 0,8 mmol*l-1
. Jakákoli odchylka v přípravě vody k ředění nesmí
změnit složení ani vlastnosti vody.
DODATEK 2
Souhrn výsledků kruhového testu EHS provedeného
v roce 1978 (citovaného také v (2)).
Upozornění: účelem tohoto kruhového testu bylo
stanovení 24hodinové hodnoty EC
50
. Použité látky:
1) Dichroman draselný
2) Kyselina tetrapropylbenzensulfonová
3) Kyselina tetrapropylbenzensulfonová, sodná sůl
4) Kyselina 2,4,5trichlorfenoxyoctová, draselná
sůl
-----------------------------------------------------
Látka Počet Počet Střední
zúčastněných výsledků hodnota
laboratoří pro 24hodinové
výpočet EC50
mg/l
-----------------------------------------------------
1 46 129 1,5
2 36 108 27
3 31 84 27
4 32 72 770
-----------------------------------------------------
DODATEK 3
Příklad závislosti imobilizace, vyjádřené
v procentech, na koncentraci
Příklad stanovení EC
50
s použitím
pravděpodobnostního logaritmického papíru Imobilizace v %
III. METODA PRO STANOVENÍ INHIBICE RŮSTU ŘAS – METODA
C.3 PODLE PŘÍLOHY SMĚRNICE 92/69/EHS
III.1 METODA
III.1.1 ÚVOD
Účelem této zkoušky je stanovit účinky látky na
růst jednobuněčných zelených řas. Relativně
krátkodobými zkouškami (72 h) lze posoudit účinky
na několik generací řas. Tato metoda může být
upravena pro použití s několika druhy řas,
přičemž musí být v protokolu o zkoušce uveden
popis metody.
Použití metody je nejsnadnější v případě látek
rozpustných ve vodě, které za podmínek zkoušky
pravděpodobně zůstávají ve vodě.
Metodu lze použít pro látky, které přímo
neovlivňují měření růstu řas.
Je žádoucí mít před započetím zkoušky k dispozici
co nejúplnější údaje o rozpustnosti látky ve
vodě, o tenzi par, chemické stabilitě,
disociačních konstantách a o biologické
rozložitelnosti látky.
Další informace (např. strukturní vzorec, stupeň
čistoty, druh a podíl významných nečistot
v procentech, přítomnost a množství přísad a
rozdělovací koeficient noktanol/voda) je třeba
vzít v úvahu při plánování zkoušky i při
interpretaci výsledků.
III.1.2 DEFINICE A JEDNOTKY
Hustota buněk: počet buněk na jeden mililitr.
Růst: zvyšování hustoty buněk během doby trvání
zkoušky.
Růstová rychlost: nárůst hustoty buněk za
jednotku času.
EC
50
: v této metodě jde o koncentraci zkušební
látky, která má za následek 50% snížení růstu
(Eb
C50
) nebo růstové rychlosti (Er
C50
) vzhledem
ke kontrole. NOEC (no observed effect concentration): v této
metodě jde o je nejvyšší zkoušenou koncentraci,
při níž není pozorováno žádné významné snížení
růstu nebo růstové rychlosti ve srovnání
s kontrolou.
Všechny koncentrace zkušební látky se udávají
v hmotnosti na jednotku objemu (mg·l
1
). Mohou se
také vyjádřit v hmotnostních podílech (mg*kg1
).III.1.3 REFERENČNÍ LÁTKY
Zkoušky s referenčními látkami mohou být
provedeny s cílem prokázat, že se reakce
zkušebních druhů za laboratorních zkušebních
podmínek podstatně nezměnila.
Při použití referenční látky musí být výsledky
uvedeny do protokolu o zkoušce. Jako referenční
látka může být použit dichroman draselný, ale
jeho barva může ovlivnit kvalitu a intenzitu
světla dostupného buňkám a také
spektrofotometrická měření, pokud se použijí.
Dichroman draselný byl použit v mezinárodních
mezilaboratorních testech (viz (3) a doplněk 2).
III.1.4 PODSTATA ZKUŠEBNÍ METODY
Může být provedena limitní zkouška s koncentrací
100 mg·l
1
, s cílem prokázat, že EC50
je vyšší
než tato koncentrace. Exponenciálně rostoucí kultury vybraných zelených
řas jsou po několik generací vystaveny za
definovaných podmínek různým koncentracím
zkušební látky.
Zkušební roztoky se kultivují 72 h, během nichž
se alespoň každých 24 h měří hustota buněk
v každém roztoku. Stanoví se snížení růstu ve
srovnání s kontrolní kulturou.
III.1.5. KRITÉRIA JAKOSTI
Kritéria jakosti se vztahují jak na limitní
zkoušku, tak na celý zkušební postup.
Hustota buněk v kontrolních kulturách by se měla
za 3 dny zvýšit alespoň šestnáctkrát.
Koncentrace zkušební látky nesmí po celou zkoušky
klesnout pod 80 % původní hodnoty koncentrace.
U látek, které se ve zkušebním médiu lehce
rozpouštějí a dávají stabilní roztoky,
tj. v podstatné míře netěkají, nerozkládají se,
nehydrolyzují nebo se neadsorbují, lze počáteční
koncentraci pokládat za ekvivalentní s nominální
koncentrací. Musí být potvrzeno, že byly
koncentrace po celou zkoušku udrženy a že
kritéria jakosti byla dodržena.
U látek, které
i) jsou ve zkušebním médiu špatně rozpustné, nebo
ii) mohou vytvářet stabilní emulze nebo disperse,
nebo
iii) jsou ve vodných roztocích nestabilní,
musí být počáteční koncentrace brána jako
koncentrace naměřená v roztoku na začátku
zkoušky. Koncentrace se stanoví po určité době
jejího ustálení.
Ve všech uvedených případech musí být během
zkoušky provedena další měření s cílem potvrdit
skutečné expoziční koncentrace nebo dodržení
kritérií jakosti.
Je známo, že podstatná část zkušební látky může
být během zkoušky zabudována do biomasy řas.
Proto by se za účelem prokázání dodržení kritérií
jakosti mělo brát v úvahu jak množství látky
zabudované do biomasy řas, tak látka v roztoku
(nebo, neníli to technicky možné, ve vodním
sloupci). Protože však stanovení koncentrace
látky v biomase řas může představovat technické
obtíže, může být dodržení kritérií jakosti
prokázáno zkouškou s nejvyšší koncentrací látky,
ale bez řas, a měřením koncentrací v roztoku
(nebo, neníli to technicky možné, ve vodním
sloupci) na začátku a na konci zkoušky.
III.1.6 POPIS ZKUŠEBNÍHO POSTUPU
III.1.6.1 Činidla
III.1.6.1.1 Roztoky zkušebních látek
Zásobní roztoky o požadované koncentraci se
připraví rozpuštěním látky v deionizované vodě
nebo ve vodě podle bodu 1.6.1.2.
Zvolené zkušební koncentrace se připraví přidáním
vhodného alikvotního podílu k předkulturám řas
(viz doplněk 1).
Látky se obvykle zkoušejí až do meze jejich
rozpustnosti. U některých látek (např. u látek
s nízkou rozpustností ve vodě nebo vysokou
hodnotou P
o/v
nebo u látek, které ve vodě
vytvářejí spíše stabilní disperse než pravé
roztoky) je možné provést zkoušku při koncentraci
vyšší, než je mez rozpustnosti, aby bylo
zajištěno, že je dosaženo maximální koncentrace
odpovídající maximální rozpustnosti/stabilitě. Je
ovšem nutné, aby tato koncentrace jinak
nenarušovala zkušební systém (např. vytvořením
filmu na hladině bránícímu okysličení vody atd.).
Pro přípravu zásobních roztoků látek s nízkou
rozpustností ve vodě nebo pro usnadnění
rozptýlení látky ve zkušebním médiu lze použít
ultrazvukovou dispergaci, organická rozpouštědla
či emulgátory nebo dispergátory. Použijíli se
takové pomocné látky, měly by všechny zkušební
koncentrace obsahovat stejné množství těchto
pomocných látek a stejné koncentraci pomocné
látky jako ve zkušebních sériích by měly být
exponovány další kontroly. Koncentrace pomocných
látek by měla být minimální a v žádném případě by
neměla překročit 100 mg na l zkušebního média.Zkouška se provede bez úpravy pH. Existujíli
známky toho, že dochází k výrazné změně pH,
doporučuje se zkoušku opakovat s úpravou pH a
výsledky zaznamenat. V takovém případě se upraví
pH zásobního roztoku na pH vody k ředění, pokud
proti tomu neexistuji specifické důvody. Při
úpravě pH se dává přednost HCl a NaOH. Úprava pH
se provede tak, aby nebyla koncentrace zkušební
látky v zásobním roztoku v podstatné míře
změněna. Dojdeli úpravou ve zkušebním médiu
k chemické reakci nebo ke srážení, skutečnosti se
zaznamenají.
III.1.6.1.2 Zkušební médium
Voda musí být kvalitní destilovaná nebo
deionizovaná s vodivostí menší než 5 µS·cm
-1
.
Destilační přístroj nesmí obsahovat žádné měděné
části. Je doporučeno následující médium:
Podle následující tabulky se připraví čtyři
zásobní roztoky. Tyto roztoky se sterilizují
membránovou filtrací nebo v autoklávu a skladují
se v temnu při 4 st.C. Zásobní roztok č. 4 by se
měl sterilizovat pouze membránovou filtrací.
Ředěním těchto roztoků se získají konečné živné
koncentrace zkušebních roztoků.
---------------------------------------------------------------------
Živina Koncentrace Konečná koncentrace ve
v zásobním zkušebním roztoku
roztoku
---------------------------------------------------------------------
Zásobní roztok č. 1: makroživiny
NH4Cl 1,5 15 mg*l-1
MgCl2*6H2O 1,2 12 mg*l-1
CaCl2*2H2O 1,8 18 mg*l-1
MgSO4*7H2O 1,5 15 mg*l-1
KH2PO4 0,16 1,6 mg*l-1
Zásobní roztok č. 2: Fe - EDTA
FeCl3*6H2O 80 0,08 mg*l-1
Na2EDTA*2H2O 100 0,1 mg*l-1
Zásobní roztok č. 3: stopové prvky
H3BO3 185 0,18 mg*l-1
MnCl2*4H2O 415 0,415 mg*l-1
ZnCl2 3 3×10-3 mg*l-1
CoCl2*6H2O 1,5 1,5×10?3 mg*l-1
CuCl2*2H2O 0,01 1×10-5 mg*l-1
Na2MoO4*2H2O 7 7×10-3 mg*l-1
Zásobní roztok č. 4: NaHCO3
NaHCO3 50 g*l-1 50 mg*l-1
---------------------------------------------------------------------
Po ustálení a po provzdušnění by mělo mít médium
hodnotu pH přibližně 8.
III.1.6.2 Přístroje a pomůcky
— Běžné laboratorní vybavení.
— Kultivační baňky o vhodném objemu (např.
Erlenmeyerovy baňky na 250 ml jsou vhodné
v případě zkušebního roztoku o objemu
100 ml). Všechny zkušební baňky by měly být
identické, pokud jde o materiál a rozměry.
— Kultivační zařízení: místnost nebo komora,
v nichž lze udržovat teplotu 21 – 25 st.C +/-
2 st.C a stálé rovnoměrné osvětlení
v rozsahu vlnových délek od 400 do 700 nm.
Jestliže všechny řasy v kontrolních
kulturách dosáhly doporučené růstové
rychlosti, lze předpokládat, že podmínky
pro jejich růst, včetně intenzity světla,
jsou vyhovující.
U zkušebních roztoků s průměrnými
koncentracemi se doporučuje použít
světelnou intenzitu od 60 do 120 µE·m
2
*s1
(35 – 70*1018 fotonů m2
*s1
) při měření
v rozsahu 400 – 700 nm vhodným detektorem.
Při měření intenzity luxmetry je přijatelný
rozsah odpovídající 6000 – 10 000 lx. Této světelné intenzity lze dosáhnout
umístěním čtyř až sedmi univerzálních
bílých 30W zářivek (teplota chromatičnosti
přibližně 4 300 K) ve vzdálenosti 0,35 m od
kultury řas.
— Měření hustoty buněk by se mělo provádět přímým
počítáním živých buněk, např. pod
mikroskopem s počítacími komůrkami. Za
předpokladu dostatečné citlivosti a
prokázané dobré korelace s buněčnou
hustotou mohou být použity i jiné postupy
(fotometrie, turbidimetrie,...).
III.1.6.3 Testovací organismy
Je doporučeno použít rychle rostoucí druhy
zelených řas vhodné pro kultivaci a zkoušení.
Dává se přednost následujícím druhům:
— Selenastrum capricornutum, např. ATCC 22662
nebo CCAP 278/4,
— Scenedesmus subspicatus, např. 86.81 SAG.
Poznámka:
ATCC = American Type Culture Collection (USA)
CCAP = Culture Centre of Algae and Protozoa (VB)
SAG = Collection of algal culture (Göttingen,
SRN)
Použití jiného druhu řas musí být uvedeno ve
zprávě.
III.1.6.4 Zkušební postup
Koncentrační rozmezí, ve kterém lze očekávat
účinky, se určí na základě výsledků orientačních
zkoušek.
Dva parametry, jež jsou mírou růstu (biomasa a
růstová rychlost), mohou poskytovat zcela
rozdílné hodnoty snížení růstu; v orientační
zkoušce by měly být použity oba parametry, aby
mohlo zajištěno, že geometrická řada koncentrací
umožní odhadnout jak E
b
C50
, tak Er
C50
. Počáteční hustota buněk
Doporučuje se, aby byla počáteční hustota buněk
řasy Selenastrum capricornutum a řasy Scenedesmus
subspicatus ve zkušebních roztocích přibližně 104
buněk na ml. Použije-li se jiný druh řasy, měla
by být biomasa srovnatelná.
Koncentrace zkušební látky
Pro zkoušku se připraví geometrická řada nejméně
pěti koncentrací lišících se od sebe vždy
faktorem nepřekračujícím 2,2. Nejnižší zkoušená
koncentrace by neměla vykazovat žádný
pozorovatelný účinek na růst řas. Nejvyšší
zkoušená koncentrace by měla omezit růst ve
srovnání s kontrolní zkouškou nejméně o 50 %,
nejlépe by měla růst zcela zastavit.
Opakování a kontroly
Plán zkoušky by měl zahrnovat tři opakování
s každou zkušební koncentrací. Dále se provedou
tři kontroly bez zkušební látky, a je-li použita
pomocná látka, též tři kontroly s touto látkou.
Je-li pro to důvod, může být plán zkoušky upraven
tak, že se použije více koncentračních úrovní a
sníží se počet opakování zkoušky s každou
koncentrací.
Provedení zkoušky
Zkušební roztoky o požadované koncentraci
zkušební látky a požadovaném množství inokula řas
se připraví přidáním alikvotních podílů zásobního
roztoku zkušební látky k vhodnému množství
prekultury řas (viz doplněk 1).
Kultivační baňky se protřepou a umístí se do
kultivačního zařízení. Buňky řas se udržují
v suspensi třepáním, mícháním nebo probubláváním
vzduchem, aby se zlepšila výměna plynů a zmenšilo
se kolísání pH ve zkušebních roztocích. Kultury
se udržují při teplotě 21 – 25 st.C udržované
s přesností na +/- 2 st.C.
Hustota buněk v každé baňce se stanoví nejméně po
24, 48 a 72 h po zahájení zkoušky. Používá-li se
měření hustoty buněk jiná metoda, než je jejich
přímé počítání, použije se ke stanovení pozadí
filtrované médium pro kultivaci řas obsahující
odpovídající koncentraci zkušební chemické látky.
pH se měří na začátku zkoušky a po 72 h.
Hodnota pH by se neměla během zkoušky změnit víc
než o 1,5.
Zkoušení těkavých látek
V současné době neexistuje obecně přijatý způsob
zkoušení těkavých látek. Je-li o látce známo, že
se snadno vypařuje, mohou být použity uzavřené
kultivační nádoby se zvětšeným mrtvým objemem.
Při plánování objemu horní části kultivačních
baněk se musí zohlednit eventuální nedostatek
CO
2
. Byly navrženy varianty této metody (4). Měl by být učiněn pokus stanovit množství
zkušební látky, které v roztoku zůstalo; při
interpretaci výsledků zkoušek s těkavými látkami
v uzavřených systémech je doporučeno postupovat
mimořádně opatrně.
Limitní zkouška
S využitím postupů popsaných v této metodě může
být provedena limitní zkouška s koncentrací
100 mg·l
1
s cílem prokázat, že EC50
je vyšší než
tato koncentrace. Jeli povaha zkušební látky taková, že nelze ve
vodě dosáhnout koncentrace 100 mg·l
-1
, provede se
limitní zkouška při koncentraci odpovídající
rozpustnosti této látky v použitém médiu (nebo
při maximální koncentraci, kdy látka vytváří
stabilní disperzi) (viz také bod 1.6.1.1).Limitní zkouška se provede alespoň třikrát, se
stejným počtem kontrol. V limitní zkoušce se
stanoví oba parametry, jež jsou mírou růstu
(biomasa a růstová rychlost).
Zjistíli se v limitní zkoušce pokles růstu
biomasy nebo růstové rychlosti ve srovnání
s kontrolami o 25 % nebo více, provede se úplná
zkouška.
III.2 DATA A HODNOCENÍ
Naměřené hustoty buněk ve zkušební kultuře a
v kontrolách se spolu s koncentracemi zkušební
látky a dobami měření shrnou do tabulky. Střední
hodnota hustoty buněk pro každou zkušební
koncentraci a pro kontroly se vynese proti času
(0 – 72 h) a sestrojí se růstová křivka.
Vztah koncentrace/účinek se stanoví dvěma
následujícími postupy. Některé látky mohou růst
při nízkých koncentracích stimulovat. V úvahu by
měla být vzata pouze data udávající potlačení
růstu mezi 0 a 100 %.
III.2.1 POROVNÁNÍ PLOCH POD RŮSTOVÝMI KŘIVKAMI
Plocha mezi růstovou křivkou a vodorovnou linií N
= N0 se vypočte podle následujícího vzorce:
N1 - N2 N1 + N2 - 2No Nn-1 + Nn - 2No
A = --------- . t1 + ------------- . (t2 - t1) + ... + ---------------- . (tn - tn-1)
2 2 2
kde
A = plocha,
N
0
= počet buněk v ml v čase t0 (na počátku
zkoušky), N
1
= naměřený počet buněk v 1 ml v čase t1, N
n
= naměřený počet buněk v 1 ml v čase tn, t
1
= doba prvního měření od počátku zkoušky, t
n
= doba n-tého měření od počátku zkoušky, n = počet měření od počátku zkoušky.
Potlačení růstu vyjádřené v % (I
A
) se pro každou
koncentraci zkušební látky vypočte podle vzorce:
Ac - At
IA = ----------- x 100
Ac
kde
A
c
= plocha mezi růstovou křivkou kontrolní
zkoušky a horizontální linií N = N0
, At = plocha mezi růstovou křivkou při koncentraci
t a horizontální linií N = N
0
.Hodnoty IA se nanesou na semilogaritmický nebo na
pravděpodobnostní semilogaritmický papír proti
odpovídajícím koncentracím. Vynesouli se body na
pravděpodobnostní papír, proloží se body přímka,
a to ručně nebo regresním výpočtem.
Hodnota EC
.50
se odhadne odečtením z regresní
přímky jako koncentrace odpovídající 50% snížení
růstu (IA
= 50 %). Pro jednoznačné označení této
hodnoty v rámci této metody výpočtu se doporučuje
použít symbol Eb
C50
. Je důležité, aby byla
s hodnotou Eb
C50
uvedena příslušná expoziční
doba, např. Eb
C50
(0 – 72 h)III.2.2 POROVNÁNÍ RŮSTOVÝCH RYCHLOSTÍ
Průměrnou specifickou růstovou rychlost (µ) pro
exponenciálně rostoucí kultury lze vypočítat
jako:
1nNn - 1nN0
µ = ------------
tn - t0
kde t
0
je čas začátku zkoušky. Průměrnou specifickou růstovou rychlost lze také
odvodit ze sklonu regresní přímky v závislosti
ln N na čase.
Snížení specifické růstové rychlosti vyjádřené
v procentech pro každou koncentraci zkušební
látky (I
µt
) se vypočte podle vzorce:
µc - µt
Iµt = ----------- x 100
µc
kde
µc = střední specifická růstová rychlost
v kontrole,
µt = střední specifická růstová rychlost pro
zkušební koncentraci t.
Snížení střední specifické růstové rychlosti
v procentech při všech koncentracích zkušební
látky ve srovnání s kontrolní hodnotou se vynese
proti logaritmu koncentrace. Hodnotu EC
50
lze
odečíst z výsledného grafu. Pro jednoznačné
označení EC50
odvozené touto metodou se
doporučuje použít symbol Er
C50
. Musí být uvedeny
okamžiky měření, např. vztahujeli se hodnota
k času 0 a k 72 h, označí se symbolem
Er
C50
(0 – 72 h): Poznámka: Ve výrazu pro specifickou růstovou
rychlost vystupují logaritmy, tzn. malé změny
růstové rychlosti mohou odpovídat velkým změnám
biomasy. Hodnoty E
b
C a Er
C tedy nejsou číselně
srovnatelné.III.2.3 VÝPOČET NOEC
Hodnota koncentrace nezpůsobující žádné
pozorovatelné účinky (NOEC) se stanoví vhodnou
statistickou metodou pro srovnávání více vzorků
(např. analýza rozptylu a Dunnettův test)
s využitím jednotlivých hodnot ploch pod
růstovými křivkami A (viz bod 2.1) nebo
specifických růstových rychlostí µ (viz bod 2.2).
III.3 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat
následující údaje:
— zkušební látka: údaje o chemické identitě;
— testovací organismus: původ, laboratorní
kultura, číslo kmene, metoda kultivace;
— zkušební podmínky:
— datum zahájení a ukončení zkoušky a délka
zkoušení,
— teplota,
— složení média,
— kultivační zařízení,
— hodnoty pH roztoku na počátku a na konci
zkoušky (jeli pozorováno kolísání pH
o více než 1,5, uvede se vysvětlení),
— nosič a metoda použitá pro rozpouštění
zkušební látky, koncentrace nosiče ve
zkušebních roztocích,
— intenzita a kvalita světla,
— zkoušené koncentrace (naměřené nebo
nominální);
— výsledky:
— koncentrace buněk v jednotlivých baňkách
v každé době měření a metoda měření
koncentrace buněk,
— průměrné hodnoty koncentrace buněk,
— růstové křivky,
— grafické znázornění vztahu koncentrace –
účinek,
— hodnoty EC a metoda výpočtu,
— NOEC,
— další pozorované účinky.
III.4 LITERATURA
(1) OECD, Paris, 1981, Test Guideline 201,
Decision of the Council C(81) 30 Final.
(2) Umweltbundesamt, Berlin, 1984,
Verfahrensvorschlag „Hemmung der
Zellvermehrung bei der Grünalge Scenedesmus
subspicatus“, In: Rudolph / Boje:
Ökotoxikologie, ecomed, Landsberg,1986.
(3) ISO 8692 – Water quality – Fresh water algal
growth inhibition test with Scenedesmus
subspicatus and Selenastrum capricornutum.
(4) S. Galassi, M. Vighi. Chemosphere, 1981, 10,
1123-1126.
DODATEK 1
Příklad postupu kultivace řas
Obecné poznámky
Účelem kultivace následujícím postupem je získání kultur
řas pro zkoušky toxicity.
Měly by být použity vhodné metody k tomu, aby bylo
zajištěno, že kultury řas nebudou infikovány bakteriemi
(ISO 4833). Vhodné mohou být axenické kultury, avšak
základem jsou jednodruhové kultury.
Všechny operace se provádějí za sterilních podmínek, aby
nedošlo ke kontaminaci bakteriemi a jinými řasami.
Kontaminované kultury se vyřadí.
Postupy při získání kultur řas
Příprava živných roztoků (média):
Médium lze připravit zředěním koncentrovaných základních
roztoků živin. K získání pevného média se přidává 0,8 %
agaru. Použité médium by mělo být sterilní. Sterilizace
v autoklávu může vést ke ztrátě NH
3
.Kmenová kultura:
Kmenové kultury jsou malé kultury řas, které se
pravidelně přenášejí do čerstvého média, kde slouží jako
výchozí testovací materiál. Nejsouli kultury pravidelně
používány, vyočkovávají se na šikmý agar. Poté se nejméně
jednou za dva měsíce přenášejí do čerstvého média.
Kmenové kultury se pěstují v Erlenmeyerových baňkách
obsahujících vhodné medium (objem přibližně 100 ml). Jsou-
li řasy kultivovány při teplotě 20 st.C a stálém osvětlení,
musí se přenášet každý týden.
Při přeočkování se přenese sterilní pipetou do baňky
s čerstvým mediem takové množství „staré“ kultury, aby
byla výchozí koncentrace u rychle rostoucího druhu řas
asi stokrát menší než koncentrace kultury staré.
Růstovou rychlost druhu řas lze odečíst z růstové křivky.
Jeli známa, lze z ní odhadnout hustotu, při níž musí být
kultura přenesena do čerstvého média. K tomu musí dojít
před fází odumírání kultury.
Předkultura:
Účelem předkultur je poskytnout dostatečné množství řas
potřebných pro naočkování testovacích kultur. Předkultura
se kultivuje za zkušebních podmínek a použije se ještě
během exponenciálního růstu, to znamená obvykle po
třídenní inkubační lhůtě. Obsahujíli kultury řas
deformované nebo abnormální buňky, musí se odstranit.
DODATEK 2
V normě ISO 8692 - Jakost vody - Růstová inhibiční
zkouška na sladkovodních řasách Scenedesmus subspicatus a
Selenastrum capricornutum jsou uvedeny výsledky
mezilaboratorních zkoušek dichromanu draselného
provedených 16 laboratořemi.
-----------------------------------------------------------------
Střední hodnota (mg*l-1) Rozpětí (mg*l-1)
-----------------------------------------------------------------
ErC50 (0 – 72 h) 0,84 0,60 až 1,03
EbC50 (0 – 72 h) 0,53 0,20 až 0,75
-----------------------------------------------------------------
IV. METODY PRO STANOVENÍ „SNADNÉ“ BIOLOGICKÉ
ROZLOŽITELNOSTI – METODY C.4 PODLE PŘÍLOHY SMĚRNICE
92/69/EHS
IV.I.1 ÚVOD
Je popsáno šest metod, které umožňují
screeningové posouzení snadné biologické
rozložitelnosti chemických látek v aerobním
vodním prostředí:
a) Zkouška na úbytek rozpuštěného organického
uhlíku (DOC) (metoda C.4A)
b) Modifikovaná screeningová zkouška OECD – na
úbytek DOC (metoda C.4B)
c) Zkouška na uvolňování oxidu uhličitého (CO
2
)
(modifikovaná Sturmova zkouška)
(metoda C.4C) d) Zkouška manometrickou respirometrií
(metoda C.4D)
e) Zkouška v uzavřených lahvičkách (metoda C.4E)
f) Zkouška MITI (Ministerstvo zahraničního
obchodu a průmyslu – Japonsko)
(metoda C.4F)
Obecné a společné úvahy pro všech šest zkoušek
jsou uvedeny v části I metody. Specifické body
jednotlivých metod jsou uvedeny v částech II až
VII. Přílohy obsahují definice, vzorce a návody.
Mezilaboratorní srovnávací test OECD provedený
v roce 1988 ukázal, že metody poskytují shodné
výsledky. V závislosti na fyzikálním charakteru
látky, která má být zkoušena, se však může dávat
přednost určité metodě.
IV.I.2 VÝBĚR VHODNÉ METODY
Pro volbu nejvhodnější metody jsou nezbytné
informace o rozpustnosti, tenzi par a o
adsorpčních vlastnostech chemické látky. Pro
výpočet teoretických hodnot a/nebo ověření
naměřených hodnot parametrů, např. TSK, TCO
2
,
DOC, TOC, CHSK (viz přílohy I a II) je nutné znát
chemickou strukturu nebo vzorec. Zkušební chemické látky, jejichž rozpustnost ve
vodě je alespoň 100 mg·l
1
, lze zkoušet všemi
metodami za předpokladu, že netěkají a
neadsorbují se. Pro látky špatně rozpustné ve
vodě, které těkají nebo se adsorbují, jsou vhodné
metody uvedené v tabulce 1. Způsob, jakým je
třeba zacházet s látkami špatně rozpustnými ve
vodě a s látkami těkavými, je popsán
v příloze III. Mírně těkavé látky je možno
zkoušet metodou úbytku DOC, pokud je ve
zkušebních nádobách (které musí být vhodně
uzavřeny) dostatečně velký prostor pro plyn.
V tomto případě musí být provedena abiotická
kontrola pro zohlednění případné fyzikální
ztráty.
Tabulka 1: Použitelnost zkušebních metod
------------------------------------------------------------------------------- ----------
Zkouška Analytická metoda Vhodnost pro látky
špatně těkavé adsorbující
rozpustné se
------------------------------------------------------------------------------- ----------
na úbytek DOC rozpuštěný organický — — + / –
uhlík
modif. zkouška OECD – rozpuštěný organický — — + / –
na úbytek DOC uhlík
na uvolňování CO2 respirometrie: + — +
uvolňování CO2
manometrická manometrická + + / – +
respirometrie respirometrie: spotřeba
kyslíku
zkouška v uzavřených respirometrie: + / – + +
lahvičkách rozpuštěný kyslík
MITI respirometrie: spotřeba + + / – +
kyslíku
------------------------------------------------------------------------------- ----------
Pro interpretaci získaných výsledků, zejména
pokud jsou výsledky nízké nebo marginální, se
vyžadují informace o čistotě nebo relativních
podílech hlavních složek zkušebního materiálu.
Pro volbu vhodných zkušebních koncentrací mohou
být velmi užitečné informace o toxicitě zkušební
chemické látky pro bakterie (příloha IV); tyto
informace mohou být důležité pro správnou
interpretaci nízkých hodnot biologického
rozkladu.
IV.I.3 REFERENČNÍ LÁTKY
Pro ověření postupu se souběžně se zkouškou a ve
vlastní baňce zkoušejí referenční chemické látky,
které splňují kritéria snadné biologické
rozložitelnosti.
Vhodnými chemickými látkami jsou anilin (čerstvě
předestilovaný), natriumacetát, natriumbenzoát.
Všechny tyto referenční chemické látky se za
podmínek v uvedených metodách rozkládají, i když
se záměrně nepřidá žádné inokulum.
Byl podán návrh hledat referenční chemickou
látku, která by byla snadno rozložitelná, avšak
vyžadovala by přidání inokula. Navržen byl
kaliumhydrogenftalát. O této látce je třeba
ještě získat více údajů, než ji bude možné
přijmout jako referenční látku.
V respirometrických zkouškách mohou v důsledku
nitrifikace ovlivnit spotřebu kyslíku látky
obsahující dusík (viz přílohy II a V).
IV.I.4 PODSTATA ZKUŠEBNÍCH METOD
Roztok nebo suspense zkušební látky v minerálním
prostředí se inokuluje a kultivuje v aerobních
podmínkách v temnu nebo v difuzním světle.
Množství DOC ve zkušebním roztoku pocházející
z inokula se musí udržovat ve srovnání s DOC
pocházejícího ze zkušební látky co nejnižší.
Endogenní aktivita inokula se zohlední na základě
souběžné slepé zkoušky s inokulem, avšak bez
zkoušené látky, třebaže endogenní aktivita buněk
v přítomnosti látky přesně neodpovídá aktivitě
v endogenní kontrolní zkoušce. Za účelem kontroly
postupu se souběžně provádí zkouška s referenční
látkou.
Obecně se rozklad sleduje stanovením parametrů
jako DOC, tvorba CO
2
nebo spotřeba kyslíku a
měření se provádějí v dostatečně krátkých
intervalech, aby bylo možné identifikovat začátek
a konec biologického rozkladu. Měření
automatickými respirometry je kontinuální. Někdy
se doplňkově k jinému parametru měří DOC, avšak
obvykle pouze na začátku a na konci zkoušky. Lze
rovněž použít specifickou chemickou analýzu,
kterou se vyhodnotí primární rozklad zkušební
látky nebo kterou se stanoví koncentrace
kteréhokoli vzniklého meziproduktu (ve zkoušce
MITI povinné). Zkouška obvykle trvá 28 dnů. Je však možné
ukončit měření před uplynutím 28 dní, tj. jakmile
vykazuje křivka biologického rozkladu plató po
tři po sobě následující měření. Je také možné
měření po 28 dnech prodloužit, jestliže z křivky
vyplývá, že biologický rozklad začal, avšak 28.
dne ještě nebylo ještě dosaženo plató.
IV.I.5 KRITÉRIA JAKOSTI
IV.I.5.1 Reprodukovatelnost
Vzhledem k charakteru biologického rozkladu a
směsných populací bakterií používaných jako
inokula se stanovení provádějí nejméně
duplicitně.
Je obecně známo, že čím vyšší je koncentrace
mikroorganismů přidaných na počátku do zkušebního
média, tím menší jsou rozdíly mezi vícenásobnými
měřeními. Okružní testy rovněž ukázaly, že mezi
výsledky získanými různými laboratořemi mohou být
velké rozdíly, avšak u snadno biologicky
rozložitelných sloučenin se obvykle dosahuje
dobré shody.
IV.I.5.2 Platnost zkoušky
Zkouška se považuje za platnou, je-li na konci
zkoušky nebo popřípadě na konci 10denního období
rozkladu rozdíl hodnot krajních výsledků
vícenásobných měření rozkladu zkušební chemické
látky v oblasti plató křivky menší než 20 % a
dosáhlli stupeň rozkladu referenční látky
vyjádřený v procentech úrovně snadné biologické
rozložitelnosti do 14 dní. Není-li splněna
kterákoli z těchto podmínek, měření se opakuje.
Vzhledem k náročnosti metod neznamenají nízké
hodnoty nutně skutečnost, že zkušební látka není
v podmínkách životního prostředí biologicky
rozložitelná, ale znamenají, že k prokázání
biologické rozložitelnosti jsou třeba další
studie.
Jestliže ve zkoušce toxicity zahrnující jak
zkušební látku, tak referenční chemickou látku
došlo během 14 dnů k méně než 35% rozkladu
(stanoveného podle DOC) nebo k méně než 25%
rozkladu (stanoveného podle TSK nebo TCO
2
), lze
zkušební chemické látky považovat za inhibující
(viz také příloha IV). Série zkoušek by měla být
opakována, pokud možno s nižší koncentrací
zkušební chemické látky a/nebo s vyšší
koncentrací inokula, avšak ne s koncentrací vyšší
než 30 mg tuhých látek v litru.IV.I.6 OBECNÉ POSTUPY A PŘÍPRAVA
Obecné podmínky pro zkoušky jsou shrnuty
v tabulce 2. Přístroje a další experimentální
podmínky specifické pro jednotlivé metody jsou
popsány dále v kapitolách pro tyto příslušné
metody.
Tabulka 2: Zkušební podmínky
---------------------------------------------------- ---------------------------------------------------
Zkouška Zkouška Zkouška na Manometrická Modif. Zkouška Zkouška MITI
na uvolňování respirometrie screeningová v uzavřených (I)
úbytek CO2 zkouška OECD lahvičkách
---------------------------------------------------- --------------------------------------------------- DOC
Koncentrace
zkušební látky
mg*l-1 100 2 - 10 100
mg DOC/l 10 - 40 10 - 20 10 - 40
mg TSK/l 50 - 100 5 - 10
---------------------------------------------------- ---------------------------------------------------
Koncentrace =< 30 mg/l SL nebo =< 100 ml 0,5 ml =< 5 ml odpadní 30 mg/l SL
inokula odpadní vody/l sekundární vody/l (107-108)
(buňky/l, (107-108) odpadní vody/l (104-106)
přibližně) (105)
---------------------------------------------------- ---------------------------------------------------
Koncentrace
prvků
v minerálním
médiu (v mg*l-1)
P 116 11,6 29
N 1,3 0,13 1,3
Na 86 8,6 17,2
K 122 12,2 36,5
Mg 2,2 2,2 6,6
Ca 9,9 9,9 29,7
Fe 0,05 – 0,1 0,05 - 0,1 0,15
---------------------------------------------------- ---------------------------------------------------
pH 7,4 +/- 0,2 nejlépe 7,0
---------------------------------------------------- ---------------------------------------------------
Teplota 22 +/- 2 st.C 25 +/- 1 st.C
---------------------------------------------------- ---------------------------------------------------
DOC = rozpuštěný organický uhlík, TSK = teoretická spotřeba kyslíku, SL = suspendované látky
---------------------------------------------------- ---------------------------------------------------
IV.I.6.1 Ředicí voda
Používá se deionizovaná nebo destilovaná voda
neobsahující inhibující koncentrace toxických látek
(např. ionty Cu
2+
). Voda smí obsahovat nejvýše 10 %
obsahu organického uhlíku vneseného zkušebním
materiálem. Vysoká čistota vody pro zkoušky je nezbytná
pro to, aby se nevyskytovaly vysoké hodnoty slepého
pokusu. Kontaminace může pocházet z vlastních
přítomných nečistot, z materiálu měniče iontů,
z rozkladných látek z bakterií a řas. Pro každou sérii
měření se použije pouze jedna šarže vody, která byla
předem překontrolována analýzou DOC. Tato kontrola není
nutná u zkoušky v uzavřených lahvičkách, spotřeba
kyslíku vodou však musí být nízká.IV.I.6.2 Zásobní roztoky minerálních složek
Pro přípravu zkušebních roztoků se připraví zásobní
roztoky o vhodných koncentracích minerálních složek.
Níže uvedené zásobní roztoky je možné použít (při
různých zřeďovacích faktorech) pro metodu s úbytkem
DOC, modifikovanou screeningovou metodu OECD, metodu
s uvolňováním CO
2
, pro manometrickou respirometrii a
pro metodu s uzavřenými lahvičkami.
Zřeďovací faktory a specifická příprava minerálního
media pro zkoušku MITI jsou uvedeny v oddílech pro
jednotlivé zkoušky. Zásobní roztoky:
Za použití reakčních činidel čistoty p.a. se připraví
následující zásobní roztoky:
a) Dihydrogenfosforečnan draselný, KH2PO4 8,50 g
Hydrogenfosforečnan didraselný, K2HPO4 21,75 g
Hydrogenfosforečnan disodný dihydrát, Na2HPO4*2H2O 33,40 g
Chlorid amonný, NH4Cl 0,50 g
Rozpustí se ve vodě a doplní na 1 litr. pH roztoku
musí být 7,4.
b) Chlorid vápenatý bezvodý, CaCl2 27,50 g
nebo chlorid vápenatý dihydrát, CaCl2*2H2O 36,40 g
Rozpustí se ve vodě a doplní na 1 litr.
c) Síran hořečnatý heptahydrát, MgSO4*7H2O 22,50 g
Rozpustí se ve vodě a doplní na 1 litr.
d) Chlorid železitý hexahydrát, FeCl3*6H2O 0,25 g
Rozpustí se ve vodě a doplní na 1 litr.
Poznámka: Aby nebylo nutné připravovat tento roztok
bezprostředně před použitím, přidá se jedna kapka
koncentrované kyseliny chlorovodíkové nebo 0,4 g
disodné soli kyseliny ethylendiamintetraoctové (EDTA)
na 1 litr.
IV.I.6.3 Zásobní roztoky chemických látek
Pokud je rozpustnost vyšší než 1 g·l
-1
, rozpustí se
například 1 – 10 g (podle potřeby) zkušební nebo
referenční látky v deionizované vodě a doplní se na
1 litr. Jinak se zásobní roztoky připravují
v minerálním médiu, nebo se chemická látka přidá přímo
do minerálního média. Pokud jde o postup s méně
rozpustnými chemickými látkami, viz příloha III; ve
zkoušce MITI (metoda C.4-F) se nepoužívají ani
rozpouštědla, ani emulgační činidla.IV.I.6.4 Inokula
Inokulum lze získat z řady zdrojů: z aktivovaného kalu,
ze splaškových vod (nechlorovaných), z povrchových vod
a půd nebo z jejich směsi. Používáli se aktivovaný kal
ve zkoušce na úbytek DOC, na uvolňování CO
2
a ve
zkoušce manometrickou respirometrií, měl by být odebrán
z čistírny nebo z laboratorní jednotky čistící převážně
domovní odpadní vody. U inokulí z jiných zdrojů byl
zjištěn větší rozptyl výsledků. V modifikované
screeningové zkoušce OECD a ve zkoušce v uzavřených
lahvičkách je potřebné zředěnější inokulum bez vloček
kalu a nejvhodnějším zdrojem je voda z druhého stupně
čistírny domovních odpadních vod nebo z laboratorní
jednotky. Pro zkoušku MITI se inokulum získává ze směsi
zdrojů a je popsáno v oddílu věnovaném této zkoušce.IV.I.6.4.1 Inokulum z aktivovaných kalů
Odebere se čerstvý vzorek aktivovaného kalu z aerační
nádrže čistírny odpadních vod nebo laboratorní jednotky
čistící převážně domovní odpadní vody. Podle potřeby se
filtrací přes jemné síto odstraní hrubé částice a kal
se udržuje v aerobních podmínkách.
Jinou možností je usazení nebo odstředění (např. 10 min
při 1 100 g) po odstranění hrubých částic. Voda nad
usazeninou se odstraní. Kal se promyje minerálním
médiem. Koncentrovaný kal se suspenduje v minerálním
médiu na koncentraci 3 – 5 g suspendovaných tuhých
látek na litr a až do použití se provzdušňuje.
Kal by měl být odebrán z dobře fungující konvenční
čistírny. Je-li nutné odebrat kal z čistírny s vysokým
výkonem nebo předpokládáli se, že kal obsahuje
inhibitory, je třeba jej promýt. Po důkladném
promíchání se kal nechá usadit nebo se odstředí, voda
nad usazeninou se odstraní a promytý kal se opět
suspenduje v nové dávce minerálního média. Tento postup
se opakuje, dokud se kal nepovažuje za prostý
přebytečného substrátu nebo inhibitoru.
Po opakovaném suspendování nebo z neupravovaného kalu
se těsně před použitím odebere vzorek pro stanovení
hmotnosti sušiny suspendovaných tuhých látek.
Další možností je homogenizace aktivovaného kalu
(3 – 5 g suspendovaných látek v litru). Kal se 2 min
zpracovává v mechanickém mísiči při střední rychlosti.
Promíchaný kal se nechá 30 min, popřípadě déle,
usazovat a kapalina se dekantuje pro použití jako
inokulum v koncentraci 10 ml na litr minerálního média.
IV.I.6.4.2 Jiné zdroje inokula
Inokulum lze získat z výstupu z druhého stupně čistírny
odpadních vod nebo laboratorní jednotky zpracovávající
převážně domovní odpadní vody Odebere se čerstvý vzorek
a během přepravy se udržuje v aerobních podmínkách.
Nechá se 1 h usadit nebo se zfiltruje přes hrubý
filtrační papír a dekantovaná kapalina nebo filtrát se
až do použití udržuje v aerobních podmínkách. Na litr
média lze použít až 100 ml tohoto typu inokula.
Dalším zdrojem inokula je povrchová voda. V tomto
případě se odebere vzorek vhodné povrchové vody, např.
říční nebo jezerní vody, a uchovává se až do použití
v aerobních podmínkách. V případě potřeby se inokulum
zkoncentruje filtrací nebo odstředěním.
IV.I.6.5 Předběžná úprava inokulí
Inokula je možné předběžně upravit pro experimentální
podmínky, ale nikoli předběžně adaptovat na zkušební
látku. Předběžná úprava spočívá v aeraci aktivovaného
kalu v minerálním médiu nebo výstupu z druhého stupně
čistírny po dobu 5 – 7 dnů při zkušební teplotě.
Předběžná úprava někdy zlepší přesnost zkušebních metod
snížením hodnot ze slepých pokusů. Předběžná úprava
inokula pro zkoušku MITI se nepovažuje za nutnou.
IV.I.6.6 Abiotické kontroly
V případě potřeby se kontroluje možný abiotický rozklad
zkušební látky stanovením úbytku DOC, přijmu kyslíku
nebo uvolňování oxidu uhličitého ve sterilních
kontrolách bez inokula. Sterilizace se provádí filtrací
přes membránu (0,2 – 0,45 µm) nebo přidáním vhodné
toxické látky v odpovídající koncentraci. Používáli se
membránová filtrace, odebírají se vzorky asepticky, aby
byla zachována sterilita. Pokud nebyla předem vyloučena
adsorpce zkušební látky, měly by zkoušky, kterými se
sleduje biologický rozklad podle úbytku DOC, zejména
při použití inokula z aktivovaného kalu, zahrnovat
abiotickou kontrolu, která je inokulována a
intoxikována.
IV.I.6.7 Počet nasazených baněk
Počet nasazených baněk v typické zkoušce je uveden
v oddílech věnovaných jednotlivým zkouškám.
Mohou být použity tyto baňky:
Zkušební suspense: obsahující zkušební látku a inokulum
Slepá zkouška s inokulem: obsahující pouze inokulum
Kontrolní zkouška postupu: obsahující referenční látku
a inokulum
Abiotická sterilní kontrola: sterilní, obsahující
zkušební látku (viz I.6.6)
Kontrola adsorpce: obsahující zkušební látku, inokulum
a sterilizační činidlo
Kontrola toxicity: obsahující zkušební látku,
referenční látku a inokulum
Stanovení ve zkušební suspensi a slepý pokus s inokulem
musí být prováděny souběžně. Doporučuje se, aby
stanovení v ostatních baňkách bylo prováděno rovněž
souběžně.
To však nemusí být vždy možné. Je třeba zajistit, aby
se odebíral dostatečný počet vzorků nebo aby se
prováděl dostatečný počet odečtů pro vyhodnocení
procenta úbytku v 10denním období rozkladu.
IV.I.7 DATA A HODNOCENÍ
Při výpočtu rozkladu v procentech Dt, se použijí
střední hodnoty z měření parametru provedených
duplicitně v obou zkušebních nádobách a ze slepého
pokusu s inokulem. Vzorce jsou uvedeny dále v oddílech
pro jednotlivé zkoušky. Průběh rozkladu se znázorní
graficky a vyznačí se 10denní období rozkladu. Vypočte
se a uvede úbytek v procentech dosažený na konci
10denního období rozkladu a hodnota pro plató křivky
nebo popřípadě hodnota odpovídající konci zkoušky.
V respirometrických zkouškách mohou v důsledku
nitrifikace ovlivnit spotřebu kyslíku látky obsahující
dusík (viz přílohy II a V).
IV.I.7.1 Měření rozkladu prostřednictvím stanovení DOC
Za účelem posouzení platnosti zkoušky (viz I.5.2) by se
měla hodnota rozkladu Dt v procentech v každém časovém
okamžiku, ve kterém se odebral vzorek, vypočítat
odděleně pro každou baňku obsahující zkušební látku, a
to pomocí středních hodnot měření DOC provedených
duplicitně. Vypočte se podle následující rovnice:
+- -+
| Ct - Cbt |
Dt = 1 - | ----------| x 100
| C0 - Cb0 |
+- -+
kde
D
t
= rozklad v procentech v čase t, C
0
= střední počáteční koncentrace DOC v inokulovaném
kultivačním médiu obsahujícím zkušební látku
(v mg DOC na litr), C
t
= střední koncentrace DOC v inokulovaném kultivačním
médiu obsahujícím zkušební látku v čase t (v mg
DOC na litr), C
bo
= střední počáteční koncentrace DOC ve slepém
inokulovaném minerálním médiu (v mg DOC na litr), C
bt
= střední koncentrace DOC ve slepém inokulovaném
minerálním médiu v čase t (v mg DOC na litr). Všechny koncentrace se stanoví experimentálně.
IV.I.7.2 Rozklad měřený specifickou analýzou
Je-li možné získat specifické analytické údaje, vypočte
se primární biologický rozklad z rovnice:
Sb - Sa
Dt = --------- x 100
Sb
kde
D
t
= rozklad v procentech v čase t, obvykle po
28 dnech, S
a
= zbylé množství zkušební látky v médiu s inokulem
na konci zkoušky (mg), S
b
= zbylé množství zkušební látky ve slepém pokusu
s vodou/médiem, do kterých byla přidána pouze
zkušební látka (mg).IV.I.7.3 Abiotický rozklad
Použijeli se abiotická sterilní kontrola, vypočte se
abiotický rozklad v procentech podle rovnice:
Cs(0) - Cs(t)
abiotický rozklad v % = ---------------- x 100
Cs(0)
kde:
C
s(0)
= koncentrace DOC ve sterilní kontrole v den 0, C
s(t)
= koncentrace DOC ve sterilní kontrole v den t.IV.I.8 ZPRÁVY
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— zkušební a referenční chemické látky a jejich
čistota;
— zkušební podmínky;
— inokulum: charakter a místo (místa) odběru,
koncentrace a jakákoli předběžná úprava;
— podíl a charakter průmyslového odpadu obsaženého
v odpadní vodě, jsou-li známy;
— délka zkoušky a teplota;
— v případě špatně rozpustných zkušebních látek použitý
způsob zpracování;
— použitá zkušební metoda; měly by být uvedeny vědecké
důvody a vysvětlení pro veškeré změny postupu;
— přehled dat;
— veškeré pozorované projevy inhibice;
— jakýkoli pozorovaný abiotický rozklad;
— specifická analytická data o chemické látce, pokud
existují;
— analytická data o meziproduktech, pokud existují;
— graf závislosti rozkladu v procentech na čase pro
zkušební a referenční látku; je třeba zřetelně
označit fázi iniciace, fázi rozkladu, 10denní
období rozkladu a směrnici (příloha I).
Vyhovujeli zkouška kritériím jakosti, je možné
v grafu použít střední hodnotu rozkladu
v procentech v baňkách obsahujících zkušební
látku;
— rozklad v procentech po 10denním období rozkladu,
v oblasti plató a na konci zkoušky.
IVA. METODA PRO STANOVENí „SNADNÉ“ BIOLOGICKÉ ROZLOŽITELNOSTI
POMOCí ÚBYTKU ROZPUŠTĚNÉHO ORGANICKÉHO UHLÍKU (DOC) – METODA
C.4-A PODLE PříLOHY SMěRNICE 92/69/EHS
IVA.1 PODSTATA METODY
Odměřený objem inokulovaného minerálního média
obsahujícího známou koncentraci zkušební látky (10 –
40 mg DOC na litr) jako nominální jediný zdroj
organického uhlíku se provzdušňuje v temnu nebo
v difusním světle při 22 +/- 2 st.C.
Rozklad se sleduje v krátkých intervalech během
28denního období prostřednictvím analýzy DOC. Stupeň
biologického rozkladu se vypočte vyjádřením koncentrace
rozloženého DOC (opravené na koncentraci DOC ve slepé
zkoušce s inokulem) v procentech koncentrace, která
byla přítomna na začátku. Stupeň primárního
biologického rozkladu lze rovněž vypočítat z doplňkové
chemické analýzy provedené na začátku a na konci
kultivace.
IVA 2 POPIS METODY
IVA 2.1 Aparatura
a) Erlenmeyerovy baňky, např. 250 ml až 2 litry, podle
objemu potřebného pro analýzu DOC;
b) Třepačka upravená pro umístění Erlenmeyerových
baněk, buď s automatickou regulací teploty nebo
používaná v místnosti s konstantní teplotou, a
s dostatečným výkonem pro udržení aerobních
podmínek ve všech baňkách;
c) Filtrační aparatura s vhodnými membránami;
d) Analyzátor DOC;
e) Přístroj pro stanovení rozpuštěného kyslíku;
f) Odstředivka;
IVA 2.2 Příprava minerálního média
Příprava zásobních roztoků je popsána v bodě I.6.2.
Smísí se 10 ml roztoku a) s 800 ml ředicí vody, přidá
se po 1 ml roztoků b) až d) a doplní se ředicí vodou na
1 litr.
IVA 2.3 Příprava a předběžná úprava inokula
Inokulum lze získat z řady zdrojů: z aktivovaného kalu,
ze splaškových vod, z povrchových vod, z půd nebo
z jejich směsi.
Viz I.6.4, I.6.4.1, I.6.4.2 a I.6.5.
IVA 2.4 Příprava baněk
Do dvoulitrových Erlenmeyerových baněk se například
odměří 800 ml minerálního média a do jednotlivých baněk
se přidají dostatečná množství zásobních roztoků
zkušební a referenční látky tak, aby se získaly
koncentrace látky odpovídající 10 – 40 mg DOC na litr.
Zkontrolují se hodnoty pH a popřípadě se upraví na 7,4.
Baňky se inokulují aktivovaným kalem nebo jiným zdrojem
inokula (viz I.6.4), aby se získala výsledná
koncentrace nejvýše 30 mg suspendovaných látek na litr.
Připraví se rovněž kontroly s inokulem v minerálním
médiu, avšak bez zkušební nebo referenční látky.
Podle potřeby se použije jedna nádoba ke kontrole
možného inhibičního účinku zkušební látky inokulací
roztoku, který obsahuje srovnatelná množství jak
zkušební, tak referenční chemické látky v minerálním
médiu.
Podle potřeby se také použije další, sterilní baňka
s roztokem chemické látky bez inokula, a to ke
kontrole, zda se zkušební chemická látka rozkládá
abioticky (viz I.6.6).
Existujeli dále podezření, že se zkušební látka
významně adsorbuje na skle, kalu apod., provede se
předběžný odhad pravděpodobného rozsahu adsorpce, a
tedy vhodnosti zkoušky pro danou látku (viz tabulka 1).
Nasadí se baňka obsahující zkušební látku, inokulum a
sterilizační činidlo.
Obsah všech baněk se doplní minerálním médiem na 1 litr
a po promíchání se z každé baňky odebere vzorek pro
stanovení počáteční koncentrace DOC (viz příloha II,
bod 4). Ústí baněk se zakryjí např. hliníkovou fólií
tak, aby byla umožněna volná výměna vzduchu mezi
baňkami a okolní atmosférou. Baňky se poté umístí do
třepačky a zahájí se zkouška.
IVA 2.5 Počet baněk v typické zkoušce
Baňka 1 a 2: Zkušební suspense
Baňka 3 a 4: Slepá zkouška s inokulem
Baňka 5: Kontrolní zkouška postupu
Dále se doporučují nebo se podle potřeby použijí:
Baňka 6: Abiotická sterilní kontrola
Baňka 7: Kontrola adsorpce
Baňka 8: Kontrola toxicity
Viz také bod I.6.7.
IVA 2.6 Provedení zkoušky
Během zkoušky se ve známých časových intervalech
duplicitně stanovuje koncentrace DOC v každé baňce, a
to dostatečně často, aby bylo možné určit začátek
10denního období rozkladu a úbytek v procentech na
konci 10denního období rozkladu. Pro každé stanovení se
odebere pouze minimální nezbytné množství zkušební
suspense.
Před každým odběrem vzorků se podle potřeby nahradí
ztráty odpařováním z baněk přidáním potřebného množství
ředicí vody (1.6.1). Před odběrem vzorků se kultivační
médium dobře promíchá a zajistí se, aby látky ulpělé na
stěnách nádob přešly do roztoku nebo suspense. Vzorky
se ihned po odběru zfiltrují přes membránu nebo
odstředí (viz příloha II, bod 4). Zfiltrované nebo
odstředěné vzorky se analyzují týž den, v opačném
případě se uchovávají nejdéle 48 h při 2 – 4 st.C nebo
delší dobu při teplotě nižší než -18 st.C.
IVA 3 DATA A ZPRÁVY
IVA 3.1 Zpracování výsledků
Rozklad v procentech v čase t se vypočte podle bodu
I.7.1. (stanovení DOC) nebo podle bodu I.7.2
(specifická analýza).
Všechny výsledky se uvedou na příslušných formulářích
přehledu dat.
IVA 3.2 Platnost výsledků
Viz bod I.5.2.
IVA 3.3 Zprávy
Viz bod I.8.
IVA 4 PŘEHLED DAT
Dále je uveden příklad přehledu dat.
ZKOUŠKA NA ÚBYTEK DOC
1. LABORATOŘ
2. DATUM POČÁTKU ZKOUŠKY
3. ZKUŠEBNÍ LÁTKA
Název:
Koncentrace chemické látky v zásobním roztoku:
mg*l-1
Počáteční koncentrace chemické látky v médiu
v čase t0: mg*l-1
4. INOKULUM
Zdroj:
Provedená úprava:
Předběžná úprava, pokud byla provedena:
Koncentrace suspendovaných látek v reakční směsi:
mg*l1
5 STANOVENÍ UHLÍKU
------------------------------------------------------------
Analyzátor uhlíku:
Baňka DOC po n dnech
č. (mg*l-1)
------------------------------------------------------------
0 n1 n2 n3 nx
------------------------------------------------------------
Zkušební látka a 1 a1
inokulum
a2
a, střední
hodnota
Ca(t)
2 b1
b2
b, střední
hodnota
Cb(t)
------------------------------------------------------------
Slepá zkouška 3 c1
s inokulem bez
zkušební látky
c2
c, střední
hodnota
Cc(t)
4 d1
d2
d, střední
hodnota
Cd(t)
------------------------------------------------------------
Cc(t) + Cd(t)
Cbl(t) = ---------------
2
6. VYHODNOCENÍ NAMĚŘENÝCH DAT

Poznámka: Podobné formuláře lze použít pro referenční
chemickou látku a kontrolu toxicity.
7. ABIOTICKÁ KONTROLA (nepovinná)

8. SPECIFICKÁ CHEMICKÁ ANALÝZA (nepovinná)
---------------------------------------------------------------------
Zbylé množství Primární
zkušební rozklad
chemické látky v procentech
na konci
zkoušky (mg*l-1)
---------------------------------------------------------------------
Sterilní kontrola Sb
Sb - Sa
Inokulované zkušební médium Sa ----------- x 100
Sb
---------------------------------------------------------------------
IVB. METODA PRO STANOVENí „SNADNÉ“ BIOLOGICKÉ ROZLOŽITELNOSTI
POMOCí ÚBYTKU ROZPUŠTĚNÉHO ORGANICKÉHO UHLÍKU (DOC) -
MODIFIKOVANÁ SCREENINGOVÁ ZKOUŠKA OECD – METODA C.4-B PODLE
PříLOHY SMěRNICE 92/69/EHS
IVB.1 PODSTATA METODY
Odměřený objem minerálního média obsahujícího známou
koncentraci zkušební látky (10 – 40 mg DOC na litr)
jako jediný zdroj organického uhlíku se inokuluje
0,5 ml odpadní vody na litr média. Směs se provzdušňuje
v temnu nebo v difusním světle při 22 +/- 2 st.C.
Rozklad se sleduje v krátkých intervalech během
28denního období prostřednictvím analýzy DOC. Stupeň
biologického rozkladu se vypočte vyjádřením koncentrace
rozloženého DOC (opravené na koncentraci DOC ve slepé
zkoušce s inokulem) v procentech koncentrace, která
byla přítomna na začátku. Stupeň primárního
biologického rozkladu lze rovněž vypočítat z doplňkové
chemické analýzy provedené na začátku a na konci
inkubace.
IVB.2 POPIS METODY
IVB.2.1 Aparatura
a) Erlenmeyerovy baňky, např. 250 ml až 2 litry, podle
objemu potřebného pro analýzu DOC;
b) Třepačka pro umístění Erlenmeyerových baněk, buď
s automatickou regulací teploty nebo používaná
v místnosti s konstantní teplotou, a
s dostatečným výkonem pro udržení aerobních
podmínek ve všech baňkách;
c) Filtrační aparatura s vhodnými membránami;
d) Analyzátor DOC;
e) Přístroj pro stanovení rozpuštěného kyslíku;
f) Odstředivka.
IVB.2.2 Příprava minerálního média
Příprava zásobních roztoků je popsaná v bodě I.6.2.
Smísí se 10 ml roztoku a) s 800 ml ředicí vody, přidá
se po 1 ml roztoků b) až d) a doplní se ředicí vodou na
1 litr.
V této metodě se používá jako inokulum pouze 0,5 ml
odpadní vody na litr, a proto je nutné do média dodat
stopové prvky a růstové faktory. Toho se dosáhne
přidáním 1 ml každého z dále uvedených roztoků na jeden
litr výsledného média:
Roztok stopových prvků:
Síran manganatý tetrahydrát, MnSO4*4H2O 39,9 mg
Kyselina boritá, H3BO3 57,2 mg
Síran zinečnatý heptahydrát, ZnSO4*7H2O 42,8 mg
Heptamolybdenan hexaamonný, (NH4)6Mo7O24 34,7 mg
Chelát Fe (FeCl3 s kyselinou
ethylendiaminotetraoctovou) 100,0 mg
Rozpustí se v ředicí vodě a doplní se touto vodou na
1 000 ml.
Vitaminový roztok:
Kvasničný extrakt 15,0 mg
Kvasničný extrakt se rozpustí ve 100 ml vody.
Sterilizuje se průchodem membránou 0,2 µm, nebo se
připraví čerstvě.
IVB.2.3 Příprava a předběžná úprava inokula
Inokulum se získá z výstupu druhého stupně čistírny
nebo laboratorní jednotky zpracovávající převážně
domovní odpadní vody.
Viz I.6.4.2 a I 6.5.
Použije se 0,5 ml na litr minerálního média.
IVB.2.4 Příprava baněk
Do dvoulitrových Erlenmeyerových baněk se například
odměří 800 ml minerálního média a do jednotlivých baněk
se přidají dostatečná množství zásobních roztoků
zkušební a referenční látky tak, aby se získaly
koncentrace látky odpovídající 10 – 40 mg DOC na litr.
Zkontrolují se hodnoty pH a popřípadě se upraví na 7,4.
Baňky se inokulují odpadní vodou z druhého stupně
čištění odpadních vod (viz I.6.4.2) v objemu 0,5 ml na
litr. Připraví se rovněž slepé zkoušky s inokulem
v minerálním médiu, avšak bez zkušební nebo referenční
látky.
Podle potřeby se použije jedna nádoba ke kontrole
možného inhibičního účinku zkušební látky inokulací
roztoku, který obsahuje srovnatelná množství jak
zkušební, tak referenční chemické látky v minerálním
médiu.
Podle potřeby se také použije další, sterilní baňka
s roztokem chemické látky bez inokula, a to ke
kontrole, zda se zkušební chemická látka rozkládána
abioticky (viz I.6.6).
Existujeli dále podezření, že se zkušební látka
významně adsorbuje na skle, kalu apod., provede se
předběžný odhad pravděpodobného rozsahu adsorpce, a
tedy vhodnosti zkoušky pro danou látku (viz tabulka 1).
Nasadí se baňka obsahující zkušební látku, inokulum a
sterilizační činidlo.
Obsah všech baněk se doplní minerálním médiem na 1 litr
a po promíchání se z každé baňky odebere vzorek pro
stanovení počáteční koncentrace DOC (viz příloha II,
bod 4). Ústí baněk se zakryjí např. hliníkovou fólií
tak, aby byla umožněna volná výměna vzduchu mezi
baňkami a okolní atmosférou. Baňky se poté umístí do
třepačky a zahájí se zkouška.
IVB.2.5 Počet baněk v typické zkoušce
Baňka 1 a 2: Zkušební suspense
Baňka 3 a 4: Slepá zkouška s inokulem
Baňka 5: Kontrolní zkouška postupu
Dále se doporučují se nebo se podle potřeby použijí:
Baňka 6: Abiotická sterilní kontrola
Baňka 7: Kontrola adsorpce
Baňka 8: Kontrola toxicity
Viz také bod I.6.7.
IVB.2.6 Provedení zkoušky
Během zkoušky se ve známých časových intervalech
duplicitně stanovuje koncentrace DOC v každé baňce, a
to dostatečně často, aby bylo možné určit začátek
10denního období rozkladu a úbytek v procentech na
konci 10denního období rozkladu. Pro každé stanovení se
odebere pouze minimální nezbytné množství zkušební
suspense.
Před odběrem vzorků se podle potřeby nahradí ztráty
odpařováním z baněk přidáním potřebného množství ředicí
vody (1.6.1). Před odběrem vzorků se kultivační médium
dobře promíchá a zajistí se, aby látky ulpělé na
stěnách nádob přešly do roztoku nebo suspense. Vzorky
se ihned po odběru zfiltrují přes membránu nebo
odstředí (viz příloha II, odst. 4). Zfiltrované resp.
odstředěné vzorky se analyzují týž den, v opačném
případě se uchovávají nejdéle 48 h při 2 – 4 st.C nebo
delší dobu při teplotě nižší než
-1
8 st.C.IVB.3 DATA A ZPRÁVY
IVB.3.1 Zpracování výsledků
Rozklad v procentech v čase t se vypočte podle bodu
I.7.1. (stanovení DOC) nebo podle bodu I.7.2
(specifická analýza).
Všechny výsledky se uvedou na příslušných formulářích
přehledů dat.
IVB.3.2 Platnost výsledků
Viz bod I.5.2.
IVB.3.3 Zprávy
Viz bod I.8.
IVB.4 PŘEHLED DAT
Dále je uveden příklad přehledu dat.
MODIFIKOVANÁ SCREENINGOVÁ ZKOUŠKA OECD
1. LABORATOŘ
2. DATUM POČÁTKU ZKOUŠKY
3. ZKUŠEBNÍ LÁTKA
Název:
Koncentrace chemické látky v zásobním roztoku:
mg*l-1
Počáteční koncentrace chemické látky v médiu
v čase t0: mg*l-1
4. INOKULUM
Zdroj:
Provedená úprava:
Předběžná úprava, pokud byla provedena:
Koncentrace suspendovaných látek v reakční směsi:
mg*l1
5 STANOVENÍ UHLÍKU
-----------------------------------------------------------
Analyzátor uhlíku:
Baňka DOC po n dnech
č. (mg*l-1)
-----------------------------------------------------------
0 n1 n2 n3 nx
Zkušební látka a 1 a1
inokulum
a2
a, střední
hodnota
Ca(t)
2 b1
b2
b, střední
hodnota
Cb(t)
-----------------------------------------------------------
Slepá zkouška 3 c1
s inokulem bez
zkušební látky
c2
c, střední
hodnota
Cc(t)
4 d1
d2
d, střední
hodnota
Cd(t)
-----------------------------------------------------------
Cc(t) + Cd(t)
Cbl(t) = ---------------
2
6. VYHODNOCENÍ NAMĚŘENÝCH DAT
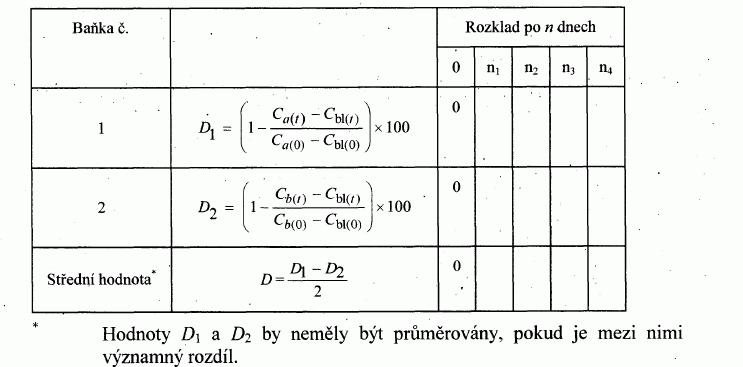
Poznámka: Podobné formuláře lze použít pro referenční
chemickou látku a kontrolu toxicity.
7. ABIOTICKÁ KONTROLA (nepovinná)
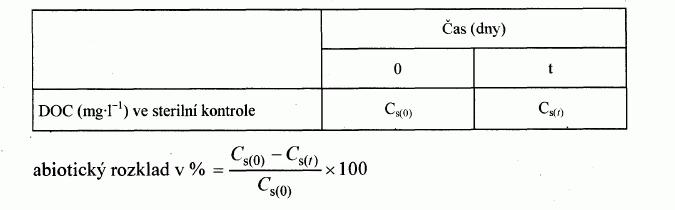
8. SPECIFICKÁ CHEMICKÁ ANALÝZA (nepovinná)
---------------------------------------------------------------------
Zbylé množství Primární
zkušební rozklad
chemické látky v procentech
na konci
zkoušky (mg*l-1)
---------------------------------------------------------------------
Sterilní kontrola Sb
Sb - Sa
Inokulované zkušební médium Sa ----------- x 100
Sb
---------------------------------------------------------------------
IVC. METODA PRO STANOVENÍ „SNADNÉ“ BIOLOGICKÉ ROZLOŽITELNOSTI
POMOCÍ UVOLŇOVÁNÍ OXIDU UHLIČITÉHO (CO
2
) – MODIFIKOVANÁ
STURMOVA ZKOUŠKA – METODA C.4-C PODLE PŘÍLOHY SMĚRNICE
92/69/EHSIVC.1 PODSTATA METODY
Odměřený objem inokulovaného minerálního média
obsahující známou koncentraci zkušební látky
(10 – 20 mg DOC nebo TOC na litr), která je jediným
zdrojem uhlíku, se provzdušňuje v temnu nebo v difusním
světle regulovaným proudem vzduchu bez CO
2
. Rozklad se
sleduje po dobu 28 dnů prostřednictvím vznikajícího CO2
jímaného v roztoku hydroxidu barnatého nebo sodného,
kde se stanoví titrací zbytkového hydroxidu nebo jako
anorganický uhlík. Množství CO2
vzniklého ze zkušební
látky (po korekci na CO2
pocházející z čistého inokula)
se vyjádří v procentech TCO2
. Stupeň biologického
rozkladu může být také vypočten z doplňkového stanovení
DOC na začátku a na konci inkubace.IVC.2 POPIS METODY
IVC.2.1 Přístroje
a) Baňky na 2 – 5 l vybavené provzdušňovací trubicí
dosahující až ke dnu nádoby a výstupním otvorem;
b) Magnetické míchačky pro zkoušení špatně rozpustných
látek;
c) Absorpční lahv;
d) Zařízení pro regulaci a měření průtoku vzduchu;
e) Zařízení pro odstraňování CO
2
při přípravě vzduchu
bez CO2
, popřípadě může být použita směs kyslíku
bez CO2
a dusíku bez CO2
ve správném poměru (20 %
O2
a 80 % N2) z lahví se stlačenými plyny; f) Zařízení na stanovení CO
2
buď titračně nebo pomocí
analyzátoru anorganického uhlíku; g) Zařízení pro membránovou filtraci (podle volby);
h) Analyzátor DOC (podle volby).
IVC.2.2 Příprava minerálního média
Příprava zásobních roztoků je popsána v části I.6.2.
Smísí se 10 ml roztoku a) s 800 ml ředicí vody, přidá
se po 1 ml roztoků b) až d) a doplní se ředicí vodou na
1 litr.
IVC.2.3 Příprava a předběžná úprava inokula
Inokulum lze získat z řady zdrojů: z aktivovaného kalu,
ze splaškových vod, z povrchových vod, z půd nebo
z jejich směsi.
Viz I.6.4, I.6.4.1, I.6.4.2 a I.6.5.
IVC.2.4 Příprava baněk
Jako příklad jsou uvedeny hodnoty pro baňky na 5 litrů
obsahující 3 litry suspense. V případě použití menších
objemů se hodnoty úměrně upraví, musí být ovšem
zajištěno, aby bylo možné přesně měřit vznikající CO
2
.
Do každé baňky na 5 litrů se přenese 2 400 ml
minerálního média. Přidá se vhodné množství
připraveného inokula (viz I.6.4.1 a I.65), aby
koncentrace suspendovaných látek v konečném objemu 3 l
inokulované směsi byla 30 mg*l-1
. Eventuálně lze
nejdříve zředit připravený kal v minerálním médiu na
suspensi o koncentraci 500 – 1 000 mg*l-1
a poté přidat
alikvotní části do baňky na 5 litrů, aby byla dosažena
koncentrace 30 mg*l-1
; zajistí se tím větší přesnost.
Mohou být použity i jiné zdroje inokula (viz I.6.4.2).
Inokulovaná směs se přes noc provzdušňuje vzduchem bez
CO2
, aby se ze systému odstranil oxid uhličitý. Odděleně do dvojic baněk se ze zásobních roztoků přidá
zkušební látka a referenční látka tak, aby koncentrace
pocházející z chemických látek byla v rozmezí 10 až
20 mg DOC nebo TOC na litr; některé lahve se nasadí
jako kontrola inokula bez přidání chemických látek.
Špatně rozpustné látky se odváží nebo odměří přímo do
baněk, nebo se postupuje podle přílohy III.
Podle potřeby se jedna baňka použije ke kontrole
možného inhibičního účinku zkušební látky, a to
přidáním zkušební i referenční látky ve stejných
koncentracích jako v ostatních baňkách.
Podle potřeby se další baňka použije k ověření, zda se
zkušební látka nerozkládá abioticky, přičemž se použije
roztok chemické látky bez inokula (viz I.6.6).
Sterilizace se provádí přidáním vhodné koncentrace
toxické látky.
Podle potřeby se další baňka použije k ověření, zda se
zkušební látka nerozkládá abioticky, přičemž se použije
roztok chemické látky bez inokula (viz I.6.6).
Sterilizace se provádí přidáním vhodné koncentrace
toxické látky. Ve všech baňkách se upraví objem na 3 1 přídavkem
minerálního média bez CO
2
. Podle potřeby lze odebrat
vzorky pro stanovení DOC (viz příloha II, bod 4) a/nebo
pro specifickou analýzu. Poté se na výstup plynů u
baněk připojí absorpční lahve. V případě použití hydroxidu barnatého se za každou
baňku na 5 litrů zařadí tři absorpční lahve, každá
obsahující 100 ml roztoku Ba(OH)
2
o koncentraci
0,0125 mol*l-1
. Roztok nesmí obsahovat sraženinu síranů
a uhličitanu barnatého a jeho koncentrace musí být
stanovena bezprostředně před použitím. Jeli použit
hydroxid sodný, spojí se 2 absorpční lahve, z nichž
druhá slouží jako kontrola, že byl veškerý CO2
zachycen
v první absorpční lahvi. K tomuto účelu se hodí
absorpční lahve opatřené sérovými uzávěry. Do každé
absorpční lahve se přidá po 200 ml roztoku NaOH o
koncentraci 0,05 mol*l-1
, což postačuje k absorpci
veškerého oxidu uhličitého, který by se uvolnil při
úplném rozkladu látky. Roztok hydroxidu sodného, i když
je čerstvě připraven, obsahuje stopy uhličitanů;
korekce se provede odečtením množství uhličitanů ve
slepém pokusu.IVC.2.5 Počet baněk v typické zkoušce
Baňka 1 a 2: Zkušební suspense
Baňka 3 a 4: Slepá zkouška s inokulem
Baňka 5: Kontrolní zkouška postupu
Dále se doporučují se nebo se podle potřeby použijí:
Baňka 6: Abiotická sterilní kontrola
Baňka 7: Kontrola toxicity
Viz také bod I.6.7.
IVC.2.6 Provedení zkoušky
Zkouška se zahájí probubláváním vzduchu bez CO
2
suspensí při průtoku 30 – 100 ml*min-1
. Za účelem
analýzy obsahu CO2
se pravidelně odebírají vzorky
absorbentu. Doporučuje se, aby se v průběhu prvních
10 dnů prováděly analýzy každý druhý až třetí den a
dále pak každý pátý den až do 28. dne, což umožní
rozpoznat období 10denního období rozkladu. 28. den se (nepovinně) odebere vzorek pro stanovení DOC
a/nebo pro specifickou analýzu, změří se pH suspensí a
poté se do každé baňky přidá 1 ml koncentrované HCl;
provzdušňuje se přes noc, aby se odstranil CO
2
přítomný
v suspensi. Poslední analýza uvolněného CO2
se provede
29. den. Ve dnech, kdy se provádí stanovení CO
2
, se odpojí
absorpční lahev s hydroxidem barnatým bližší zkušební
baňce a roztok hydroxidu barnatého se titruje 0,05M HCl
za přítomnosti fenolftaleinu jako indikátoru. Zbývající
dvě absorpční lahve se posunou k baňce a na konec řady
se zařadí nová absorpční lahev se 100 ml čerstvě
připraveného 0,0125M hydroxidu barnatého. Titrace se
provádějí podle potřeby, např. jeli pozorována v první
absorpční lahvi zřetelná sraženina a před tím, než
vznikne viditelná sraženina ve druhé absorpční lahvi,
nebo alespoň jednou týdně. Jinou možností je provést
při použití NaOH jako absorbentu odběr malého vzorku
hydroxidu sodného pomocí injekční stříkačky (podle
použitého analyzátoru uhlíku) z absorpční lahve, která
je nejblíže k baňce. Vzorek se nastříkne přímo do IC-
části analyzátoru uhlíku pro analýzu anorganického
uhlíku. Obsah druhé absorpční lahve se analyzuje pouze na konci
zkoušky s cílem stanovit korekci na možný únik CO
2
.IVC.3 DATA A ZPRÁVY
IVC.3.1 Zpracování výsledků
Množství CO
2
zachyceného v absorpční lahvi je v případě
titračního stanovení dáno vztahem: mg CO
2
= (100 × CB
- 0,5 × V × CA
) × 44kde
V = objem HCl spotřebovaný při titraci 100 ml obsahu
absorpční lahve (ml),
C
B
= koncentrace roztoku hydroxidu barnatého (mol*l-l
), C
A
= koncentrace roztoku kyseliny chlorovodíkové
(mol*l-l
). Jeli CL 0,0125 mol·ll a C
A
0,05 mol*ll, je spotřeba
pro titraci 100 ml roztoku Ba(OH)2
50 ml a hmotnost CO2
je dána vztahem:
0,05
---- x 44 x počet ml HCl spotřebované při titraci = 1,1 x ml HCl
2
V tomto případě se tedy k přepočtu objemu HCl
spotřebovaného při titraci na hmotnost vzniklého CO
2
použije faktor 1,1. S použitím příslušných výsledků titrace se vypočte
hmotnost CO
2
vzniklého ze samotného inokula a inokula
se zkušební látkou a jejich rozdíl je hmotnost CO2
vzniklého ze samotné zkušební látky.Jeli např. výsledkem titrace samotného inokula 48 ml a
inokula se zkušební látkou 45 ml, je množství
CO
2
z inokula = 1,1 × (50 - 48) = 2,2 mg, CO
2
z inokula a zkušební látky = 1,1 × (50 - 45)=
5,5 mg, a tedy hmotnost CO
2
vzniklého ze zkušební látky 3,3 mg. Biologický rozklad v procentech se vypočte podle
vztahu:
vzniklý CO2 v mg x 100
rozklad v procentech = --------------------------------------------
TCO2 x přidaná zkušební látka v mg
nebo
vzniklý CO2 v mg x 100
rozklad v procentech = --------------------------------------------
TCO2 přidaný ve zkoušce v mg x 3,67
přičemž 3,67 je převodní faktor (44/12) pro uhlík a
oxid uhličitý.
Rozklad v procentech se po každém období vypočte
dosazením hodnoty TCO
2
vypočítané pro každý den až do
doby, kdy byl měřen. Při zachytávání do NaOH se vypočte hmotnost vzniklého
CO
2
, vyjádřeného jako anorganický uhlík v mg,
vynásobením koncentrace anorganického uhlíku
v absorpční lahvi objemem absorpčního roztoku. Rozklad v procentech se vypočte podle vztahu:
anorg. C ze zkušeb. baňky v mg - anorg. C × 100 ze slep. pokusu v mg TCO2v % = --------------------------------------------------------------------------- TOC přidaný jako zkušební látka v mg
Úbytky DOC se (nepovinně) vypočítají podle bodu I.7.
Tento výsledek spolu s ostatními výsledky se
zaznamenají do příslušného formuláře přehledu dat.
IVC.3.2 Platnost výsledků
Obsah anorganického uhlíku ve zkušební suspensi
v minerálním médiu na začátku zkoušky musí být menší
než 5 % TC a celkové množství CO
2
vzniklé na konci
slepé zkoušky s inokulem nesmí za normálních okolností
překročit 40 mg na litr média. Jsouli hodnoty větší
než 70 mg CO2
na litr, měla by být data i
experimentální postup kriticky přehodnoceny. Viz také I.5.2.
IVC.3.3 Zprávy
Viz I. 8.
IVC.4 PŘEHLED DAT
Dále je uveden příklad přehledu dat:
ZKOUŠKA NA UVOLŇOVÁNÍ OXIDU UHLIČITÉHO
1. LABORATOŘ
2. DATUM ZAHÁJENÍ ZKOUŠKY
3. ZKUŠEBNÍ LÁTKA
Název:
Koncentrace chemické látky v zásobním roztoku:
mg*l-1
Počáteční koncentrace chemické látky v médiu:
mg*l-1
Celkové množství uhlíku přidaného do baňky: mg C
TCO2: mg CO2
4. INOKULUM
Zdroj:
Provedená úprava:
Předběžná úprava, pokud byla provedena:
Koncentrace suspendovaných látek v reakční směsi:
mg*l1
5. TVORBA OXIDU UHLIČITÉHO A ROZLOŽITELNOST
Metoda: Ba(OH)2 / NaOH / jiná
------------------------------------------------------------------------
Čas CO2 CO2 Celkové množství TCO2
(dny) uvolněný uvolněný CO2 (průměr ve
ve zkoušce ve slepé zkoušce minus kumulativní CO2
(mg) zkoušce průměr ve slepé --------------- x100
(mg) zkoušce) (mg) TCO2
-------------------------------------------------------------------------
1 2 průměr 3 4 průměr 1 2 1 2 průměr
0
n1
n2
n3
------------------------------------------------------------------------
28
------------------------------------------------------------------------
Poznámka: podobný formulář lze použít i pro referenční
látku a pro kontroly toxicity.
6. ANALÝZA UHLÍKU (podle volby)
Analyzátor uhlíku:
------------------------------------------------------
Čas (dny) Slepý pokus Zkušební látka
(mg*l-1) (mg*l-1)
0 Cb(0) C0
28* Cb(t) Ct
------------------------------------------------------
* nebo na konci kultivace
Ct - Cb(t)
odstraněný DOC v % = 1 - ------------------ x 100
C0 - Cb(0)
7. ABIOTICKÝ ROZKLAD (nepovinné)
tvorba CO2 ve steril. podm. po 28 dnech v mg
abiotický rozklad v % = -------------------------------------------- x 100
TCO2
IVD. METODA PRO STANOVENí „SNADNÉ“ BIOLOGICKÉ ROZLOŽITELNOSTI
MANOMETRICKOU RESPIROMETRIÍ C.4D PODLE PŘÍLOHY SMĚRNICE
92/69/EHS
IVD.1 PODSTATA METODY
Odměřený objem inokulovaného minerálního média
obsahující známou koncentraci zkušební chemické látky
(100 mg zkušební látky na litr, dávající nejméně
50 – 100 mg TSK na litr), která je jediným zdrojem
organického uhlíku, se míchá v uzavřené nádobě při
konstantní teplotě (tolerance +/-1 st.C nebo menší) na
dobu 28 dnů. Spotřeba kyslíku se stanoví buď měřením
množství kyslíku (elektrolyticky produkovaného), který
je potřebný k udržení konstantního objemu plynu
v respirační nádobce, nebo ze změn objemu nebo tlaku
(nebo obojího) v aparatuře. Uvolněný CO
2
se jímá
v roztoku hydroxidu draselného nebo v jiném vhodném
absorbentu. Množství kyslíku, které je zkoušenou látkou
spotřebováno (korigované na spotřebu kyslíku inokulem
ve slepé zkoušce, která se provádí současně), se
vyjádří v procentech TSK nebo CHSK. Popřípadě může být
z doplňkové specifické chemické analýzy provedené na
začátku a na konci kultivace vypočten primární
biologický rozklad a z analýzy DOC úplný biologický
rozklad.IVD.2 POPIS METODY
IVD.2.1 Přístroje
a) vhodný respirometr;
b) regulátor teploty s přesností na +/-1 st.C nebo lepší;
c) zařízení pro membránovou filtraci (nepovinné);
d) analyzátor uhlíku (nepovinné).
IVD.2.2 Příprava minerálního média
Příprava zásobních roztoků je popsána v části I.6.2.
Smísí se 10 ml roztoku a) s 800 ml ředicí vody, přidá
se po 1 ml roztoků b) až d) a doplní se ředicí vodou na
1 litr.
IVD.2.3 Příprava a předběžná úprava inokula
Inokulum lze získat z řady zdrojů: z aktivovaného kalu,
ze splaškových vod, z povrchových vod, z půd nebo
z jejich směsi.
Viz I.6.4, I.6.4.1, I.6.4.2 a I.6.5.
IVD.2.4 Příprava baněk
S použitím zásobních roztoků se připraví samostatné
sady roztoků zkušební chemické látky a referenční
chemické látky v minerálním médiu o koncentraci
odpovídající obvykle 100 mg chemické látky na litr
(dávající nejméně 50 – 100 mg TSK na litr).
TSK se vypočte z tvorby amoniových solí, pokud lze
vyloučit nitrifikaci, v opačném případě by měl být
výpočet založen na tvorbě dusičnanů (viz příloha II,
bod 2).
Změří se pH a v případě potřeby se upraví na 7,4 +/-
0,2.
Špatně rozpustné látky se přidají v pozdějším stádiu
(viz dále).
Má-li se stanovit toxicita zkušební látky, připraví se
další roztok v minerálním médiu, jenž obsahuje
referenční i zkušební látku, a to ve stejných
koncentracích jako v roztocích obsahujících jen jednu
látku.
Požadujeli se stanovení fyzikálněchemické spotřeby
kyslíku, připraví se roztok zkušební látky obvykle o
koncentraci 100 mg TSK na litr sterilizovaný přídavkem
vhodné toxické látky (viz I.6.6).
Připravené objemy roztoků zkušební a referenční
chemické látky se rozdělí alespoň duplicitně do baněk.
Do dalších baněk se přidá pouze minerální médium (pro
kontrolu inokula) a podle potřeby směs roztoku zkušební
a referenční chemické látky a sterilní roztok.
Jeli zkušební chemická látka špatně rozpustná, odváží
se nebo odměří v tomto stádiu přímo do baněk, nebo se
postupuje podle přílohy III. Do lahví pro absorpci CO
2
se přidá hydroxid draselný, pelety hydroxidu sodného
nebo jiný absorbent.IVD.2.5 Počet baněk v typické zkoušce
Baňka 1 a 2: Zkušební suspense
Baňka 3 a 4: Slepá zkouška s inokulem
Baňka 5: Kontrolní zkouška postupu
Dále se doporučují se nebo se podle potřeby použijí:
Baňka 6: Sterilní kontrola
Baňka 7: Kontrola toxicity
Viz také bod I.6.7.
IVD.2.6 Provedení zkoušky
V baňkách se nechá ustavit požadovaná teplota a vybrané
baňky se inokulují přidáním aktivovaného kalu nebo
jiného zdroje inokula, aby nebyla koncentrace
suspendovaných látek větší než 30 mg·l
-1
. Zařízení se
sestaví, spustí se míchačka, přezkouší se na
vzduchotěsnost a zahájí se měření spotřeby kyslíku.
Obvykle není třeba věnovat zkoušce žádnou zvláštní
pozornost, kromě nezbytných odečtů a denní kontroly
teploty a míchání. Z pravidelných častých odečtů se podle postupu
uvedeného výrobcem zařízení vypočte spotřeba kyslíku.
Na konci inkubace, obvykle po 28 dnech, se změří pH
v baňkách, a to zvláště tehdy, jeli spotřeba kyslíku
malá nebo větší než TSK
NH4
(platí pro látky obsahující
dusík). V případě potřeby se na začátku a na konci odebírá
vzorek z respiračních nádobek pro stanovení DOC nebo
pro specifickou analýzu (viz příloha II, bod 4). Při
počátečním odběru z baňky se zajistí, aby byl znám
objem zkušební suspense, která v baňce zůstala. Jeli
kyslík spotřebováván látkami obsahujícími dusík,
stanoví se přírůstek koncentrací dusičnanů a dusitanů
za 28 dnů a vypočte se korekce na spotřebu kyslíku
nitrifikací (příloha V).
IVD.3 DATA A ZPRÁVY
IVD.3.1 Zpracování výsledků
Spotřeba kyslíku (mg) zkušební látkou za danou dobu
(korigovaná na spotřebu kyslíku inokulem za stejnou
dobu ve slepé zkoušce) se podělí hmotností zkušební
látky v baňce. Získá se tak hodnota BSK vyjádřená v mg
kyslíku na mg zkušební látky:
spotř. O2 zk. chem. látkou v mg - spotř. O2 ve slep. zkoušce v mg
BSK = ------------------------------------------------------------------
hmotnost zkušební chem. látky v baňce v mg
= mg O2 na mg zkušební chemické látky.
Biologický rozklad v procentech se vypočte buď
z rovnice:
BSK (mg O2 na mg chem. látky)
biolog. rozklad v % = % TSK = ------------------------------ x 100
TSK (mg O2 na mg chem. látky)
nebo z rovnice:
BSK (mg O2 na mg chem. látky)
% COD = ------------------------------ x 100.
COD (mg O2 na mg chem. látky)
Je třeba poznamenat, že tyto dvě metody nemusí
poskytovat stejné hodnoty; přednost se dává první
metodě.
Pro látky, jež obsahují dusík, se použije vhodná
hodnota TSK (pro NH
4
nebo NO3
) podle toho, zda se
očekává nitrifikace, či nikoli (příloha II, bod 2). Jestliže k nitrifikaci dochází, avšak není úplná,
vypočte se korekce na spotřebu kyslíku při nitrifikaci
ze změn koncentrace dusitanů a dusičnanů (příloha V).
V případě, že se provádí nepovinné stanovení
organického uhlíku a/nebo specifické chemické látky,
vypočte se stupeň rozkladu podle bodu I.7.
Všechny výsledky se zaznamenají do příslušného
formuláře přehledu dat.
IVD.3.2 Platnost výsledků
Obvyklá spotřeba kyslíku inokulem je 20 – 30 mg O
2
na
litr a neměla by být větší než 60 mg*l-1
za 28 dnů.
Hodnoty větší než 60 mg*l-1
vyžadují kritické
přehodnocení výsledků a experimentální techniky. Jeli
pH mimo rozpětí 6 – 8,5 a spotřeba kyslíku zkušební
látkou je menší než 60 %, měla by být zkouška opakována
s nižší koncentrací zkušební látky. Viz také I.5.2.
IVD.3.3 Zprávy
Viz I.8.
IVD.4 PŘEHLED DAT
Dále je uveden příklad přehledu dat:
ZKOUŠKA MANOMETRICKOU RESPIROMETRIÍ
1. LABORATOŘ
2. DATUM ZAHÁJENÍ ZKOUŠKY
3. ZKUŠEBNÍ LÁTKA
Název:
Koncentrace zásobního roztoku: mg*l-1
Počáteční koncentrace v médiu, C0: mg*l-1
Objem zkušební baňky (V): ml
TSK nebo CHSK: v mg O2 na mg zkušební látky (NH4,
NO3):
4. INOKULUM
Zdroj:
Provedená úprava:
Předběžná úprava, pokud byla provedena:
Koncentrace suspendovaných látek v reakční směsi:
mg*l1
5. SPOTŘEBA KYSLÍKU: BIOLOGICKÁ ROZLOŽITELNOST
-----------------------------------------------------------------
Čas (dny)
0 7 14 21 28
-----------------------------------------------------------------
Spotřeba O2 1
(mg)
zkušební
látkou
2
a,průměr
-----------------------------------------------------------------
Spotřeba O2 3
(mg) ve
slepé
zkoušce
4
b,průměr
-----------------------------------------------------------------
Korigovaná (a1 -bm)
BSK (mg)
(a2 -bm)
-----------------------------------------------------------------
BSK na mg
zkušební
látky
-----------------------------------------------------------------
Rozklad v % D1
(a1)
BSK D2
--- x 100 (a2)
TSK Průměr*
-----------------------------------------------------------------
V = objem média ve zkušební baňce
* Hodnoty D1 a D2 by neměly být průměrovány, jeli mezi
nimi výrazný rozdíl.
Poznámka: Podobný formulář lze použít i pro referenční
látku a pro kontroly toxicity.
6. KOREKCE NA NITRIFIKACI (viz příloha V)
-----------------------------------------------------------------------------
Den 0 28 Rozdíl
i) Koncentrace dusičnanů (mg N na litr) (N)
ii) Kyslíkový ekvivalent (4,57 × N × V) (mg) — —
iii) Koncentrace dusitanů (mg N na litr) (N)
iv) Kyslíkový ekvivalent (3,43 × N × V) (mg) — —
ii + iv) Celkový kyslíkový ekvivalent — —
-----------------------------------------------------------------------------
7. ANALÝZA UHLÍKU (podle volby)
Analyzátor uhlíku:
-----------------------------------------------
Čas (dny) Slepá zkouška Zkušební látka
(mg*l-1) (mg*l-1)
-----------------------------------------------
0 (Cbl(0)) (C0)
28* (Cbl(t)) (Ct)
-----------------------------------------------
* nebo na konci inkubace
8. SPECIFICKÁ ANALÝZA (nepovinné)
Sb = koncentrace ve fyzikálněchemické kontrole
(sterilní) po 28 dnech,
Sa = koncentrace v inokulované baňce po 28 dnech.
9. ABIOTICKÝ ROZKLAD (nepovinné)
a = spotřeba kyslíku ve sterilních baňkách po
28 dnech v mg,
a
spotřeba kyslíku na mg zkušební chemické látky = -------
C0V
(viz oddíl 1 a 3)
a x 100
abiotický rozklad v % = ----------------------.
C0V x TSK
IVE. METODA PRO STANOVENí „SNADNÉ“ BIOLOGICKÉ ROZLOŽITELNOSTI
POMOCÍ ZKOUŠKY V UZAVŘENÝCH LAHVIČKÁCH – METODA C.4-E PODLE
PŘÍLOHY SMĚRNICE 92/69/EHS
IVE.1. PODSTATA ZKUŠEBNÍ METODY
Roztok zkušební látky v minerálním médiu, obvykle o
koncentraci 2 až 5 mg·l
-1
, se inokuluje malým množstvím
mikroorganismů ze směsné kultury a udržuje se ve zcela
naplněných uzavřených lahvičkách, v temnu a při
konstantní teplotě. Rozklad se sleduje po dobu 28 dnů
prostřednictvím analýzy rozpuštěného kyslíku. Množství
spotřebovaného kyslíku po korekci na souběžnou slepou
zkoušku s inokulem se vyjádří jako TSK nebo CHSK.IVE.2 POPIS METODY
IVE.2.1 Přístroje a pomůcky
a) Lahve pro analýzu BSK se skleněnými zátkami, např.
na 250 – 300 ml.
b) Vodní lázeň nebo inkubátor pro udržování lahviček
při konstantní teplotě (tolerance +/-1 st.C nebo
menší) v temnu.
c) Velké skleněné lahve na 2 – 5 1 pro přípravu média a
pro naplnění lahviček pro analýzu BSK.
d) Kyslíková elektroda a oxymetr nebo vybavení a
činidla pro Winklerovu titrační metodu.
IVE.2.2 Příprava minerálního média
Příprava zásobních roztoků je popsána v části I.6.2.
Smísí se po 1 ml roztoků a) až d) a doplní se vodou na
1 litr.
IVE.2.3 Příprava inokula
Inokulum se obvykle získává z výstupu z druhého stupně
čistírny odpadních vod nebo laboratorní jednotky
zpracovávající převážně domovní odpadní vody.
Alternativním zdrojem inokula může být povrchová voda.
Obvykle se použije jedna kapka (0,05 ml) až 5 ml
filtrátu na litr média; k nalezení optimálního objemu
dané odpadní vody může být nezbytné provést pokusy (viz
I.6.4.2 a I.6.5).
IVE.2.4 Příprava lahviček
Minerální médium se alespoň 20 min silně provzdušňuje.
Všechny série zkoušek se provedou s minerálním médiem
ze stejné dávky. Obecně je médium připraveno k použití
po 20 h stání při zkušební teplotě. Pro kontrolu se
stanoví obsah kyslíku v médiu; jeho obsah by měl být
asi 9 mg·l
-1
při 20 st.C. Všechny operace přenosu média
nasyceného vzduchem a jeho plnění se provedou tak, aby
nevznikaly bublinky, např. pomocí nasávaček.
Připravují se shodné skupiny lahviček pro analýzu BSK
pro stanovení se zkušební látkou a referenční látkou
v souběžných sériích experimentů. Připraví se
dostatečný počet lahviček, včetně slepých pokusů, tak,
aby v každém zvoleném časovém intervalu, např. 0, 7,
14, 21 a 28 dnů, bylo možné provést alespoň dvě měření
spotřeby kyslíku. K tomu, aby bylo možné rozpoznat
10denní období rozkladu, může být potřeba více
lahviček.Velké lahve se přibližně do jedné třetiny naplní
provzdušněným médiem. Poté se zvlášť do jednotlivých
velkých lahví přidá dostatečný objem zásobního roztoku
zkušební látky a referenční látky, a to obvykle tak,
aby nebyla konečná koncentrace chemických látek větší
než 10 mg·l-1. Ke slepému pokusu v další velké lahvi se
nepřidávají žádné chemické látky.
S cílem zajistit, aby aktivita inokula nebyla omezená,
nesmí koncentrace kyslíku v lahvičkách pro analýzu BSK
klesnout pod 0,5 mg·l
-1
. Toto omezuje koncentraci
zkušební látky na 2 mg*l-1. Pro látky, které se špatně
rozkládají, a pro látky s nízkou hodnotou TSK lze
použít koncentraci 5 - 10 mg*l-1
. V některých případech
se doporučuje provést souběžné série měření při dvou
různých koncentracích zkušební látky, např. při 2 a
5 mg*l-1
. Obvykle se TSK počítá na základě tvorby
amonných solí, ale v případech, kdy se předpokládá
nitrifikace nebo kdy dochází k nitrifikaci, se TSK
vypočte na základě tvorby dusičnanů (TSKNO3
, viz
příloha II, bod 2). V případech, kdy nitrifikace není
úplná, se provede korekce na změny analyticky
stanovených koncentrací dusitanů a dusičnanů (viz
příloha V). Máli být vyšetřena toxicita zkušební látky (např.
v případě dříve zjištěné nízké biologické
rozložitelnosti), je nezbytné nasadit další sérii
lahviček.
Připraví se další velká láhev s provzdušněným
minerálním médiem (naplněná asi do jedné třetiny
objemu), do které se přidá zkušební a referenční
chemická látka o konečné koncentraci obvykle stejné
jako v případě ostatních velkých lahví.
Roztoky ve velkých lahvích se inokulují výstupem
z druhého stupně čistírny odpadních vod (jedna kapka
nebo 0,05 až 5 ml·l
-1
) nebo z jiného zdroje inokula,
jako je např. říční voda (viz I.6.4.2). Nakonec se
lahve doplní na objem provzdušněným minerálním médiem
za použití hadičky, která sahá na dno, aby se dosáhlo
dostatečného promíchání.IVE.2.5 Počet lahviček v typické zkoušce
V typické zkoušce se použijí následující lahvičky:
nejméně 10 lahviček se zkušební látkou a inokulem
(zkušební suspense),
nejméně 10 lahviček pouze s inokulem (slepá zkouška
s inokulem),
nejméně 10 lahviček s referenční látkou a inokulem
(kontrolní zkouška postupu),
a podle potřeby 6 lahviček se zkoušenou látkou,
referenční látkou a inokulem (kontrola toxicity). Pro
rozpoznání 10denního období rozkladu je však potřebný
dvojnásobný počet lahviček.
IVE.2.6 Provedení zkoušky
Všechny připravené roztoky se ihned po přípravě rozdělí
do příslušné skupiny lahviček pro analýzu BSK, a to
pomocí hadičky zavedené do spodní čtvrtiny velké lahve
(nikoliv ke dnu) tak, aby se všechny lahvičky pro
analýzu BSK zcela naplnily. Jemně se poklepe, aby se
odstranily bublinky. V lahvičkách se Winklerovou
metodou nebo pomocí oxymetru ihned stanoví obsah
rozpuštěného kyslíku k počátku zkoušky (k času nula).
Obsah lahviček lze konzervovat pro pozdější analýzu
přídavkem síranu manganatého a hydroxidu sodného
(prvním Winklerovým činidlem). Před provedením
zbývajících kroků Winklerovy metody se pečlivě uzavřené
lahvičky obsahující kyslík vázaný ve formě
hydratovaného oxidu manganitého skladují v temnu
nejdéle 24 h při teplotě 10 – 20 st.C. Zbývající souběžně
připravené lahvičky se uzavřou tak, aby v nich
nezůstaly bublinky vzduchu, a inkubují se v temnu při
20 st.C. Každá série musí být doprovázena úplnou sérií
slepého pokusu s inokulovaným médiem. Ve všech sériích
se během 28 dnů inkubace v pravidelných intervalech
(nejméně jednou týdně) stanoví alespoň ve dvou
lahvičkách obsah rozpuštěného kyslíku.
Týdenní vzorky umožní stanovení rozkladu v procentech
ve 14denním období rozkladu, zatímco vzorky odebírané
každé 3 – 4 dny umožní rozpoznat 10denní období
rozkladu, což vyžaduje dvojnásobný počet lahviček.
U látek obsahujících dusík se provede korekce na
spotřebu kyslíku při nitrifikaci. K tomuto účelu se
stanoví koncentrace rozpuštěného kyslíku oxymetrem a
poté se z lahvičky pro analýzu BSK odebere vzorek pro
stanovení dusitanů a dusičnanů. Z přírůstku koncentrace
dusitanů a dusičnanů se vypočte množství spotřebovaného
kyslíku (viz příloha V).
IVE.3 DATA A ZPRÁVY
IVE.3.1 Zpracování výsledků
Nejprve se vypočte BSK, ke které došlo po každé časové
periodě, a to odečtením spotřeby kyslíku (v mg O
2
na
litr) ve slepém pokusu s inokulem od spotřeby zkušební
chemickou látkou. Takto korigovaná spotřeba se vydělí
koncentrací zkušební látky (mg*l-1
) a získá se
specifická BSK v mg kyslíku na mg zkušební látky.
Biologická rozložitelnost v procentech se vypočte jako
podíl specifické BSK a specifické TSK (vypočtené podle
přílohy II, bodu 2) nebo CHSK (stanovené analyticky,
viz příloha II, bod 3), tedy:
spotř. O2 zk. chem. látkou v mg - spotř. O2 ve slep. pokusu v mg
BSK = -----------------------------------------------------------------
hmotnost zkušební chem. látky v baňce v mg
= mg O2 na mg zkušební chemické látky.
BSK (mg O2 na mg zkušeb. chem. látky)
rozklad v % = -------------------------------------- x 100
TSK (mg O2 na mg zkušeb. chem. látky)
nebo
BSK (mg O2 na mg zkušeb. chem. látky)
rozklad c % = -------------------------------------- x 100
COD (mg O2 na mg zkušeb. chem. látky)
Je třeba poznamenat, že tyto dvě metody nemusí
poskytovat stejné hodnoty; přednost se dává první
metodě.
Pro látky, jež obsahují dusík, se použije odpovídající
hodnota TSK (pro NH
4
nebo NO3
) podle toho, zda se
očekává nitrifikace, či nikoli (příloha II, bod 2).
Jestliže k nitrifikaci dochází, avšak není úplná,
vypočte se korekce na spotřebu kyslíku při nitrifikaci
ze změn koncentrace dusitanů a dusičnanů (příloha V).IVE.3.2 Platnost výsledků
Spotřeba kyslíku ve slepém pokusu s inokulem by neměla
být po 28 dnech vyšší než 1,5 mg·l
-1
. Vyšší hodnoty
vyžadují přešetření experimentální techniky. Zbytková
koncentrace kyslíku ve zkušebních lahvičkách by neměla
nikdy klesnout pod 0,5 mg*l-1
. Takto nízké úrovně
kyslíku jsou platné pouze tehdy, lzeli použitou
metodou stanovení rozpuštěného kyslíku tak nízké úrovně
přesně změřit. Viz také I.5.2.
IVE.3.3 Zprávy
Viz I.8.
IVE.4 PŘEHLED DAT
Dále je uveden příklad přehledu dat:
ZKOUŠKA V UZAVŘENÝCH LAHVIČKÁCH
1. LABORATOŘ
2. DATUM ZAHÁJENÍ ZKOUŠKY
3. ZKUŠEBNÍ LÁTKA
Název:
Koncentrace zásobního roztoku: mg*l-1
Počáteční koncentrace v lahvičce: mg*l-1
TSK nebo CHSK: v mg O2 na mg zkušební látky
4. INOKULUM
Zdroj:
Provedená úprava:
Předběžná úprava, pokud byla provedena:
Koncentrace v reakční směsi: mg*l1
5. STANOVENÍ ROZPUŠTĚNÉHO KYSLÍKU:
Metoda: Winklerova metoda / oxymetr
Analýzy lahviček
--------------------------------------------------
Doba kultivace (d) Rozpuštěný
kyslík
(mg*l-1)
--------------------------------------------------
0 n1 n2
Slepá 1 C1
zkouška (bez
chemické
látky)
2 C2
Průměr
Zkušební 1 a1
chemická
látka
2 a2
Průměr
a1 + a2
m1 = -----------
2
--------------------------------------------------
Poznámka: podobný formulář lze použít i pro referenční
látku a pro kontroly toxicity.
6. KOREKCE NA NITRIFIKACI (viz příloha V)
------------------------------------------------------
Doba kultivace 0 n1 n2 n3
------------------------------------------------------
i) Koncentrace dusičnanů (mg N
na litr)
ii) Změna koncentrace dusičnanů —
(mg N na litr)
iii) Kyslíkový ekvivalent (mg*l-1) —
iv) Koncentrace dusitanů (mg N
na litr)
v) Změna koncentrace dusitanů —
(mg N na litr)
vi) Kyslíkový ekvivalent (mg*l-1) —
iii + vi) Celkový kyslíkový —
ekvivalent (mg*l-1)
------------------------------------------------------
7. ÚBYTEK ROZPUŠTĚNÉHO KYSLÍKU: ROZKLAD V PROCENTECH
-----------------------------------------------------------------
Úbytek po n dnech
(mg.l-1)
-----------------------------------------------------------------
n1 n2 n3
-----------------------------------------------------------------
Lahvička 1: (mt0 - mtx) - (mb0 - mbx)
-----------------------------------------------------------------
Lahvička 2: (mt0 - mtx) - (mb0 - mbx)
-----------------------------------------------------------------
Lahvička 1:
[(mt0 - mtx) - (mb0 - mbx)] x 100
% D1 = ---------------------------------
konc. zkuš. chem. látky x TSK
-----------------------------------------------------------------
Lahvička 2:
[(mt0 - mtx) - (mb0 - mbx)] x 100
% D2 = ---------------------------------
konc. zkuš. chem. látky x TSK
-----------------------------------------------------------------
D1 - D2
průměr*) % D = -------
2
-----------------------------------------------------------------
* Hodnoty nelze průměrovat, jeli mezi nimi výrazný rozdíl.
mt0 = hodnota pro zkušební lahvičku v čase 0
mtx = hodnota pro zkušební lahvičku v čase x
mb0 = hodnota pro slepý pokus v čase 0
mbx = hodnota pro slepý pokus v čase x
Použijí se rovněž korekce na nitrifikaci z bodu iii + vi v oddílu 6.
8. ÚBYTEK ROZPUŠTĚNÉHO KYSLÍKU VE SLEPÉM POKUSU
Spotřeba kyslíku ve slepém pokusu je (mb0 - mb28)
v mg*l-1. Tato spotřeba je důležitá pro platnost
zkoušky. Měla by být menší než 1,5 mg*l-1.
IVF. METODA PRO STANOVENÍ „SNADNÉ“ BIOLOGICKÉ ROZLOŽITELNOSTI
POMOCÍ ZKOUŠKY MITI – METODA C.4-F PODLE PŘÍLOHY SMĚRNICE
92/69/EHS
IVF.1 PODSTATA METODY
Měření spotřeby kyslíku v míchaném roztoku nebo
suspensi zkušební chemické látky v minerálním médiu
inokulovaném speciální kulturou neadaptovaných
mikroorganismů se provádí automaticky po dobu 28 dnů za
tmy v uzavřeném respirometru při 25 +/- 1 st.C.
Uvolňovaný oxid uhličitý se jímá v hydroxidu sodném.
Biologická rozložitelnost se vyjádří jako spotřeba
kyslíku (korigovaná na slepý pokus) vyjádřená
v procentech teoretické spotřeby kyslíku (TSK).
Primární biologická rozložitelnost vyjádřená
v procentech se rovněž vypočte z doplňkové specifické
chemické analýzy provedené na začátku a na konci
kultivace, popřípadě z analýzy DOC.
IVF.2 POPIS METODY
IVF.2.1 Přístroje a pomůcky
a) automatický elektrolytický měřič BSK nebo
respirometr standardně vybavený 6 baňkami na
300 ml opatřenými uzávěry obsahujícími absorbent
CO
2
; b) místnost s konstantní teplotou nebo vodní lázeň
nastavená na 25 +/- 1 st.C;
c) zařízení pro membránovou filtraci (nepovinné);
d) analyzátor uhlíku (nepovinné).
IVF.2.2 Příprava minerálního média
a) Dihydrogenfosforečnan draselný, KH2PO4 8,50
Hydrogenfosforečnan didraselný, K2HPO4 21,75 g
Hydrogenfosforečnan disodný dodekahydrát, Na2HPO4*12H2O 44,60 g
Chlorid amonný, NH4Cl 1,70 g
Rozpustí se ve vodě a doplní na 1 litr.
pH roztoku musí být 7,2.
b) Síran hořečnatý heptahydrát, MgSO4*7H2O 22,50 g
Rozpustí se ve vodě a doplní na 1 litr.
c) Chlorid vápenatý bezvodý, CaCl2 27,50 g
Rozpustí se ve vodě a doplní na 1 litr.
d) Chlorid železitý hexahydrát, FeCl3*6H2O 0,25 g
Rozpustí se ve vodě a doplní na 1 litr.
Spojí se po 3 ml roztoků a), b), c), a d) a doplní se
na 1 litr.
IVF.2.3 Příprava inokula
Odeberou se čerstvé vzorky nejméně z deseti lokalit,
kde se používají a vypouštějí různé chemické látky.
Z míst, jako jsou čistírny městských a průmyslových
odpadních vod, řeky, jezera a moře se odeberou litrové
vzorky kalu, povrchových půd, vody atd., které se
pečlivě smíchají. Po odstranění vyplavených látek a
ustálení se pH supernatantu upraví na 7 +/- 1
hydroxidem sodným nebo kyselinou fosforečnou.
Vhodným objemem filtrovaného supernatantu se naplní
nádoba na aktivaci kalu a kapalina se 23˝ h
provzdušňuje. Třicet minut po ukončení provzdušňování
se odlije přibližně jedna třetina celkového objemu
supernatantu a k usazenému materiálu se přidá stejný
objem roztoku (pH 7), který obsahuje vždy po 0,1 %
glukosy, peptonu a dihydrogenfosforečnanu draselného, a
obnoví se provzdušňování. Tento postup se opakuje
jednou denně. Kalová jednotka musí být provozovaná
podle zásad správné laboratorní praxe: odtok má být
čirý, teplota má být udržována při 25 +/- 2 st.C, pH má
být 7 +/- l, kal se má dobře usazovat, provzdušňování
musí být za všech okolností dostatečné, mají být
přítomni prvoci a aktivita kalu se má kontrolovat
pomocí referenční látky nejméně každé tři měsíce.
Inokulum se nepoužívá dříve než po 1 měsíci kultivace,
ale ne později než po čtyřech měsících. Proto se
v pravidelných intervalech jednou za tři měsíce
odebírají vzorky z 10 míst.
K udržení stejné aktivity čerstvého a starého kalu se
filtrovaný supernatant aktivovaného použitého kalu mísí
se stejným objemem filtrovaného supernatantu čerstvě
odebraného kalu pocházejícího z deseti zdrojů a směs se
kultivuje podle výše uvedeného postupu. Kal se použije
jako inokulum až 18 – 24 h po uvedeném zpracování.
IVF.2.4 Příprava baněk
Připraví se následujících 6 baněk:
Baňka č. 1: zkušební chemická látka v ředicí vodě,
100 mg*l
-1
Baňky č. 2, 3, 4: zkušební chemická látka v minerálním
médiu, 100 mg*l
-1
Baňka č. 5: referenční látka (např. anilin)
v minerálním médiu, 100 mg*l
-1
Baňka č. 6: pouze minerální médium
Špatně rozpustné chemické látky se odváží nebo odměří,
nebo se zpracují podle přílohy III, s výjimkou těch, u
nichž nesmějí být použita rozpouštědla ani emulgátory.
Do speciálních uzávěrů všech lahví se přidá absorbent
oxidu uhličitého. pH v baňkách č. 2, 3 a 4 se upraví na
7,0.
IVF.2.5 Provedení zkoušky
Baňky č. 2, 3, 4 (zkušební suspense), č. 5 (kontrola
aktivity), č. 6 (slepý pokus s inokulem) se inokulují
malým množstvím inokula tak, aby byla výsledná
koncentrace kalu 30 mg·l
-1
. Do lahve č. 1 se inokulum
nepřidává, slouží jako abiotická kontrola. Zařízení se
sestaví, přezkouší se na vzduchotěsnost, spustí se
míchačka a v temnu se zahájí měření spotřeby kyslíku.
Denně se kontroluje teplota, míchání, coulometrický
zapisovač spotřeby kyslíku a zaznamenají se všechny
změny barvy obsahu baněk. Spotřeba kyslíku pro 6 baněk
se odečítá přímo, např. šestikanálovým zapisovačem,
čímž se získá křivka BSK. Na konci kultivace, obvykle
po 28 dnech, se změří pH v baňkách a stanoví se
zbytková koncentrace zkušební chemické látky a jejích
produktů rozkladu a v případě zkoušení látek
rozpustných ve vodě také koncentrace DOC (postup podle
přílohy II, bodu 4). Zvláštní pozornost je třeba
věnovat těkavým látkám. Pokud se předpokládá
nitrifikace, stanoví se podle možnosti koncentrace
dusičnanů a dusitanů.IVF.3 DATA A ZPRÁVY
IVF.3.1 Zpracování výsledků
Spotřeba kyslíku (mg) zkušební látkou za danou dobu
(korigovaná na spotřebu inokulem za stejnou dobu ve
slepém pokusu) se podělí hmotností použité zkušební
látky. Získá se tak hodnota BSK vyjádřená v mg kyslíku
na mg zkušební látky:
spotř. O2 zk. chem. látkou v mg - spotř. O2 ve slepé zkoušce v mg
BSK = -----------------------------------------------------------------
hmotnost zkušební chem. látky v baňce v mg
= mg O2 na mg zkušební chemické látky.
Biologický rozklad v procentech se vypočte buď z rovnice:
BSK (mg O2 na mg chem. látky)
biolog. rozklad v % = % TSK = ----------------------------- x 100.
TSK (mg O2 na mg chem. látky)
Pro směsi se TSK vypočte z elementární analýzy, tak jako pro
jednoduché sloučeniny. Použije se odpovídající hodnota TSK
(TSKNH4 nebo TSKNO3)
podle toho, zda se očekává nitrifikace, či nikoli (příloha II, bod 2).
Jestliže k nitrifikaci dochází, avšak není úplná, vypočte se korekce
na spotřebu kyslíku při nitrifikaci ze změn koncentrace dusitanů
a dusičnanů (příloha V).
Vypočte se primární biologický rozklad v procentech z úbytku specifické
(výchozí) chemické látky (viz I.7.2):
Sb - Sa
Dt = ------- x 100
Sb
Zjistí-li se při měření fyzikálně-chemického úbytku ztráta zkušební
chemické látky v baňce č. 1, zaznamená se to a jako koncentrace zkušební
látky (Sb) po 28 dnech se pro výpočet biologické rozložitelnosti
dosadí tato koncentrace.
Stanovuje-li se koncentrace DOC (nepovinné), vypočte se konečná hodnota
biologického rozkladu v procentech podle vztahu:
C1 - Cbt
Dt = (1 - --------) x 100
C0 - Cb0
jak je uvedeno v bodě I.7.1. Zjistíli se při měření
fyzikálně-chemického úbytku ztráta DOC v baňce č. 1,
použije se při výpočtu biologického rozkladu
v procentech tato koncentrace DOC.
Všechny výsledky se zaznamenají do přehledu dat.
IVF.3.2 Platnost výsledků
Obvyklá spotřeba kyslíku inokulem je 20 – 30 mg O
2
na
litr a neměla by být větší než 60 mg*l-1
za 28 dnů.
Hodnoty větší než 60 mg*l-1
vyžadují kritické
přehodnocení výsledků a experimentální techniky. Jeli
pH mimo rozpětí 6 – 8,5 a spotřeba kyslíku zkušební
látkou je menší než 60 %, měla by být zkouška opakována
s nižší koncentrací zkušební látky. Viz také I.5.2.
V případě, že rozklad anilinu vypočtený ze spotřeby
kyslíku nepřekročí po 7 dnech 40 % a po 14 dnech 65 %,
považuje se zkouška za neplatnou.
IVF.3.3 Zprávy
Viz I.8.
IVF.4 PŘEHLED DAT
Dále je uveden příklad přehledu dat:
ZKOUŠKA MITI (I)
1. LABORATOŘ
2. DATUM ZAHÁJENÍ ZKOUŠKY
3. ZKUŠEBNÍ LÁTKA
Název:
Koncentrace chemické látky v zásobním roztoku:
mg*l-1
Počáteční koncentrace chemické látky v médiu, C0:
mg*l-1
Objem reakční směsi, V: ml
TSK: mg O2 na litr
4. INOKULUM
Místa odběru kalu:
1)... 6)...
2)... 7)...
3)... 8)...
4)... 9)...
5)... 10)...
Koncentrace suspendovaných látek v aktivovaném
kalu po aklimatizaci se syntetickými splašky =
... mg*l-1.
Objem aktivovaného kalu v litru konečného média =
... ml
Koncentrace kalu v konečném médiu = ... mg*l-1
5. SPOTŘEBA KYSLÍKU: BIOLOGICKÁ ROZLOŽITELNOST
Typ použitého respirometru:
---------------------------------------------------
Čas (dny)
0 7 14 21 28
---------------------------------------------------
Spotřeba O2 a1
(mg)
zkušební
látkou
a 2
a 3
---------------------------------------------------
Spotřeba O2 b
(mg) ve
slepé
zkoušce
---------------------------------------------------
Korigovaná (a1 - b)
spotřeba O2 (a2 - b)
(mg) (a3 - b)
---------------------------------------------------
BSK na mg (a-b) Baňka
zkušební ---- 1
látky C0V
Baňka
2
Baňka
3
---------------------------------------------------
Rozklad v % 1
2
3
Průměr*
---------------------------------------------------
Poznámka: podobný formulář lze použít i pro referenční
látku.
* Hodnoty nelze průměrovat, jeli mezi nimi výrazný
rozdíl.
6. ANALÝZA UHLÍKU (podle volby)
Analyzátor uhlíku:
--------------------------------------------------------
Baňka DOC úbytek Průměr
DOC
v %
--------------------------------------------------------
Naměřená Korigovaná
hodnota hodnota
--------------------------------------------------------
Voda + a — —
zkušební
látka
Kal + b1 b1 - c
zkušební
látka
Kal + b2 b2 - c
zkušební
látka
Kal + b3 b3 - c
zkušební
látka
Kontrolní c — — —
slepá
zkouška
--------------------------------------------------------
7. DATA ZE SPECIFICKÉ CHEMICKÉ ANALÝZY
--------------------------------------------------------
Zbytkové množství Rozklad
zkušební chemické v %
látky na konci
zkoušky
--------------------------------------------------------
Slepá zkouška Sb
s vodou
--------------------------------------------------------
Inokulované Sa1
médium Sa2
Sa3
--------------------------------------------------------
Sb - Sa
rozklad v % = ------- x 100
Sb
Rozklad v % se vypočte pro baňky a1, a2, a3.
8. POZNÁMKY
Připojí se křivka závislosti BSK na čase, jeli
k dispozici.
PŘÍLOHA I
ZKRATKY A DEFINICE
DO: Rozpuštěný kyslík (dissolved oxygen) (mg*l
-1
) je
koncentrace kyslíku, který je rozpuštěn ve vodném vzorku.BSK: Biochemická spotřeba kyslíku (biochemical oxygen demand,
BOD) (g) je množství kyslíku, jež je v průběhu
metabolizace zkušební látky spotřebováno mikroorganismy;
vyjadřuje se také jako spotřeba kyslíku v gramech na gram
zkušební látky. (Viz metoda C.5).
CHSK: Chemická spotřeba kyslíku (chemical oxygen demand, COD)
(g) je množství kyslíku, jež je spotřebováno v průběhu
oxidace zkušební látky horkým kyselým dichromanem; je
měřítkem množství přítomných oxidovatelných látek;
vyjadřuje se také v gramech kyslíku spotřebovaného na
gram zkušební látky. (Viz metoda C.6).
DOC: Rozpuštěný organický uhlík (dissolved organic carbon) je
celkový organický uhlík, který je přítomný v roztoku nebo
projde přes filtr o velikosti pórů 0,45 µm nebo zůstane
v supernatantu po odstřeďování po dobu 15 min při
zrychlení 40 000 m*s?2 (asi 4 000 g).
TSK: Teoretická spotřeba kyslíku (theoretical oxygen demand,
ThOD) (mg) je celkové množství kyslíku nezbytné pro
úplnou oxidaci chemické látky; vypočte se z molekulového
vzorce látky (viz příloha II, bod 2) a vyjadřuje se také
jako množství kyslíku v mg nezbytné na mg zkušební látky.
TCO
2
: Teoretický oxid uhličitý (theoretical carbon dioxide,
ThCO2
) je množství oxidu uhličitého, které by mělo
vzniknout ze známého nebo změřeného obsahu uhlíku ve
zkušební látce za předpokladu její úplné mineralizace;
vyjadřuje se v mg oxidu uhličitého uvolněného z 1 mg
zkušební látky.TOC: Celkový organický uhlík (total organic carbon) ve vzorku
je součtem organického uhlíku v roztoku a v suspensi.
IC: Anorganický uhlík (inorganic carbon).
TC: Celkový uhlík (total carbon) je součtem organického a
anorganického uhlíku ve vzorku.
Primární biologický rozklad:
jsou změny chemické struktury látky způsobené biologickým
působením, vedoucí ke ztrátě specifických vlastnosti látky.
Úplný biologický rozklad (aerobní):
je stupeň rozkladu látky dosažený po jejím úplném zužitkování
mikroorganismy, vedoucí k produkci oxidu uhličitého, vody,
minerálních solí a nové mikrobiální buněčné hmoty (biomasy).
Snadno biologicky rozložitelná:
je dohodnutá klasifikace chemických látek, které prošly
screeningovými zkouškami úplné biologické rozložitelnosti; tyto
zkoušky jsou tak přísné, že lze předpokládat, že se látky budou
ve vodném prostředí za aerobních podmínek rychle a úplně
biologicky rozkládat.
Biologicky rozložitelná:
je klasifikace chemických látek, pro něž existuje nepochybný
důkaz o jejich biologické rozložitelnosti (primární nebo
konečné) v kterékoli uznávané zkoušce biologické
rozložitelnosti.
Odstranitelnost:
je náklonnost látek k jejich odstranění při biologickém čištění
odpadních vod, aniž by byl nepříznivě ovlivněn normální průběh
čisticích pochodů. Látky snadno biologicky rozložitelné jsou
obecně odstranitelné, avšak ne všechny rozložitelné látky jsou
odstranitelné. Mohou zde působit také abiotické procesy.
Fáze iniciace:
je doba, ve zkoušce na úbytek rozpuštěného organického uhlíku,
od inokulace do dosažení alespoň 10% biologického rozkladu.
Fáze iniciace je často různě dlouhá a špatně reprodukovatelná.
Doba rozkladu:
je doba od konce fáze zdržení do dosažení 90 % maximální
dosažitelné úrovně rozkladu.
10denní období rozkladu:
je 10 dnů, které následují bezprostředně po dosažení 10%
rozkladu.
PŘÍLOHA II
VÝPOČET A STANOVENÍ NĚKTERÝCH SOUHRNNÝCH PARAMETRŮ
V závislosti na zvolené zkušební metodě se vyžaduje určení
některých souhrnných parametrů. V následujícím oddíle je popsán
výpočet těchto hodnot. Využití těchto parametrů je popsáno u
jednotlivých metod.
1. Obsah uhlíku
Obsah uhlíku se počítá ze známého elementárního složení nebo se
stanoví analýzou prvků ve zkušební látce.
2. Teoretická spotřeba kyslíku (TSK)
Teoretickou spotřebu kyslíku (TSK) lze vypočítat ze znalosti
elementárního složení nebo z výsledků analýzy prvků. Pro látku
CcHhClclNnNanaOoPpSs
bez nitrifikace,
16[2c + 1/2(h - cl - 3n) + 3s + 5/2p + 1/2na -o]
* TSKNH4 = ------------------------------------------------ v mg/mg
M
nebo s nitrifikací,
16[2c + 1/2(h - cl) + 5/2n + 3s + 5/2p + 1/2na -o]
TSKNH4 = --------------------------------------------------
M
bez nitrifikace,
* Poznámka: M je molekulová hmotnost
3. Chemická spotřeba kyslíku (CHSK)
Chemická spotřeba kyslíku (CHSK) se stanoví metodou C.6.
4. Rozpuštěný organický uhlík (DOC)
Rozpuštěným organickým uhlíkem je podle definice organický
uhlík přítomný ve vodném roztoku chemické látky nebo směsi,
který projde přes filtr o velikosti pórů 0,45 µm.
Odeberou se vzorky ze zkušebních nádob a ihned se filtrují
pomocí filtračního zařízení s vhodným membránovým filtrem.
Prvních 20 ml (toto množství může být při použití malých filtrů
zmenšeno) se odstraní. 10 ? 20 ml, nebo v případě nástřiku
menší objem (objem závisí na množství potřebném pro analýzu),
se uschová pro analýzu uhlíku. Koncentrace DOC se stanoví
pomocí analyzátoru organického uhlíku, který umožňuje přesné
stanovení koncentrace uhlíku, která je menší nebo rovna 10 %
počáteční koncentrace DOC použité ve zkoušce.
Zfiltrované vzorky, které není možné analyzovat ve stejný
pracovní den, se uchovávají v ledničce 48 h při 2 – 4 st.C nebo
delší dobu při teplotě nižší než -18 st.C.
Poznámky:
Membránové filtry jsou často impregnovány povrchově aktivními
látkami za účelem jejich hydrofilizace. Filtr tedy může
obsahovat až několik mg rozpustného organického uhlíku, který
může ovlivnit stanovení biologické rozložitelnosti.
Povrchově aktivní látky a jiné rozpustné organické látky se
z filtrů odstraňují vyvařením třikrát jednu hodinu
v deionizované vodě. Filtry lze poté skladovat 1 týden ve vodě.
Při použití filtračních patron pro jedno použití se musí u
každé šarže ověřit, zda neobsahuje rozpustný organický uhlík.
V závislosti na typu membránového filtru může docházet
k adsorpci zkušební látky na filtru. Doporučuje se ověřit, zda
k adsorpci zkušební chemické látky na filtru nedochází.
Místo filtrace lze použít k rozlišení TOC od DOC odstřeďování
při 40 000 m·s
-1
(4 000 g) po dobu 15 min. Tato metoda však
není spolehlivá při počáteční koncentraci DOC < 10 mg*l-1
,
protože buď nelze odstranit všechny bakterie, nebo se zpětně
rozpouští uhlík, který je součástí bakteriální plasmy.LITERATURA
— Standard Methods for the Examination of Water and Wastewater.
12th ed., Am. Publ. Hlth. Ass.,
Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, p 65.
— Wagner, R. von Wasser, 1976, vol 46, 139.
— DINEntwurf 38 409, Teil 41 – Deutsches Einheitsverfahren zur
Wasser-, Abwasser- und Schlammuntersuchung, Summarische
Wirkungs- und Stoffkenngrössen (Gruppe H). Bestimmung des
Chemischen Sauerstoffbedarfs (CSB) (H 41),
Normenausschuss Wasserwesen (NAW) in DIN Deutsches
Institut für Normung e.V.
— Gerike, P. The biodegradability testing of poorly water
soluble compounds. Chemosphere, 1984, vol 13(1), 169.
PŘÍLOHA III
VYHODNOCENÍ BIOLOGICKÉ ROZLOŽITELNOSTI ŠPATNĚ ROZPUSTNÝCH LÁTEK
Při zkouškách biologické rozložitelnosti špatně rozpustných
látek si zaslouží zvláštní pozornost následující aspekty.
Zatímco odběr vzorků homogenních kapalin je problémem jen
zřídka, u tuhých látek se doporučuje provést homogenizaci
vhodnými prostředky, aby v důsledku nehomogenity nedošlo
k chybám. Zvláštní pozornost musí být věnována odběrům
reprezentativních vzorků o několika miligramech ze směsí látek,
které obsahují velké množství nečistot.
V průběhu zkoušek lze použít různé způsoby míchání. Je třeba
věnovat pozornost tomu, aby míchání bylo přiměřené právě pro
udržení látky v disperzi a nedocházelo k přehřívání, nadměrnému
pěnění a nadměrným třecím silám.
Může se použít emulgátor vytvářející stabilní disperzi chemické
látky. Nesmí být toxický pro bakterie a nesmí se biologicky
rozkládat nebo pěnit za zkušebních podmínek.
Stejná kritéria jako pro emulgátory platí i pro rozpouštědla.
U tuhých zkušebních látek se nedoporučuje používat tuhé nosiče,
mohou však být vhodné v případě olejovitých látek.
Použijíli se pomocné látky, jako jsou emulgátory, rozpouštědla
a nosiče, musí být proveden slepý pokus s pomocnou látkou.
Pro studium biologické rozložitelnosti špatně rozpustných látek
lze použít kteroukoli ze tří respirometrických zkoušek (zkouška
na úbytek CO
2
, na BSK, zkouška MITI).LITERATURA
— de Morsier, A. et al. Biodegradation tests for poorly soluble
compounds. Chemosphere, 1987, 16, 833.
— Gerike, P. The Biodegradability testing of poorly water
soluble compounds. Chemosphere, 1984, 13, 169.
PŘÍLOHA IV
VYHODNOCENÍ BIOLOGICKÉ ROZLOŽITELNOSTI LÁTEK POTENCIÁLNĚ
TOXICKÝCH PRO INOKULUM
Jeli chemická látka podrobena zkoušení snadné biologické
rozložitelnosti a jeví se jako biologicky nerozložitelná,
doporučuje se postupovat při požadavku rozlišit inhibiční
působení od odolnosti látky vůči rozkladu následujícím způsobem
(Reynolds et al., 1987).
Ve zkouškách toxicity i ve zkouškách biologické rozložitelnosti
se použijí podobná nebo stejná inokula.
K posouzení toxicity chemických látek zkoušených ve zkouškách
snadné biologické rozložitelnosti se doporučuje použít zkoušku
inhibice dýchání aktivovaného kalu (směrnice 88/302/EHS),
stanovení BSK nebo metodu inhibice růstu nebo kombinaci těchto
metod.
Nemáli dojít k inhibici z důvodu toxicity, měla by být
koncentrace zkušební látky použitá ve zkouškách snadné
biologické rozložitelnosti menší než 1/10 hodnoty EC
50
(nebo
menší než EC20
) zjištěné zkouškou toxicity. Látky
s EC50
> 300 mg*l-1
pravděpodobně nemají při zkouškách snadné
biologické rozložitelnosti toxické účinky.Hodnoty EC
50
< 20 mg*l-1
mohou při následném zkoušení působit
potíže. Měly by být použity nízké koncentrace, což vyžaduje
použít přísné a citlivé zkoušky v uzavřených lahvičkách nebo
materiál značený 14C. Použití vyšších koncentrací zkušební
látky může být popřípadě umožněno nasazením aklimatizovaného
inokula. V tomto případě se však ztrácí specifické kritérium
zkoušky snadné biologické rozložitelnosti.LITERATURA
Reynolds, L. et al., Evaluation of the toxicity of substances
to be assessed for biodegradability. Chemosphere, 1987, 16,
2259.
PŘÍLOHA V
KOREKCE NA SPOTŘEBU KYSLÍKU PŘI NITRIFIKACI
Chyby způsobené tím, že při stanovení spotřeby kyslíku ve
zkouškách látek, které neobsahují dusík, není vzata v úvahu
nitrifikace, nejsou významné (nejsou větší než 5 %), i když je
oxidace amoniakálního dusíku ve zkušebních nádobách a ve slepém
pokusu nepravidelná. U zkušebních látek obsahujících dusík může
dojít ke značným chybám.
Docházíli k nitrifikaci, avšak nikoli úplné, musí být spotřeba
kyslíku reakční směsí korigována na množství kyslíku
spotřebovaného na oxidaci amoniaku a amonných iontů na dusitany
a dusičnany, jsouli změny koncentrace dusitanů a dusičnanů
během kultivace stanoveny pomocí následujících rovnic:
2 NH4Cl + 3 O2= 2 HNO2+ 2 HCl + 2 H2O (1) 2 HNO2+ O2= 2 HNO3(2) Celkově: 2 NH4Cl + 4 O2= 2 HNO3+ 2 HCl + 2 H2O (3)
Podle rovnice 1 je spotřeba kyslíku při oxidaci 28 g dusíku
obsaženého v NH
4
Cl na dusitan 96 g, tzn., že přepočítávací
faktor je 3,43 (96/28). Stejně tak je podle rovnice 3 spotřeba
kyslíku při oxidaci na dusičnan 128 g, tzn. přepočítávací
faktor je 4,57 (128/28).Protože popsané reakce následují po sobě, přičemž jsou
realizovány odlišnými druhy bakterií, může koncentrace dusitanů
stoupat i klesat; při poklesu roste odpovídajícím způsobem
koncentrace dusičnanů. Spotřeba kyslíku při tvorbě dusičnanů se
tedy vypočte vynásobením přírůstku koncentrace dusičnanů
faktorem 4,57, zatímco spotřeba kyslíku při tvorbě dusitanů se
vypočte vynásobením přírůstku koncentrace dusitanů faktorem
3,43, nebo při poklesu obsahu dusitanů se ztráty kyslíku
vypočtou vynásobením poklesu koncentrace faktorem -3,43.
To znamená: spotřeba O2při tvorbě dusičnanů = 4,57 × přírůstek koncentrace dusičnanů (4) spotřeba O2při tvorbě dusitanů = 3,43 × přírůstek koncentrace dusitanů (5) ztráta O2při úbytku dusitanů: = -3,43 × pokles koncentrace dusitanů (6) Tedy spotřeba O2při nitrifikaci = +/- 3,43 × změna koncentrace dusitanů + 4,57 × změna koncentrace dusičnanů (7) a proto spotřeba O2v důsledku oxidace C = celková pozorovaná spotřeba - spotřeba v důsledku nitrifikace (8)
Jinými slovy, pokud se stanoví pouze celkový oxidovaný N, je
možno za spotřebu kyslíku v důsledku nitrifikace považovat
v prvém přiblížení hodnotu 4,57 x přírůstek oxidovaného
dusíku.
Korigovaná hodnota spotřeby kyslíku v důsledku oxidace C se
potom porovnává s TSK NH3 vypočítanou podle přílohy II.
V. METODA PRO STANOVENí ROZLOŽITELNOSTI – BIOCHEMICKÁ SPOTŘEBA
KYSLÍKU – METODA C.5 PODLE PříLOHY SMĚRNICE 92/69/EHS
V.1 METODA
V.1.1 ÚVOD
Metoda je určena pro měření biochemické spotřeby
kyslíku (BSK) tuhých nebo kapalných organických látek.
Data získaná při této zkoušce platí pro látky rozpustné
ve vodě; těkavé látky a látky s nízkou rozpustností ve
vodě lze touto metodou alespoň v zásadě rovněž zkoušet.
Metodu lze použít pouze pro organické látky, které
nemají v koncentracích používaných při zkoušce
inhibiční účinek na bakterie. Není-li daná látka při
koncentracích používaných ve zkoušce rozpustná, může
být nezbytné použít pro dosažení dobré dispergace
zkušebního materiálu zvláštní postupy, např. dispergaci
ultrazvukem.
Informace o toxicitě chemické látky mohou být užitečné
při interpretaci nízkých hodnot výsledku zkoušky a při
volbě vhodných zkušebních koncentrací.
V.1.2 DEFINICE A JEDNOTKY
Biochemická spotřeba kyslíku (BSK) je definována jako
množství rozpuštěného kyslíku, které je nutné
k biochemické oxidaci určitého objemu roztoku látky za
předepsaných podmínek.
Výsledky se vyjadřují v gramech spotřeby kyslíku (BSK)
na 1 g zkušební látky.
V.1.3 REFERENČNÍ LÁTKY
Je žádoucí použít vhodnou referenční látku pro kontrolu
aktivity inokula.
V.1.4 PODSTATA ZKUŠEBNÍ METODY
Předem stanovené množství látky rozpuštěné nebo
dispergované ve vhodném, dobře provzdušněném médiu se
inokuluje mikroorganismy a kultivuje se v temnu za
stálé, definované teploty.
BSK se stanoví z rozdílu mezi obsahem rozpuštěného
kyslíku na začátku a na konci zkoušky. Zkouška musí
trvat nejméně pět dní a nejdéle 28 dní.
Souběžně musí být provedena slepá zkouška bez obsahu
zkušební látky.
V.1.5 KRITÉRIA JAKOSTI
Stanovení BSK nelze považovat za ověřené stanovení
biologické rozložitelnosti látky. Tuto zkoušku lze
považovat pouze za screeningovou zkoušku.
V.1.6 POPIS ZKUŠEBNÍ METODY
Připraví se předběžný roztok nebo disperse zkušební
látky o koncentraci vhodné pro použitou metodu. Poté se
stanoví BSK některou vhodnou vnitrostátní nebo
mezinárodní standardizovanou metodou.
V.2 DATA A HODNOCENÍ
BSK předběžného roztoku se vypočte vybranou
normalizovanou metodou a přepočte se na BSK vyjádřenou
v gramech na 1 g zkušební látky.
V.3 ZPRÁVY
Uvede se použitá metoda.
Biochemická spotřeba kyslíku se vypočte jako průměr
výsledků alespoň tří platných měření.
Musí být uvedeny všechny informace a poznámky, které
jsou důležité pro interpretaci výsledků a které by
mohly ovlivnit výsledek, zejména pokud jde o nečistoty,
fyzikální stav, toxické účinky a vlastní složení
zkušební látky.
Použití přísad pro inhibici biologické nitrifikace musí
být uvedeno.
V.4 LITERATURA
Seznam příkladů standardizovaných metod:
NF T 90103: Determination of the biochemical oxygen
demand.
NBN 407: Biochemical oxygen demand.
NEN 3235 5.4: Bepaling van het biochemisch
zuurstofverbruik (BZV).
The determination of biochemical oxygen demand, Methods
for the examination of water and associated materials,
HMSO, London.
ISO 5815: Determination of biochemical oxygen demand
after n days.
VI. METODA PRO STANOVENí ROZLOŽITELNOSTI - CHEMICKÁ SPOTŘEBA
KYSLÍKU – METODA C.6 PODLE PŘÍLOHY SMĚRNICE 92/69/EHS
VI.1 METODA
VI.1.1 ÚVOD
Metoda je určena pro měření chemické spotřeby kyslíku
(CHSK) tuhých nebo kapalných organických látek
prováděné standardním dohodnutým způsobem za pevně
stanovených laboratorních podmínek.
Pro provedení této zkoušky a pro interpretaci výsledků
jsou užitečné informace o chemickém vzorci látky (např.
zda jde o soli halogenů, železnaté soli organických
sloučenin, organické sloučeniny chloru).
VI.1.2 DEFINICE A JEDNOTKY
Chemická spotřeba kyslíku (CHSK) je mírou
oxidovatelnosti látky, která se vyjadřuje jako
ekvivalentní množství kyslíku oxidačního činidla
spotřebovaného látkou za pevně stanovených
laboratorních podmínek.
Výsledek se vyjadřuje jako množství spotřebovaného
kyslíku (COD) v gramech na 1 g zkušební látky.
VI.1.3 REFERENČNÍ LÁTKY
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
VI.1.4. PODSTATA ZKUŠEBNÍ METODY
Předem stanovené množství látky rozpuštěné nebo
dispergované ve vodě se za přítomnosti síranu
stříbrného jako katalyzátoru oxiduje dichromanem
draselným v prostředí koncentrované kyseliny sírové pod
zpětným chladičem. Přebytečný dichroman se stanoví
titrací odměrným roztokem síranu amonnoželeznatého.
U látek obsahujících chlór se pro omezení rušení
chloridy přidává síran rtuťnatý*.
VI.1.5 KRITÉRIA JAKOSTI
Vzhledem k dohodnutým podmínkám stanovení je CHSK
„ukazatelem oxidovatelnosti“ a jako takový se používá
pro hodnocení organických látek.
Ve zkoušce mohou rušit chloridy; na stanovení CHSK
mohou mít rovněž vliv anorganické redukční a oxidační
látky.
U některých cyklických sloučenin a u řady těkavých
sloučenin (např. u nižších mastných kyselin) nedochází
v této zkoušce k úplné oxidaci.
VI.1.6 POPIS ZKUŠEBNÍ METODY
Připraví se počáteční roztok nebo disperse látky tak,
aby bylo dosaženo CHSK od 250 do 600 mg·l
-1
. Poznámky:
U špatně rozpustných nebo nedispergovatelných látek lze
jemně rozmělněnou látku nebo kapalinu v množství
odpovídajícím 5 mg CHSK odvážit a vpravit přímo do
experimentální aparatury s vodou.
Často je výhodné, zejména v případě špatně rozpustných
látek, stanovit CHSK upravenou metodou, tj. v uzavřeném
systému s vyrovnávačem tlaku (H. Kelkenberg, 1975).
Touto upravenou metodou lze často úspěšně kvantifikovat
i látky, u nichž je stanovení konvenční metodou obtížné
– např. kyselinu octovou. Metoda však také selhává
v případě pyridinu. Zvýšíli se koncentrace dichromanu
draselného předepsaná v (1), na 0,25 N (0,0416 M),
usnadní se přímé navažování 5 – 10 mg látky, což je
důležité pro stanovení CHSK látek obtížně rozpustných
ve vodě (2).
Jinak se CHSK stanoví vhodnou vnitrostátní nebo
mezinárodní metodou.
VI.2 DATA A HODNOCENÍ
CHSK obsahu experimentální baňky se vypočte vybranou
normalizovanou metodou a přepočte se na CHSK vyjádřenou
v gramech na 1 g zkušební látky.
VI.3 ZPRÁVY
Uvede se odkaz na použitou metodu.
Chemická spotřeba kyslíku se vypočte jako průměr
výsledků alespoň tří měření. Jsouli známy, musí být
uvedeny všechny informace a poznámky, které jsou
důležité pro interpretaci výsledků a které by mohly
ovlivnit výsledek, zejména pokud jde o nečistoty,
fyzikální stav a základní vlastnosti zkušební látky.
Uvede se použití síranu rtuťnatého za účelem omezení
rušení chloridy.
VI.4 LITERATURA
(1) Kelkenberg, H. Z. von Wasser und Abwasserforschung,
1975, 8, 146.
(2) Gerike, P. The biodegradability testing of poorly
water soluble compounds. Chemosphere, 1984, 13,
169.
Seznam příkladů normovaných metod:
NBN T 91201 Determination of the chemical oxygen
demand.
ISBN O 11 7512494 Chemical oxygen demand (dichromat
value) of polluted and waste
waters.
NF T 90101 Determination of the chemical oxygen
demand.
DS 217 Water analysis –Determination of the chemical
oxygen demand.
DIN 38409H41 Determination of the chemical oxygen
demand (COD) within the range
above 15 mg per litre.
NEN 3235 5.3 Bepaling van bet chemisch
zuurstofverbruik.
ISO 6060 Water Quality: Chemical oxygen demand
dichromate methods.
VII. METODA PRO STANOVENÍ ABIOTICKÉHO ROZKLADU – HYDROLÝZA
JAKO FUNKCE PH – METODA C.7 PODLE PŘÍLOHY SMĚRNICE 92/69/EHS
VII.1 METODA
Metoda je založena na Pokynech OECD pro zkoušení (1).
VII.1.1 ÚVOD
Hydrolýza je důležitá reakce ovlivňující abiotický
rozklad. Tato reakce má zvláštní význam u látek, které
jsou málo biologicky rozložitelné; může ovlivnit
stálost látky v životním prostředí.
Většina reakcí hydrolýzy probíhá jako reakce
pseudoprvního řádu, a poločasy jsou tedy nezávislé na
koncentraci. To zpravidla dovoluje extrapolaci výsledků
získaných s laboratorními koncentracemi na podmínky
v životním prostředí.
Mimoto byly u několika typů chemických sloučenin
publikovány příklady uspokojivé shody výsledků
naměřených v čisté vodě a v přírodních vodách (2).
Při provádění této zkoušky je užitečné znát hodnotu
tlaku par dané látky.
Metoda je použitelná pouze pro látky rozpustné ve vodě.
Nečistoty mohou ovlivnit výsledky.
Chování látek při hydrolýze by mělo být zkoumáno při
hodnotách pH, které se obvykle vyskytují v životním
prostředí (pH 4 – 9).
VII.1.2 DEFINICE A JEDNOTKY
Hydrolýzou se rozumí reakce látky RX s vodou. Tuto
reakci lze znázornit prostou výměnou skupiny X za
skupinu OH:
RX + HOH => ROH + HX (1)
Rychlost, kterou klesá koncentrace látky RX, je dána
vztahem:
rychlost = k*[H2O]*[RX] (2)
Protože je voda přítomna vůči zkoušené látce ve velkém
přebytku, označuje se obvykle tento typ reakce jako
reakce pseudoprvního řádu, ve které je pozorovaná
rychlostní konstanta dána vztahem:
kpozorov. = k*[H2O] (3)
Tuto konstantu lze určit pro danou hodnotu pH a teplotu
T z výrazu:
2,303 C0
kpozorov. = ---- x log ---- (4)
t Ct
kde
t = čas,
C0 = koncentrace látky v čase 0,
Ct = koncentrace látky v čase t,
2,303 = přepočítací faktor mezi přirozeným logaritmem a
dekadickým logaritmem.
Koncentrace se vyjádří v g*l-1 nebo v mol*l-1.
Konstanta kpozorov. má rozměr [čas]-1.
„Poločas“ t1/2 je definován jako doba potřebná pro
snížení koncentrace látky o 50 %,
Ct = 1/2*C0 (5)
Z rovnic (4) a (5) plyne, že
t1/2 = 0,693 / kpozorov. (6)
VII.1.3 REFERENČNÍ LÁTKY
Při vyšetřování nové látky není nutné vždy používat
referenční látky. Měly by v první řadě sloužit
k občasné kontrole provedení metody a ke vzájemnému
porovnávání výsledků získaných jinými metodami.
Jako referenční látky byly použity následující látky
(1):
Kyselina acetylsalicylová (aspirin),
O,O-diethyl-O-(2-isopropyl-6-methylpyrimidin-4-
yl)fosforothioát (dimpylát, diazinon).
VII.1.4 PODSTATA ZKUŠEBNÍ METODY
Látka se rozpustí ve vodě v nízké koncentraci; pH a
teplota se regulují.
Vhodnou analytickou metodou se sleduje pokles
koncentrace látky v závislosti na čase.
Sestrojí se graf závislosti logaritmů koncentrací na
čase, a jeli závislost lineární, lze zjistit
rychlostní konstantu reakce prvního řádu ze směrnice
přímky (viz bod 2).
Není-li možné stanovit rychlostní konstantu pro danou
teplotu přímo, je obvykle možné odhadnout ji pomocí
Arrheniovy rovnice, která udává teplotní závislost
rychlostních konstant. Z průběhu lineární závislosti
logaritmů rychlostních konstant, získaných při vhodných
teplotách, na převrácené hodnotě absolutní teploty (K)
lze extrapolací získat hodnotu rychlostní konstanty,
kterou nebylo možné stanovit přímo.
VII.1.5 KRITÉRIA JAKOSTI
V odkazu (2) se uvádí, že měření rychlostních konstant
hydrolýzy lze u 13 tříd organických sloučenin provádět
s vysokou přesností.
Reprodukovatelnost závisí zejména na regulaci pH a
teploty a může být ovlivněna přítomností mikroorganismů
a ve speciálních případech koncentrací rozpuštěného
kyslíku.
VII.1.6 POPIS ZKUŠEBNÍ METODY
VII.1.6.1 Reakční činidla
VII.1.6.1.1 Pufrační roztoky
Zkouška se provádí při třech hodnotách pH: 4,0, 7,0 a
9,0.
K tomuto účelu se za použití chemikálií čistoty p.a. a
destilované nebo deionizované vody připraví pufrační
roztoky. Některé příklady pufračních roztoků jsou
uvedeny v doplňku.
Použitý pufrační roztok může mít vliv na rychlost
hydrolýzy; jeli tomu tak, je třeba zvolit jiný
pufrační roztok. V odkazu (2) se doporučuje použít
namísto fosforečnanových pufračních roztoků boritanové
a acetátové pufrační roztoky.
Není-li známa hodnota pH pufračních roztoků při
zkušební teplotě, lze ji stanovit s přesností na +/-0,1
pHmetrem kalibrovaným při zvolené teplotě.
VII.1.6.1.2 Zkušební roztoky
Zkušební látka se rozpustí ve zvoleném pufračním
roztoku a koncentrace by neměla překročit 0,01 mol·l
-1
nebo polovinu koncentrace nasyceného roztoku, podle
toho, která z těchto hodnot je nižší. Použití organických rozpouštědel mísitelných s vodou se
doporučuje jen u látek s nízkou rozpustností ve vodě.
Množství tohoto rozpouštědla by mělo být menší než 1 %
a nemělo by mít vliv na proces hydrolýzy.
VII.1.6.2 Aparatura
Použijí se skleněné baňky se zabroušenými zátkami, pro
něž není vhodné používat mazací tuk.
Pokud jsou chemická látka nebo pufrační roztok těkavé,
nebo provádíli se zkouška při zvýšené teplotě,
upřednostňují se baňky zatavené nebo jinak uzavřené a
s omezeným prostorem nad roztokem.
VII.1.6.3 Analytická metoda
Použitá metoda musí být specifická pro stanovení
zkušební látky při zkušebních koncentracích a může být
i kombinací vhodných analytických technik.
Použitá analytická metoda bude záviset na povaze látky
a musí být dostatečně přesná a citlivá pro zjištění
úbytku počáteční koncentrace o 10 %.
VII.1.6.4 Zkušební podmínky
Zkoušky se provádí v termostatovaném prostoru nebo za
použití termostatované lázně nastavené na zvolenou
teplotu s tolerancí +/-0,5 st.C. Teplota se udržuje a
měří s přesností na +/-0,1 st.C. Vhodnými opatřeními je
třeba zabránit fotolýze.
U snadno oxidovatelných látek je nezbytné odstranit
rozpuštěný kyslík (např. 5minutovým probubláváním
roztoku dusíkem nebo argonem před přípravou roztoku).
VII.1.6.5 Zkušební postup
VII.1.6.5.1 Předběžná zkouška
U všech látek se provede předběžná zkouška při teplotě
50 +/- 0,5 st.C pro tři hodnoty pH: 4,0, 7,0 a 9,0.
Provede se dostatečný počet měření, aby bylo možné pro
každé pH odhadnout, zda je při 50 st.C poločas (t˝) menší
než 2,4 h nebo zda po 5 dnech dojde k hydrolýze méně
než 10 %. (Lze odvodit, že tyto hodnoty odpovídají za
podmínek, které se nejčastěji vyskytují v životním
prostředí (25 st.C), poločasu kratšímu než jeden den,
resp. delšímu než 1 rok). Jestliže se v předběžném
experimentu ukáže, že při 50 st.C dojde při všech třech
hodnotách pH (4, 7, 9) za 2,4 h k hydrolýze 50 nebo
více procent zkušební látky, nebo že po 5 dnech dojde
k hydrolýze méně než 10 % zkušební látky, nejsou další
experimenty nezbytné.
V ostatních případech a pro hodnoty pH, u nichž výše
uvedené podmínky nenastanou, se provede zkouška 1.
VII.1.6.5.2 Zkouška 1
Zkouška 1 se provede při jedné teplotě, nejlépe při
50 +/- 0,5 st.C, a pokud možno za sterilních podmínek při
pH, pro něž se v předběžné zkoušce ukázala nutnost
dalších zkoušek.
Zvolí se dostatečný počet vzorků, aby byl pokryt stupeň
hydrolýzy 20 až 70 % a bylo tak možné ověřit, že jde
při specifikovaném pH o reakci pseudoprvního řádu.
Pro každé pH, při němž se zkouška 1 provede, se stanoví
řád reakce.
Odhad rychlostní konstanty při 25 st.C:
Rozhodnutí o dalším experimentálním postupu závisí na
tom, zda lze ze zkoušky 1 usuzovat na reakci
pseudoprvního řádu, či nikoliv.
Pokud nelze ze zkoušky 1 s jistotou usuzovat na reakci
pseudoprvního řádu, je třeba provést další experimenty
podle zkoušky 2.
Vyplývá-li s jistotou ze zkoušky 1, že jde o rekci
pseudoprvního řádu, provedou se další experimenty podle
zkoušky 3. (Za speciálních okolností lze vypočítat
rychlostní konstanty při 25 st.C z konstant při 50 st.C
vypočtených s použitím výsledků zkoušky 1, viz bod
3.2).
VII.1.6.5.3 Zkouška 2
Tato zkouška se provede při každém pH, pro něž se její
provedení ukázalo na základě výsledků zkoušky 1
nezbytným, a to
— buď při teplotě nižší než 40 st.C,
— nebo při dvou teplotách nad 50 st.C, které se od sebe
liší nejméně o 10 st.C.
Při každém pH a při každé teplotě, při nichž se má
provést zkouška 2, se v přiměřených intervalech zvolí
nejméně 6 bodů tak, že stupeň hydrolýzy je v oblasti 20
až 70 %.
Pro jedno pH a pro jednu teplotu se provede měření
dvakrát. Pokud se zkouška 2 provádí při dvou teplotách
nad 50 st.C, provede se měření dvakrát nejlépe při nižší
z těchto dvou teplot.
Při každém pH a při každé teplotě, při nichž se provede
zkouška 2, se podle možnosti uvede grafický odhad
poločasu (t
1/2
).VII.1.6.5.4 Zkouška 3
Tato zkouška se provede při každém pH, pro něž se její
provedení ukázalo na základě výsledků zkoušky 1
nezbytným, a to
— buď při teplotě nižší než 40 st.C,
— nebo při dvou teplotách nad 50 st.C, které se od sebe
liší nejméně o 10 st.C.
Při každém pH a při každé teplotě, při nichž se má
provést zkouška 3, se zvolí tři body, první v čase 0,
druhý a třetí při stupni hydrolýzy vyšším než 30 %;
vypočte se konstanta k
pozorov.
a poločas t1/2
.VII.2 DATA
Jdeli o reakci pseudoprvního řádu, lze vypočítat
hodnoty konstanty kpozorov. pro každé pH a každou
zkušební teplotu z grafu závislosti hodnot logaritmů
koncentrací na čase pomocí rovnice:
kpozorov. = - směrnice × 2,303 (7)
Dále je možné z rovnice (6) vypočítat t
1/2
. Podle potřeby se s použitím Arrheniovy rovnice stanoví
k25 st.C.
Pokud chování neodpovídá reakci pseudoprvního řádu, viz
bod 3.1.
VII.3 ZPRÁVA
VII.3.1 PROTOKOL O ZKOUŠCE
Protokol o zkoušce má pokud možno obsahovat následující
údaje:
— specifikaci látky;
— všechny výsledky získané s referenčními látkami;
— podstatu a podrobnosti použité analytické metody;
— pro každou zkoušku: teplotu, pH, složení pufračního
roztoku, tabulku se všemi údaji o koncentraci a
čase;
— u reakcí pseudoprvního řádu hodnoty k
pozorov.
a t1/2
,
včetně metody jejich výpočtu; — u reakce, která neodpovídá pseudoprvnímu řádu, graf
průběhu závislosti logaritmu koncentrace na čase;
— všechny informace a pozorování nezbytné pro
interpretaci výsledků.
VII.3.2 INTERPRETACE VÝSLEDKŮ
Může existovat možnost vypočítat přijatelné hodnoty
rychlostních konstant (při 25 st.C) zkušebních látek za
předpokladu, že pro homology chemické látky již
existují experimentální údaje pro aktivační energii a
za předpokladu, že lze důvodně očekávat, že aktivační
energie zkušební látky je stejného řádu.
VII.4 LITERATURA
(1) OECD, Paris 1981, Test Guideline 111, Decision of
the Council C(81), 30 final.
(2) W. Mabey, T. Mill.: Critical Review of Hydrolysis
of Organic Compounds in Water Under Environmental
Conditions. J. Phys, Chem. Ref. Data, 1978,
7 (2), 383415.
DODATEK
Pufrační roztoky
A. CLARK A LUBS
Hodnoty pH uvedené v následujících tabulkách byly
vypočteny na základě měření potenciálu za použití
Sörensenových standardních rovnic. Skutečné hodnoty pH
jsou o 0,04 vyšší než hodnoty v tabulce.
Složení pH
kaliumhydrogenftalát (0,1 mol*l-1) a HCl (0,1 mol*l-1) při 20 st.C
2,63 ml HCl + 50 ml ftalátu doplnit do 100 ml 3,8
kaliumhydrogenftalát (0,1 mol*l-1) a NaOH (0,1 mol*l-1) při 20 st.C
0,40 ml NaOH + 50 ml ftalátu doplnit do 100 ml 4,0
3,70 ml NaOH + 50 ml ftalátu doplnit do 100 ml 4,2
dihydrogenfosforečnan draselný (0,1 mol*l-1) a NaOH (0,1 mol*l-1) při 20 st.C
23,45 ml NaOH + 50 ml fosforečnanu doplnit do 100 ml 6,8
29,63 ml NaOH + 50 ml fosforečnanu doplnit do 100 ml 7,0
35,00 ml NaOH + 50 ml fosforečnanu doplnit do 100 ml 7,2
H3BO3 (0,1 mol*l-1) v KCl (0,1 mol*l-1) a NaOH (0,1 mol*l-1) při 20 st.C
16,30 ml NaOH + 50 ml kyseliny borité doplnit do 100 ml 8,8
21,30 ml NaOH + 50 ml kyseliny borité doplnit do 100 ml 9,0
26,70 ml NaOH + 50 ml kyseliny borité doplnit do 100 ml 9,2
B. KOLTHOFF A VLEESHOUWER
Složení pH
Monokaliumcitrát (0,1 mol*l-1) a NaOH (0,1 mol*l-1) při 18 st.C
(je třeba přidat malý krystalek thymolu, aby nevznikaly plísně)
2,0 ml NaOH + 50 ml citrátu doplnit do 100 ml 3,8
9,0 ml NaOH + 50 ml citrátu doplnit do 100 ml 4,0
16,3 ml NaOH + 50 ml citrátu doplnit do 100 ml 4,2
C. SÖRENSEN
Borax (0,05 mol*l-1) a HCl (0,1 mol*l-1)
Složení pH
ml ml HCl Sörensen Walbum
boraxu 18 st.C
10 st.C 40 st.C 70 st.C
8,0 2,0 8,91 8,96 8,77 8,59
8,5 1,5 9,01 9,06 8,86 8,67
9,0 1,0 9,09 9,14 8,94 8,74
9,5 0,5 9,17 9,22 9,01 8,80
10,0 0,0 9,24 9,30 9,08 8,86
Borax (0,05 mol*l-1) a NaOH (0,1 mol*l-1)
Složení pH
ml ml HCl Sörensen Walbum
boraxu 18 st.C
10 st.C 40 st.C 70 st.C
10,0 0,0 9,24 9,30 9,08 8,86
9,0 1,0 9,36 9,42 9,18 8,94
8,0 2,0 9,50 9,57 9,30 9,02
7,0 3,0 9,68 9,76 9,44 9,12
VIII. METODA PRO STANOVENÍ TOXICITY PRO ŽÍŽALY – ZKOUŠKA NA
UMĚLÉ PŮDĚ – METODA C.8 PODLE PŘÍLOHY SMĚRNICE 92/69/EHS
VIII.1 METODA
VIII.1.1 ÚVOD
V této laboratorní zkoušce se zkoušená látka přidá do
umělé půdy, do které se na 14 dní umístí žížaly. Po
této době (a nepovinně i po sedmi dnech) se vyšetří
letální účinek látky na žížaly. Zkouška je metodou
relativně krátkodobého orientačního zjištění účinku
chemických látek na žížaly při dermálním a potravním
příjmu.
VIII.1.2 JEDNOTKY A DEFINICE
LC
50
: Koncentrace látky, vyhodnocená jako hodnota, při
které v průběhu zkoušky dojde k uhynutí 50 % pokusných
zvířat.VIII.1.3 REFERENČNÍ LÁTKA
Referenční látka se používá periodicky jako prostředek
pro důkaz, že se citlivost zkušebního systému podstatně
nezměnila.
Jako referenční látka se doporučuje chloracetamid
analytické čistoty.
VIII.1.4 PRINCIP ZKOUŠKY
Půda představuje proměnlivé prostředí, takže se pro
zkoušku používá pečlivě definovaná umělá hlinitá půda.
V definované umělé půdě se chovají dospělé žížaly druhu
Eisenia foetida (viz poznámku v příloze) a exponují se
různým koncentracím zkoušené látky. Obsah nádob se 14
dní (a nepovinně i 7 dní) po začátku zkušky rozprostře
na podložku a spočítají se žížaly, které při
jednotlivých koncentracích přežijí.
VIII.1.5 KRITÉRIA KVALITY
Zkouška je navržena tak, aby byla z hlediska zkušebního
substrátu a organismů co nejreprodukovatelnější. Úhyn v
kontrolních skupinách nesmí na konci zkoušky překročit
10 %, jinak je zkouška neplatná.
VIII.1.6 POPIS ZKUŠEBNí METODY
VIII.1.6.1 Látky
VIII.1.6.1.1 Substrát pro zkoušku
Jako základní substrát pro zkoušku se používá definovaná umělá půda.
(a) Základní substrát (procenta se rozumí na bázi
suché hmotnosti):
- 10 % sfagnové rašeliny (s pH co nejblíže 5,5 až
6,0, bez viditelných zbytků rostlin a
jemně mleté),
- 20 % kaolinitického jílu, pokud možno s více
než 50 % kaolinitu,
- asi 69 % průmyslového křemenného písku
(dominantní jemný písek s více než 50 %
částic velikosti 0,05 až 0,2 mm). Pokud zkoušená
látka není dostatečně dispergovatelná ve
vodě, je třeba ponechat k dispozici pro
pozdější míšení se zkoušenou látkou 10 g na každou
zkušební nádobu,
- asi 1 % uhličitanu vápenatého (CaCO
3
), práško
vého, chemicky čistého, přidaného pro úpravu pH
na 6,0 +/- 0,5. (b) Substrát pro zkoušku:
Substrát pro zkoušku obsahuje základní substrát,
zkoušenou látku a deionizovanou vodu.
Obsah vody činí asi 25 až 42 % sušiny základního
substrátu. Obsah vody v substrátu se stanoví
vysušením vzorku na konstantní hmotnost při 105 st. C.
Klíčovým kritériem je, že mělá půda musí být
vlhčena tak, aby neobsahovala stojící vodu. Je
třeba věnovat péči mísení, aby se dosáhlo
rovnoměrného rozdělení zkoušené látky a substrátu.
působ uvedení zkoušené látky do substrátu je třeba
uvést ve zprávě.
(c) Kontrolní substrát:
Kontrolní substrát obsahuje základní substrát a
vodu. Přidává-li se aditivní činidlo, musí další
kontrola obsahovat stejné množství aditivního či
nidla
.VIII.1.6.1.2 Nádoby pro zkoušku
Skleněné nádoby o obsahu asi jednoho litru (řádně
přikryté plastovými víky, miskami nebo plastovou fólií
s otvory pro větrání), naplněné množstvím vlhkého
substrátu pro zkoušku nebo kontrolního substrátu,
ekvivalentním 500 g suchého substrátu.
VIII.1.6.2 Experimentální podmínky
Nádoby je třeba uchovávat v klimatizovaných komorách
při 20 +/- 2 oC se stálým světlem. Intenzita světla by
měla být 400 až 800 lux.
Doba trvání zkoušky je 14 dní, ale je možné nepovinně
vyhodnotit úhyn sedm dní po začátku zkoušky.
VIII.1.6.3 Pracovní postup
Zkoušené koncentrace
Koncentrace zkoušené látky se vyjadřují jako hmotnost
látky na hmotnost sušiny základního substrátu (mg.kg-
1).
Zkouška pro zjištění rozsahu koncentrací
Aby se získaly informace o vhodném rozmezí koncentrací
pro definitivní zkoušku provede se předběžná zkouška,
kterou se zjistí rozsah koncentrací, které právě
způsobují úhyn od 0 do 100 %.
Látku je třeba zkoušet při těchto koncentracích: 1000;
100; 10; 1; 0,1 mg látky.kg
-1
substrátu pro zkoušku
(jako sušina). Je-li třeba provést úplnou definitivní zkoušku, stačí
pro zkoušku pro zjištění rozsahu koncentrací jedna
zkušební skupina na každou koncentraci a jedna pro
neexponovanou kontrolu, každá o 10 žížalách.
Definitivní zkouška
Výsledky zkoušky pro zjištění rozsahu koncentrací se
použijí pro volbu nejméně pěti koncentrací, odstupňo
vaných v geometrické posloupnosti, právě pokrývajících
rozsah 0 až 100 % mortality, lišících se o konstantní
činitel nepřevyšující 1,8.
Zkoušky používající tyto řady koncentrací musí umožnit
co nejpřesnější stanovení hodnoty LC
50
a jejích mezí
spolehlivosti. V definitivní zkoušce se používají nejméně čtyři
zkušební skupiny na každou koncentraci a čtyři
neexponované kontrolní skupiny, každá o 10 žížalách.
Výledky za tyto replikované skupiny se uvedou průměrem
a standardní odchylkou.
Tam, kde úhyn 0 % a 100 % vyvolají dvě po sobě
následující koncentrace, jež jsou vůči sobě v poměru
1,8 , jsou tyto dvě hodnoty dostatečné pro identifikaci
oblasti, do které spadá LC
50
. Mísení základního substrátu a zkoušené látky
Substrát pro zkoušení musí být všude tam kde je to mož
né připraven bez jakýchkoli přídavných činidel jiných
než voda. Těsně před začátkem zkoušky se smísí emulze
nebo disperze zkoušené látky v deionizované vodě nebo
v jiném rozpouštědle se základním substrátem pro
zkoušení, nebo se na něj rovnoměrně rozstříká
rozprašovačem pro chromatografii nebo podobným rozprašo
vačem.
Je-li zkoušená látka nerozpustná ve vodě, může se
rozpustit v co nejmenším objemu vhodného organického
rozpouštědla (např. hexanu, acetonu nebo chloroformu).
K rozpuštění, dispergaci nebo emulgaci zkoušené látky
lze použít pouze činidla, která snadno těkají. Substrát
pro zkoušení je nutné před použitím odvětrat. Množství
odpařené vody je nutné nahradit. Kontrolní zkouška musí
obsahovat stejné množství všech aditivních činidel.
Není-li zkoušená látka rozpustná, dispergovatelná ani
emulgovatelná
v organických rozpouštědlech, připraví se směs 10 g
křemenného písku a množství zkoušené látky potřebné pro
přípravu 500 g zkušebního substrátu a ta se smíchá se
490 g zvlhčeného základního substrátu (hmotnost se
rozumí v sušině).
Pro každou jednotlivou vsázku použitou ve zkoušce se do
skleněné nádoby vpraví množství vlhkého substrátu pro
zkoušku, ekvivalentní 500 g sušiny, a na povrch
substrátu se umístí 10 žížal, které byly před použitím
kondicionovány po 24 hodiny v podobném vlhkém základním
substrátu, poté rychle omyty a zbaveny přebytečné vody
absorpcí filtračním papírem.
Nádoby se přikryjí plastovými víky s otvory, miskami
nebo fólií, aby se zabránilo vysychání substrátu, a
udržují se v podmínkách zkoušky po 14 dní.
Vyhodnocení je třeba provést 14 dní (a nepovinně i
sedm dní) po zahájení zkoušky. Substrát se rozprostře
na podnos ze skla nebo nerezové oceli. Žížaly se vy
šetří a stanoví se počet přežívajících jedinců. Žížaly
se považují za mrtvé, jestliže nereagují na jemné
mechanické podráždění na předním konci.
Provádí-li se vyšetření po sedmi dnech, nádoba se
znovu naplní substrátem a žížaly se znovu vloží na
povrch téhož substrátu.
VIII.1.6.4 Organizmy použité ve zkoušce
Ke zkoušce musí být použity dospělé žížaly Eisenia
foetida (viz poznámku v příloze) (alespoň dva měsíce
staré s klitellem) o hmotnosti (ve vlhkém stavu) 300
až 600 mg. (Pokud se týká metody chovu, viz příloha.)
VIII.2 VÝSLEDKY
VIII.2.1 ZPRACOVÁNÍ A VYHODNOCENÍ VÝSLEDKŮ
Uvedou se koncentrace zkoušené látky s odpovídajícím
procentem mrtvých žížal.
Jsou-li údaje vyhovující, stanoví se hodnota LC
50
a
meze spolehlivosti (p = 0,05) s použitím standardních
metod (Litchfield a Wilcoxon, 1949, nebo ekvivalentní
metoda). LC50
se udává v mg zkoušené lát ky na 1 kg
substrátu pro zkoušku (v sušině). V případech, kdy sklon křivky koncentrací je pro vý
počet LC
50
příliš strmý, stačí grafický odhad této
hodnoty. Tam, kde úhyn 0 % a 100 % vyvolají dvě po sobě
následující koncentrace, jež jsou vůči sobě v poměru
1,8 jsou tyto dvě hodnoty dostatečné pro identifikaci
rozsahu, do kterého spadá LC
50
.VIII.3 ZPRÁVA
VIII.3.1 PROTOKOL O ZKOUŠCE
Je-li to možné, má protokol obsahovat tyto informace:
- prohlášení, že zkouška byla provedena v souladu s
výše uvedenými kritérii kvality,
- o druhu provedené zkoušky (zkouška pro zjištění
rozsahu koncentrací a (nebo) definitivní zkouška),
- přesný popis experimentálních podmínek nebo konsta
tování, že zkouška byla provedena v souladu s
metodou; je nutno uvést veškeré odchylky,
- přesný popis, jak byla zkoušená látka smísena se
základním substrátem,
- informace o organismech použitých ve zkoušce (druh,
stáří, střední hmotnost a rozsah jednotlivých hod
not, podmínky chovu, dodavatel),
- metoda použitá ke stanovení LC
50
, - výsledky zkoušky včetně všech použitých údajů,
- popis pozorovaných symptomů nebo změn v chování organizmů použitých
ve zkoušce,
- úhyn v kontrolních zkouškách,
- LC
50
nebo nejvyšší zkoušená koncentrace nevyvolá
vající úhyn a nejnižší zkoušená koncentrace
vyvolávající 100 % úhyn 14 dní (a nepovinně sedm
dní) od začátku zkoušky, - grafické znázornění křivky koncentrace/odezva,
- výsledky získané s referenční látkou, ať v souvis
losti s touto zkouškou nebo dřívějších zkoušek kon
troly jakosti.
VIII.4 LITERATURA
(1) OECD, Paris, 1981. Test Guideline 207, Decision of
the Council C(81) 30 final.
(2) Edwards, C.A. a Lofty, J.R., 1977, Biology of
Earthworms, Chapman and all, London.
(3) Bouche, M.B., 1972, Lombriciens de France, Écolo
gieet Systématique, Institut National de la
Recherche Agronomique, 671 str.
(4) Litchfield, J.T., Wilcoxon, F., A simplified
method of evaluation dose effect experiments.
J. Pharm. Exp. Therap., vol. 96, 1949, str. 99
(5) Commission of the European Communities, Development
of a standardized laboratory method for assessing
the toxicity of chemical substances to earthworms,
Report EUR 8714 EN, 1983.
(6) Umweltbundesamt/Biologische Bundesanstalt für Land-
und Forstwirtschaft, Berlin, 1984, Verfah
rensvorschlag "Toxizitätstest am Regenwurm
Eisenia foetida in künstlichem Boden", in
Rudolph/Boje, Ökotoxikologie, ecomed,
Landsberg, 1986.
PŘÍLOHA
Chov žížal před zkouškou
Pro účely chovu se 30 až 50 dospělých žížal umístí do
chovné schránky s čerstvým substrátem a vyjmou se po
14 dnech. Tyto jedince je možné použít pro další chovné
vsázky. Žížaly vylíhlé ze zámotků se použijí ke
zkoušení, když jsou dospělé (v uvedených podmínkách po
dvou až třech měsících).
Podmínky chovu
Klimatizovaná komora: teplota 20 +/- 2 st. C, nejlépe s
neustálým světlem (intenzita
400 - 800 lux).
Chovné nádoby: vhodné mělké nádoby o objemu
10 až 20 l.
Substrát: Eisenia foetida je
možné chovat v různých zvířecích
exkrementech.
Jako chovné médium se doporučuje
používat směs 50 % obj. rašeliny
a 50 % obj.hovězího
nebo koňského
hnoje. Médium musí mít pH asi 6 až 7
(upraví se
uhličitanem vápenatým) a nízkou
iontovou
vodivost (méně
než 6 mmhos nebo 0,5 % koncentraci
solí).
Substrát musí
být vlhký, ale ne příliš mokrý.
Vedle výše
uvedené metody je možné používat i jiné
úspěšné postupy.
Poznámka:
Eisenia foetida existuje ve dvou odrůdách, které
někteří taxonomové rozlišili na druhy (Bouche, 1972).
Jsou si morfologicky podobné, avšak jedna, Eisenia
foetida foetida, má na článcích typické příčné
pruhování nebo páskování a druhá, Eisenia foetida
andrei, toto postrádá a má pestře červené zbarvení.
Pokud je to možné, je třeba používat Eisenia foetida
andrei. Jiné druhy je možné použít, pokud existuje
potřebná metodika.
IX. METODA PRO STANOVENÍ BIOLOGICKÉ ROZLOŽITELNOSTI – ZAHN-
WELLENSOVA ZKOUŠKA – METODA C.9 PODLE PŘÍLOHY SMĚRNICE
92/69/EHS
IX.1 METODA
IX.1.1 ÚVOD
Cílem metody je stanovení úplné biologické
rozložitelnosti ve vodě rozpustných netěkavých
organických látek statickou zkouškou, při které jsou
tyto látky vystaveny účinku vysokých koncentrací
mikroorganismů.
Při interpretaci výsledků musí být zohledněna fyzikálně-
chemická adsorbce na suspendované pevné částice.
Zkoušené látky jsou zřeďovány v koncentracích
odpovídajících hodnotám DOC nebo TOC od 50 do 400 mg.l
-1
nebo hodnotám CHSK 100 - 1000 mg.l-1
. Tyto poměrně
vysoké koncentrace umožňují dostatečně spolehlivou
analýzu.Sloučeniny s toxickými vlastnostmi mohou však proces
rozkladu zpomalit.
Mírou biologické rozložitelnosti zkoušené látky v této
metodě je úbytek rozpuštěného organického uhlíku nebo
chemická spotřeba kyslíku. Specifickými analytickými
metodami může být stanovena i primární biologická
rozložitelnost látek.
Touto metodou mohou být zkoušeny pouze organické látky,
které při koncentracích použitých ve zkoušce:
— jsou za podmínek zkoušky rozpustné ve vodě,
— mají za podmínek zkoušky nevýznamnou tenzi par,
— neinhibují bakterie,
— jsou ve zkušebním systému jen omezeně adsorbovány,
— pěněním nesnižují svou koncentraci ve zkoušeném
roztoku.
Pokud jsou stanoveny nízké nebo marginální hodnoty
biologické rozložitelnosti, je nutné pro interpretaci
výsledků znát obsah nejdůležitějších komponent
zkoušené látky.
Pro interpretaci nižších hodnot biologické
rozložitelnosti a volbu vhodných koncentrací zkoušené
látky jsou důležité rovněž informace o toxicitě
zkoušené látky.
IX.1.2 DEFINICE A JEDNOTKY
Procentuální hodnota biologického rozkladu v čase se vypočítá
podle vztahu:
CT - CB
DT (%) = [ 1 - -----------] .100
CA - CBA
kde:
DT = rozklad ( %) v čase T,
Ca = hodnoty DOC (nebo CHSK) zkoušené látky 3 h od
zahájení zkoušky (mg.l-1),
CT = hodnoty DOC (nebo CHSK) zkoušené látky v době
odběru vzorku (mg.l-1),
CB = hodnoty DOC (nebo CHSK) kontroly v době odběru
vzorku (mg.l-1),
CBA = hodnoty DOC (nebo CHSK) kontroly 3 h od zahájení
zkoušky (mg.l-1).
Stupeň rozložitelnosti se zaokrouhluje na celá
procenta.
Jako procentuální rozložitelnost je udáván procentuální
úbytek hodnot DOC
(nebo CHSK) zkoušené látky.
Rozdíl mezi hodnotami naměřenými po 3 h po zahájení
zkoušky a mezi vypočítanými a zejména však naměřenými
počátečními hodnotami, poskytuje užitečnou informaci o
rozložitelnosti zkoušené látky (viz 3.2).
IX.l.3 STANDARDNÍ LáTKY
Při posuzování rozložitelnosti nových látek mohou být v
jednotlivých případech využity referenční materiály, v
této metodice však nejsou doporučeny žádné.
IX.l.4 PRINCIP METODY
Aktivovaný kal, minerální živné médium a zkoušená
látka ve vodném roztoku jako zdroj uhlíku se smíchají v
1 - 4 l skleněné nádobě s míchadlem a aeračním
zařízením. Suspenze je míchána a aerována až 28 dní při
teplotě 20-25 st. C
v difuzním světle nebo temnu. Rozklad je sledován denně
nebo v jinak vhodně stanovených časových intervalech
prostřednictvím měření hodnot DOC (nebo CHSK) v
odebraném vzorku po jeho přefiltrování. Procentuální
hodnota biologického rozkladu v čase je definována jako
poměr mezi hodnotami DOC (nebo CHSK) v době odběru
vzorku a po 3 h od zahájení zkoušky. Výsledek je
vyjádřen graficky jako funkce času.
V případě, že se analyticky stanovují změny koncentrací
původní molekuly látky, jsou tyto změny měřítkem
primární biologické rozložitelnosti.
IX.l.5 KRITÉRIA KVALITY
Dostatečná reprodukovatelnost byla ověřena
mezilaboratorními zkouškami.
Citlivost metody je značně závislá na variabilitě
kontrolního vzorku, na poměrně malé přesnosti stanovení
množství organického uhlíku a na koncentraci zkoušené
látky v suspenzi.
IX.l.6 POSTUP ZKOUŠENÍ
IX.l.6.l Příprava
IX.l.6.1.1 Reagencie
Voda: Pitná voda s obsahem organického uhlíku menším
než 5 mg.l-1.Koncentrace vápenatých a hořečnatých
iontů nesmí překročit 2,7 mmol.l-1, jinak je nutné
jako rozpouštědlo použít deionizovanou nebo
destilovanou vodu.
Kyselina sírová p. a. 50 g.l-1
Hydroxid sodný p.a. 40 g.l-1
Minerální živné médium: v jednom litru deionizované
vody se rozpustí:
Chlorid amonný NH4Cl p.a. 38,5 g
NaH2PO4 . 2H2O p.a. 33,4 g
KH2PO4 p.a. 8,5 g
K2HPO4 p.a. 21,75 g
Tento roztok slouží zároveň jako tlumič pH.IX.l.6.1.2 Přístroje
Skleněné nádoby o objemu 1 - 4 l.
Skleněné nebo kovové míchadlo, které by mělo být
umístěno 5 - 10 cm nad dnem nádoby. Použito může být
rovněž magnetické míchadlo se 7 - 10 cm dlouhým
ramenem.
Skleněná aerační trubice o vnitřním průměru 2 - 4 mm.
Vyústění trubice by mělo být umístěno cca 1 - 10 cm nad
dnem nádoby.
Odstředivka (cca 3 550 g).
pH-metr.
Oximetr.
Papírový filtr.
Membránový filtrační přístroj.
Membránový filtr o velikosti pórů 0,45 m, který během
filtrace neuvolňuje a neabsorbuje uhlík.
Analyzátor ke stanovení obsahu organického uhlíku a
vybavení ke stanovení CHSK.
IX.1.6.1.3 Příprava inokula
Aktivovaný kal z biologické čistírny se promývá
opakovaně vodou předepsané kvality a buď se opakovaně
centrifuguje nebo sedimentuje.
Aktivovaný kal musí mít vhodné složení, tzn., že musí
obsahovat co nejvíce druhů bakteriálních kultur.
Inokulum může být namícháno z různých zdrojů (např. z
čistírny, z půdního extraktu, z říční vody, atd.).
Stanovení aktivity aktivovaného kalu je popsáno v kap.
1. 6. 2 nazvané Funkční kontrola.
IX.1.6.1.4 Příprava pracovních roztoků zkoušené látky
Do zkušební nádoby odměříme 500 ml vody, 2,5 ml.l
-1
minerálního živného roztoku a přidáme aktivovaný kal v
množství 0,2 až 1,0 g.l-1
sušiny v konečné směsi a
odpipetujeme takový objem základního roztoku zkoušené
látky, aby bylo dosaženo koncentrace rozpuštěného
organického uhlíku od 50 do 400 mg.l-1
suspenze. Odpovídající hodnoty CHSK jsou 100 až 1000
mg.l-1
. Doplníme vodou na celkový objem 1 - 4 l.
Zvolený objem je závislý na počtu odebíraných vzorků
nutných ke stanovení hodnot DOC nebo CHSK a na tom,
kolik odběrů bude vyžadovat zvolený analytický postup.
Zpravidla postačuje objem 2 l. Současně je s každou
zkušební sérií nasazena alespoň jedna kontrola, do
které je odměřen aktivovaný kal a minerální živné
médium doplněné na stejný objem jako má zkoušená směs.IX.1.6.2 Pracovní postup
Kultivační nádoby se inkubují při difusním světle nebo
v tmavé komoře při teplotě 20 - 25 oC, za stálého
míchání pomocí magnetického míchadla nebo šroubovitého
míchadla. Nádoba se provzdušňuje tlakovým vzduchem,
který je čištěn, pokud je to potřebné, vatovým filtrem
nebo přes promývačku. Musí být zajištěno, aby nedošlo k
usazování kalu a koncentrace rozpuštěného kyslíku
neklesla pod 2 mg.l
-1
. V pravidelných časových intervalech se měří pH (např.
denně) a pokud je to potřebné upravuje se na hodnotu pH
7 - 8.
Ztráty vypařováním se vyrovnávají destilovanou nebo
deionizovanou vodou vždy před odebráním vzorku. Je
účelné označit hladinu kapaliny před začátkem zkoušky a
znovu zaznamenat výšku hladiny po odebrání vzorku při
vypnuté aeraci a míchaní. První vzorky se odebírají 3 h
po zahájení zkoušky, aby aktivovaný kal dostatečně
adsorboval zkoušenou látku.
Rozklad zkoušené látky se sleduje stanovením hodnoty
DOC a CHSK
v pravidelných časových intervalech. Vzorky z nádoby se
zkoušenou látkou a z kontroly se před analýzou
filtrují na promytém papírovém filtru. Prvních 5 ml
filtrátu se vylévá. Kaly, které se špatně filtrují
mohou být odděleny 10 min odstředěním. Stanovení DOC a
CHSK se provede nejméně dvakrát. Všechny baňky se
nechají inkubovat 28 dní.
Poznámka: Vzorky, které jsou po uvedeném postupu ještě
zakalené, se filtrují na membránovém filtru, který
nesmí uvolňovat nebo adsorbovat organické látky.
Funkční kontrola aktivovaného kalu
Paralelně se ke každé sérii pokusů nasazuje referenční
nádoba s kalem, médiem, vodou a referenční látkou,
která slouží ke kontrole citlivosti aktivovaného kalu.
Doporučován je diethylenglykol.
Adaptace
V relativně krátkých časových intervalech (např. denně)
jsou prováděny analýzy a naměřené hodnoty jsou vynášeny
do grafu. Na inhibiční křivce lze zpočátku rozlišit
tzv. adaptační fázi (viz obr. 2), proto by zkouška
neměla být nasazována ke konci týdne. Jestliže na konci
normální délky zkoušky dochází znovu k adaptaci, může
být zkouška prodloužen až do konečného rozložení
zkoušené látky.
Upozornění: Pokud chcete důkladně poznat chování
aktivovaného kalu, upravte ho následujícím postupem:
Míchadlo a aerační zařízení se vypne, aby se mohl
aktivovaný kal usadit. Kapalná fáze se vypustí,
dekantovaný kal v nádobě se doplní vodou na objem 2 l,
15 min se míchá a znovu se nechá sedimentovat. Kapalná
fáze se znovu vypustí a zkouška se opakuje se
sedimentovaným kalem a stejnou zkoušenou látkou podle
kap. 1. 6. 1. 4 a 1. 6. 2. Aktivovaný kal může být
upraven také centrifugací.
Adaptovaný kal může být smíchán s čerstvým aktivovaným
kalem tak, aby bylo dosaženo koncentrace 0,2 - 1 g
sušiny na litr suspenze.
Příprava pro analýzu
Vzorky se filtrují přes promyté papírové filtry (k
promývání se používá deionizovaná voda).
Zakalené vzorky se filtrují přes membránové filtry
(0,45 m).
Ve filtrátech vzorku (prvních 5 ml filtrátu se
nepoužívá) se přístrojem na měření TOC stanoví dvakrát
koncentrace rozpuštěného uhlíku DOC . Jestliže nemůže
být filtrát analyzován v den odběru vzorku, musí být do
příštího dne uchován
v ledničce. Delší skladování se však nedoporučuje.
CHSK se ve filtrátu vzorku stanoví standardním postupem
podle této vyhlášky.
IX.2 VYHODNOCENÍ ZKOUŠKY
Koncentrace DOC a nebo CHSK se ve vzorcích stanoví
dle kap. 1. 6. 2 nejméně dvakrát. Biologická
rozložitelnost v čase t se vypočítá podle vzorce 1. 2
a její hodnota se zaokrouhluje na celá procenta. Takt
stanovená rozložitelnost se označuje jako „Biologická
rozložitelnost stanovená Zahn-Wellensovou zkuškou“.
Poznámka: Jestliže je dosaženo úplného rozložení
zkoušené látky před řádným proběhnutím zkoušky a
výsledek je potvrzen další analýzou provedenou
následující den, může být zkouška ukončena.
IX.3 ZÁVĚREČNÁ ZPRÁVA
IX.3.1 PROTOKOL O ZKOUšCE
V protokolu o zkoušce by měly být uvedeny následující
údaje:
— počáteční koncentrace látky,
— všechny informace a experimentální výsledky (název
zkoušené látky, referenční látka, kontrolní
vzorek),
— koncentrace látky po 3 h,
— inhibiční křivka s popisem,
— datum a zdroj odběru kalu, stav adaptace, použitá
koncentrace atd.,
— vědecké odůvodnění případných změn v provedení
zkoušky.
IX.3.2 INTERPRETACE VÝSLEDKŮ
Postupné ubývání DOC nebo CHSK během dnů až týdnů
naznačuje, že zkoušená látka je biologicky rozkládána.
V mnoha případech může ovlivňovat výsledky zkoušky
fyzikálně-chemická adsorbce. To lze prokázat tím, že se
zjistí úplné nebo částečné odstranění DOC nebo CHSK
během prvních tří hodin zkoušky a rozdíl mezi
supernatantem z kontroly a ze zkoušeného vzorku je
nečekaně malý.
Má-li se rozlišit úplná nebo částečná biologická
rozložitelnost od adsorbce, musí se provést další
zkoušky.
Ty mohou být provedeny více postupy, nejsprávnější je
ale použít supernatant nebo inokulum v některé zkoušce
snadné biologické rozložitelnosti (nejlépe v
respirometrické zkoušce.
Zkoušené látky, které vykazují velký úbytek DOC nebo
CHSK a nejsou ovlivněny adsorbcí lze pokládat za
biologicky rozložitelné. Částečný, neadsorbční úbytek
znamená, že látka je přinejmenším alespoň částečně
biologicky rozložitelná.
Jestliže je úbytek DOC nebo CHSK minimální nebo žádný,
mohla nastat inhibice mikroorganismů působením zkoušené
látky. Tato inhibice se může projevovat rozpuštěním
nebo úbytkem kalu nebo zákalem zkoušené suspenze. V
takových případech se zkouška opakuje s nižšími
koncentracemi zkoušené látky.
Vyšší citlivosti může být dosaženo specifickými
analytickými metodami nebo použitím látek značených
14C. Jestliže je použita zkoušená látka s 14C, je možné
stanovením 14CO
2
prokázat, že nastal rozklad zkoušené
látky. Pokud je udáván výsledek jako primární biologická
rozložitelnost, měly by být uvedeny, pokud je to možné,
změny v chemické struktuře, které způsobily snížení
obsahu výchozí, rodičovské, zkoušené látky.
Musí se také dokladovat ověření analytické metody a
výsledky stanovení v živném médiu bez přídavku zkoušené
látky.
IX.4 LITERATURA
(l) OECD Paris, 1981, Test Guideline 302 B, Beschluss
des Rates C (81) 330 Final
(2) Anhang V C.9 Abbaubarkeit. Chemischer
Sauerstoffbedarf, Richtlinie der Kommission
84/449/EWG (Amtsblatt den Europäischen
Gemeinschaften Nr. L 251 vom 19. September 1984).
PŘÍLOHA
PŘÍKLAD VYHODNOCENÍ
Organická látka: 4 - ethoxybenzoová kyselina
Teoretická koncentrace ve zkoušce: 600 mg.l-1
Teoretická DOC : 390 mg.l-1
Inokulum: městská čistírna v .....
Koncentrace: l g sušiny . l-1
Adaptace: bez adaptace
Analytika: stanovení DOC
Množství vzorku: 3 ml
Referenční látka: diethylenglykol
Toxicita zkoušené látky: žádné toxické účinky při
koncentraci menší než 1000 mg.l-1
Použitá zkouška: zkouška ve
fermentačních trubicích
------------------------------------------------------------------------------- --------
Referenční látka Zkoušená látka
Doba
zkoušky sl. p. DOC DOCn Rozklad DOC DOCn Rozklad
mg.l-1 mg.l-1 mg.l-1 % mg-l-1 mg.l-1 %
------------------------------------------------------------------------------- --------
0 - - 300 - - 390 -
3 h 4,0 298,0 294,0 2 371,6 367,6 6
1 den 6,1 288,3 282,3 6 373,3 367,2 6
2 dny 5,0 281,2 276,2 8 360,0 355,0 9
5 dnů 6,3 270,5 264,2 12 193,8 187,5 52
6 dnů 7,4 253,3 245,9 18 143,9 136,5 65
7 dnů 11,3 212,5 201,2 33 104,5 93,2 76
8 dnů 7,8 142,5 134,7 55 58,9 51,1 87
9 dnů 7,0 35,0 28,0 91 18,1 11,1 97
10 dnů 18,0 37,0 19,0 94 20,0 2,0 99
------------------------------------------------------------------------------- --------
Poznámka: DOC stanovena v triplikátech.
sl. p. = slepý pokus
Obrázek 1
Příklad křivek biologického rozkladu
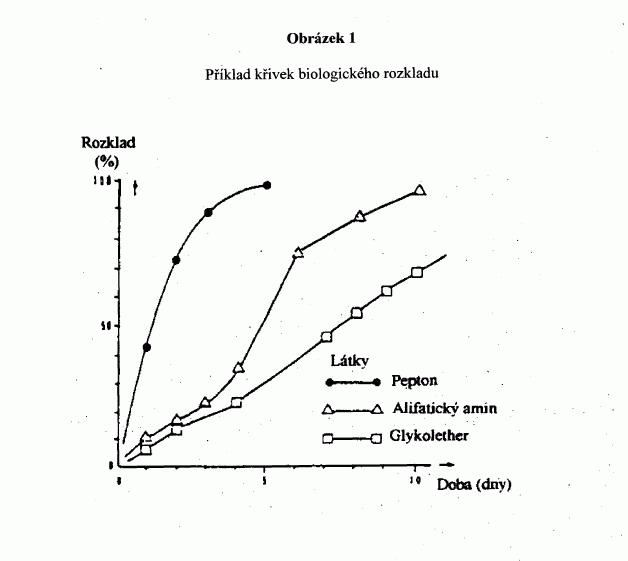
Obrázek 2
Příklad adaptace kalu
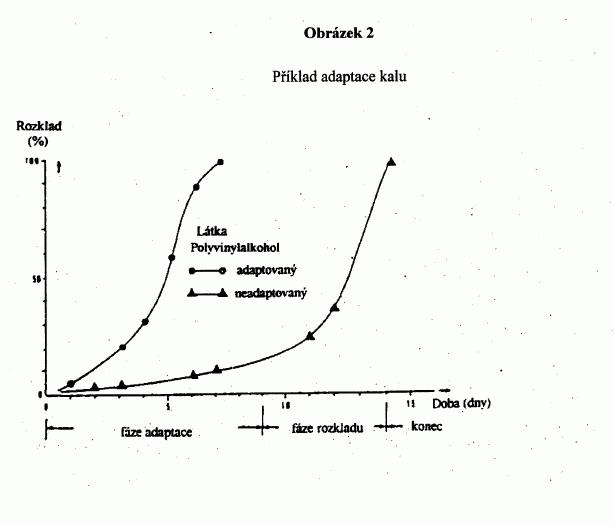
X. METODA PRO STANOVENÍ BIOLOGICKÉ ROZLOŽITELNOSTI – SIMULAČNÍ
ZKOUŠKA S AKTIVOVANÝM KALEM – METODA C.10 PODLE PŘÍLOHY
SMĚRNICE 92/69/EHS
X.1 METODA
X.1.1 ÚVOD
X.1.1.1 Obecné poznámky
Metoda je vhodná pouze pro ty organické látky, které v
používaných koncentracích:
— jsou natolik rozpustné ve vodě, aby bylo možné
připravit zásobní roztok,
— mají za podmínek zkoušky zanedbatelnou tenzi par,
— neinhibují bakterie.
Je užitečné mít informace o relativním podílu
nejdůležitějších komponent obsažených ve zkoušeném
materiálu, zvláště tehdy, když biologická
rozložitelnost dosahuje nízkých nebo marginálních
hodnot. Při interpretaci nízkých hodnot biologické
rozložitelnosti a volbě vhodné zkušební koncentrace je
potřebné znát údaje o toxicitě látky vůči
mikroorganismům.
X.1.1.2 Stanovení úplné biologické rozložitelnosti (analýza
DOC/CHSK)
Cílem metody je stanovení úplné biologické
rozložitelnosti organické látky na základě měření
úbytku zkoušené látky a vzniklých metabolitů
v koncentracích DOC více než 12 mg.1
-1
(nebo CHSK cca
40 mg.1-1
) ve zkušebním zařízení s náplní aktivovaného
kalu. Prokázalo se, že optimální je koncentrace DOC 20
mg /1. Je nutné znát obsah organického uhlíku nebo CHSK
zkoušené látky.
X.1.1.3 Stanovení primární biologické rozložitelnosti
(specifická analýza)
Cílem metody je stanovení primární biologické
rozložitelnosti zkoušené látky při koncentraci cca 20
mg/l v modelovém zařízení s aktivovaným kalem (pokud to
umožňuje analytická metoda nebo toxicita zkoušené
látky, může být použita koncentrace zkoušené látky
vyšší nebo nižší). To dovolí odhadnout primární
biologickou rozložitelnost zkoušené látky (vymizení
původní „rodičovské“ chemické struktury).
Cílem metody není stanovení stupně mineralizace
zkoušené látky.
Ke kvantitativní analýze musí být k dispozici vhodná
metoda.
X.1.2 DEFINICE A JEDNOTKY
X.1.2.1 Analýza DOC/CHSK
Úbytek látky je vyjádřen vztahem:
T - (E -Eo) (la)
DR = -------------- . 100 %
T
DR = DOC nebo CHSK úbytek v % vztažený na zkoušenou
látku při dané střední době prodlení,
T = koncentrace zkoušené látky na přítoku do
zkušební jednotky v mg.l-1 DOC nebo CHSK,
E = koncentrace DOC nebo CHSK na odtoku ze zkušební
jednotky v mg.l-1,
Eo = koncentrace DOC nebo CHSK na odtoku z kontrolní
jednotky v mg.l-1.
Rozklad je definován jako procentuální úbytek DOC nebo
CHSK při udané době zdržení, vztažený na zkoušenou
látku.X.l. 2. 2 Specifická analýza
Procentuální odstranění zkoušené látky z vodné fáze
(R
w
) během udaného času prodlení:
C1 - C0
Rw = ------- . 100 %
C1 (1b)
C1 = koncentrace zkoušené látky v přítoku do zkušebního
zařízení (v mg.l-1) stanovená specifickou analýzou,
C0 = koncentrace zkoušené látky na odtoku ze zkušebního
zařízení (v mg.l-1) stanovená specifickou analýzou.
X.l.3 REFERENČNí LÁTKY
Při zkoušení nových látek je někdy vhodné použít
referenční látku. Specifické referenční látky doposud
nejsou doporučeny.
X.l.4 PRINCIP ZKUŠEBNÍCH METOD
Ke stanovení úplné biologické rozložitelnosti se
používají dvě paralelně pracující modelová zařízení s
aktivovaným kalem (potvrzující zkouška OECD nebo
zařízení s porézní nádobkou). Zkoušená látka se přidává
na přítoku do jedné z jednotek (se syntetickou nebo s
komunální odpadní vodou), zatímco ve druhé je obsažena
pouze odpadní voda. Ke stanovení primární biologické
rozložitelnosti pomocí specifické analýzy zkoušené
látky na přítoku a odtoku je zapotřebí jedna jednotka.
Na odtoku se měří koncentrace DOC nebo CHSK nebo se
stanoví koncentrace zkoušené látky specifickou
analýzou.
DOC zkoušené látky se nestanovuje, pouze se konstatuje.
Při měření DOC nebo CHSK se vychází z toho, že rozdíl
mezi průměrnými koncentracemi na odtoku ze zkušební a z
kontrolní jednotky je způsoben nerozloženou částí
zkoušených látek.
Jestliže jsou prováděny specifické analýzy, lze
stanovovat změny koncentrace původní chemické látky
(primární biologická rozložitelnost).
Obě zařízení mohou být provozována jako „spřažená“
pomocí postupu vzájemné inokulace.
X.1.5 KRITÉRIA KVALITY
Koncentrace zkoušené látky se volí s ohledem na druh
analytické metody a její mez stanovitelnosti.
X.1.6 POPIS ZKUŠEBNÍ METODY
X.1.6.1 Příprava
X.1.6.1.1 Přístroje
Pokud se neprovádí specifická analýza, používají se dvě
modelové zkušební jednotky stejného typu. Mohou být
používány dva typy zařízení:
Potvrzující zkouška OECD
Zařízení se skládá ze zásobní nádoby (A) na syntetickou
odpadní vodu, dávkovacího čerpadla (B), aerační nádoby
(C), sedimentační nádoby (D), mamutky (E) k recirkulaci
aktivovaného kalu a sběrné nádoby vyčištěné vody (F).
Nádoby (A a F) musí být ze skla nebo z vhodné umělé
hmoty objemu nejméně 24 l. Čerpadlo (B) musí zajišťovat
konstantní přítok syntetických splašků do aerační
nádoby. Použit může být jakýkoliv vhodný systém
zajišťující stanovený přítok a koncentraci. Za
normálních podmínek je výška separátoru (D) nastavena
tak, aby objem kultivační suspenze v aerační nádobě byl
3 l. V dolní části konické části aerační nádoby je
ponořena porézní aerační krychlička. Množství
dodávaného vzduchu může být kontrolováno průtokoměrem.
Mamutka (E) je osazena tak, aby byl aktivovaný kal ze
separátoru do aktivační nádoby dopravován rovnoměrně.
Zařízení s porézní nádobkou
Porézní nádobka je vyrobena z porézní polyethylenové
fólie (tloušťka 2 mm, maximální velikost pórů 95
mikronů) stočené do válce o průměru 14 cm s konickým
dnem 45 o, obrázky 1 a 2 v příloze 2. Porézní nádobka
je umístěna v nepropustné nádobě o průměru l5 cm
zhotovené z vhodné umělé hmoty, která má nad konickou
částí odtok ve výšce 17,2 cm, čímž je
v zařízení vymezen objem 3 l. Na horním konci vnitřní
nádoby je upevněn kruhový držák tak, že mezi vnější a
vnitřní nádobou je 0,5 cm odtoková mezera.
Celé zařízení je umístěno do vodní lázně regulované
termostatem. Vzduch je přiváděn na dno vnitřní nádoby
pomocí vhodného rozvaděče.
Nádoby (A) a (E) musí být vyrobeny ze skla nebo vhodné
umělé hmoty a mají mít objem nejméně 24 l. Čerpadlo (B)
umožňuje konstantní přítok odpadních vod do aerační
nádoby. Může být použit jakýkoliv vhodný systém za
předpokladu, že zaručuje stanovený přítok a
koncentraci.
K dispozici musí být zásoba dalších porézních nádobek
jako náhrada za zanesené; zanesené nádobky se čistí
namočením na 24 hodin do roztoku chlornanu sodného a
promytím pitnou vodou.
X.l.6.1.2 Filtrace
Používají se membránové filtrační přístroje a
membránové filtry (velikost pórů 0,45 m). Membránový
filtr nesmí uvolňovat uhlík ani nesmí adsorbovat
zkoušenou látku při filtraci.
X.1.6.1.3 Odpadní voda
Může být použito buď vhodné syntetické médium nebo
komunální odpadní voda.
Příklad syntetického média:
V 1 l pitné vody se rozpustí:
pepton 160 mg,
masový extrakt 110 mg,
močovina 30 mg,
NaCl 7 mg,
CaCl2 . 2 H2O 4 mg,
MgSO4 . 7 H2O 2 mg,
K2HPO4 28 mg.
Komunální odpadní vody:
Odebírají se čerstvé každý den z přepadu mechanického
stupně čistírny,
která čistí převážně městské odpadní vody.
X.l.6.1.4 Zásobní roztok zkoušené látky
Připraví se např. l% roztok zkoušené látky, který se
bude přidávat do zkušební jednotky. Stanoví se
koncentrace zkoušené látky a určí se příslušný objem
zásobního roztoku, který je potřebné přidat k odpadní
vodě nebo dalším čerpadlem přímo do zkušební jednotky,
aby byla dosažena požadovaná zkušební koncentrace.
X.1.6.1.5 Inokulum
Poznámka: Je-li používána komunální odpadní voda není
vhodné používání inokula s malou koncentrací bakterií,
ale má se používat aktivovaný kal.
Mohou se používat inokula z různých zdrojů.
Příklady vhodného inokula:
a) Inokulum z odtoku biologické čistírny odpadních vod
Inokulum může být získáno z odtoku dobře fungující
čistírny zpracovávající převážně komunální odpadní
vody. Vzorek odtoku musí být v době mezi odběrem a
použitím uchován v aerobních podmínkách. Inokulum se
připraví filtrací vzorku vody přes hrubý filtr,
prvních 200 ml filtrátu se vylije. Až do okamžiku
použití se filtrát uchovává v aerobních podmínkách.
Inokulum musí být použito ve stejný den kdy bylo
připraveno. K inokulaci se užívá nejméně 3 ml.
b) Směsné inokulum
Inokulum odebrané z odtoku čistírny:
Viz předchozí popis.
Inokulum z půdy:
100 g zahradní zeminy (úrodná, nesterilní zemina) se
suspenduje v l l nechlórované pitné vody (nevhodné
jsou zeminy s vysokým obsahem jílu, písku a humusu).
Po zamíchání se nechá suspenze 30 minu dekantovat.
Kapalná fáze se přefiltruje, prvních 200 ml se
vylije. Filtrát se ihned provzdušňuje až do okamžiku
použití. Inokulum je možné použít pouze ten den, kdy
bylo připraveno.
Inokulum z povrchové vody:
Další díl směsného inokula se získává z
mesosaprobních povrchovým vod. Odebraný vzorek se
filtruje, prvních 200 ml se vylije. Až do okamžiku
použití se filtrát udržuje v aerobních podmínkách.
Inokulum musí být použito pouze ten den, kdy bylo
připraveno.
Směsné inokulum se získá smísením a dobrým
promícháním stejných objemových dílů všech tří
dílčích inokulí. K očkování se používají nejméně 3 ml
směsného roztoku.
c) Inokulum z aktivovaného kalu
Používá se aktivovaný kal (s obsahem suspendovaných
pevných částic do 2,5 g/l) odebraný z aerační nádrže
čistírny komunálních odpadních vod.
X.1.6.2 Postup
Zkouška se provádí při laboratorní teplotě, která se má
udržovat mezi 18 - 25 st. C.
Zkouška může být event. prováděna při nižších
teplotách (do 10 st. C). Pokud se zkoušená látka za
těchto podmínek rozkládá, nejsou zapotřebí žádná další
měření. Jestliže však při nižší teplotě rozkládána
není, musí být zkouška opakována při teplotě 18 - 25 st.
C.
X.1.6.2.1 Fáze zapracování: tvorba kalu/stabilizace kalu
Fází růstu/stabilizace kalu je období, během kterého
dochází za provozních podmínek k ustálení koncentrace
aktivovaného kalu a funkce zkušební jednotky
Rozběhová fáze začíná první vsádkou zkoušené látky a
končí dobou, kdy naměřený úbytek zkoušené látky dosáhne
relativně konstantní hodnoty. Tato fáze by neměl trvat
déle než 6 týdnů.
Hodnotící fáze je doba trvající 3 týdny od okamžiku kdy
úbytek zkoušené látky dosáhl relativně konstantní,
zpravidla vysoké, hodnoty. Pro látky, které se během
šest týdnů trvající rozběhové fáze nerozkládají nebo
jejich úbytek dosahuje nízkých hodnot se za
vyhodnocovací fázi považuje období dalších tří
následujících týdnů.
Na začátku zkoušky se zkušební jednotka(y) naplní
zkušební kapalinou s inokulem.
Zapne se provzdušňování a mamutka (při použití
zkušebního zařízení podle OECD) a zapne se dávkovací
zařízení.
Přítok odpadních vod bez zkoušené látky do aerační
nádoby se udržuje na rychlosti l l.h
-1
nebo l/2 l.h-1
;
doba zdržení tak dosáhne 3 h nebo 6 h. Intenzita provzdušňování musí být regulována tak, aby
se udržoval obsah aerační nádoby ve vznosu a obsah
rozpuštěného kyslíku neklesl pod hodnotu 2 mg.l
-1
. Pěnění směsi se zabraňuje vhodnými prostředky, které
neinhibují kal.
Kal, který se shromažďuje v horní části aerační nádoby
a u průkazné zkoušky OECD na dně sedimentační nádoby a
v cirkulačním okruhu musí být alespoň jednou za den
vracen do matečné suspenze setřením nebo jiným vhodným
způsobem.
Jestliže kal špatně sedimentuje lze zvýšit jeho hustotu
přídavkem 2 ml 5%
roztoku chloridu železitého. Přídavek je možné opakovat
podle potřeby.
Odtok ze sedimentační nádrže se shromažďuje v nádobách
E nebo F po dobu 20 - 24 hod. Před odebráním vzorku se
směs důkladně promíchá. Nádoby E a F se musí pečlivě
čistit.
Pro potřeby sledování účinnosti procesu a pro potřeby
jeho řízení se stanoví nejméně dvakrát týdně CHSK nebo
DOC zfiltrovaného průměrného vzorku výtoku ze zařízení
a filtrované směsi dávkované do zařízení. K filtraci se
používá membránový filtr s velikostí pórů 0,45 m.
Prvních 20 ml filtrátu se vylije.
Pokud se rozkladné procesy ustálí, vyrovnají se i
poklesy CHSK nebo DOC.
Sušina kalu v aerační nádobě se stanovuje dvakrát týdně
(g.l
-1
). Zařízení mohou být provozována dvěma způsoby: pokud je
sušina kalu vyšší než 2,5 g.l
-1
přebytečný kal se
vypustí nebo se denně odebere z každé nádoby 500 ml
suspenze, takže střední doba zdržení kalu v zařízení je
6 dní. Jestliže jsou naměřené a hodnocené parametry (účinnost
metody stanovená na základě úbytku CHSK nebo DOC,
koncentrace kalu, schopnost sedimentace kalu, zákal
kapalné fáze v sedimentační nádobě atd.) dvou jednotek
dostatečně stabilní, může být zahájeno přidávání
zkoušené látky dle kap. 1. 6. 2. 2 do nátoku do jedné z
jednotek.
Alternativně může být zkoušená látka přidávána na
začátku fáze růstu kalu (1. 6. 2. 1), zvlášť tehdy,
když je jako inokulum používán aktivovaný kal.
X.1.6.2.2 Pracovní postup
Za dodržování podmínek pro rozběhovou fázi se do
přítoku do zkušebního zařízení přidává zásobní roztok
zkoušené látky (cca 1 %), aby obsah DOC v suspenzi byl
v rozmezí 10 - 20 mg.l
-1
nebo CHSK 40 mg.l-1
.
Zásobní roztok se buď denně přimíchává do odpadní vody
nebo se přivádí pomocí čerpadla přímo do suspenze.
Koncentrace se postupně zvyšuje až na požadovanou
hodnotu. Vyzkoušeny mohou být i vyšší koncentrace než
udává předchozí odstavec, pokud nemá zkoušená látka na
aktivovaný kal toxické účinky. Do kontrolní jednotky se dávkuje pouze odpadní voda bez
zkoušené látky. Z odtoku se odebírají vzorky pro
analýzu a filtrují se na membránovém filtru s velikostí
pórů 0,45 m. Prvních 20 ml filtrátu se vylévá.
Filtráty vzorků musí být analyzovány v den odběru nebo
musí být konzervovány (např. přídavkem 0,05 ml 1%
chloridu rtuťnatého na 10 ml filtrátu, uložením na 24 h
při teplotě 2 - 4 st. C nebo při -18 st. C na delší dobu).
Doba trvání rozběhové fáze od okamžiku přídavku
zkoušené látky by neměla překročit 6 týdnů.
Vyhodnocovací fáze by neměla být kratší než 3 týdny,
aby bylo možné provést 14 - 20 stanovení nutných k
vyhodnocení zkoušky.
Spřažená zařízení
Zařízení jsou spřažena tak, že je mezi nimi 1x denně
vyměňováno 1,5 l suspenze (včetně kalu) z aeračních
nádob. Dochází-li k silné adsorbci zkoušené látky,
odebere se 1,5 l kapalné fáze ze sedimentační nádoby a
přidává se do aerační nádoby druhého zařízení.
X.1.6.2.3 Analytika
Ke sledování chování zkoušené látky se používají dvě
metody stanovení:
DOC a CHSK.
Hodnoty DOC se stanoví dvakrát pomocí analyzátoru
uhlíku a CHSK se stanoví podle literatury (2).
Specifická analýza
Koncentrace zkoušené látky se stanoví vhodnou
analytickou metodou. Je-li to možné, stanoví se zvlášť
množství látky adsorbované na aktivovaný kal.
X.2 DATA A VYHODNOCENÍ
X.2.1 SPŘAŽENÁ ZAŘÍZENÍ
Pokud je používáno spřažené zařízení, počítá se denně
stupeň odstranění, DR, postupem podle 1. 2. 1.
Tyto denní hodnoty se opraví na hodnotu Dr
c
,
zohledněním přenosu materiálu při očkování. Tento
výpočet se provádí dle rovnice (2) pro střední dobu
prodlení 3 hodiny a podle rovnice (3) pro střední dobu
prodlení 6 hodin.
8 100
DRc - --- DR - ----- (2)
7 7
4 100
DRc - --- DR - ----- (3)
3 3
Ze získaných hodnot se vypočítá jejich průměr a dále
standardní odchylka podle rovnice (4)
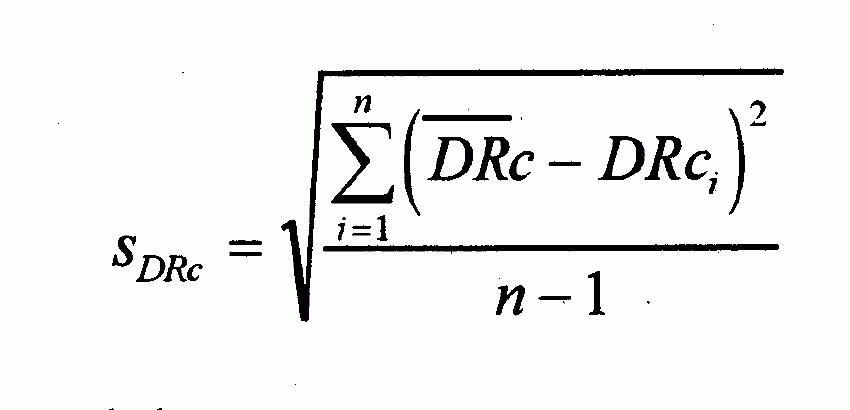
(4)
kde:
sL = standardní odchylka,
---
DRc = průměr hodnot DRc,
n = počet stanovení.
Odlehlé hodnoty DRc se eliminují vhodnou statistickou
metodou, např. Nalimovou metodou (6) pro 95% hladinu
významnosti, průměr a standardní odchylka se potom
vypočtou s vyloučením odlehlých hodnot Drc:
Výsledek se vyjádří dle (5) :
---
DRc = DRc +/- Tn-1;alfa
---------- (5)
odmocnina n
kde
tn-1; = tabulková hodnota t pro n dvojic hodnot e a
Eo a statistickou mez spolehlivosti P (P=1-), kde P =
95% (l).
Výsledkem je průměr s udanými mezemi tolerance pro 95%
hladinou významnosti případně s udanou standardní
odchylkou, počtem dat hodnot DRc bez odlehlých hodnot a
počtem odlehlých hodnot.
Např.
DRc = 98,6 +/- 2,3% úbytku DOC,
s = 4,65% úbytku DOC,
n = 18,
x = počet odlehlých hodnot.
X.2.2 NESPŘAŽENÁ ZAŘÍZENÍ
Provozní výkon zařízení může být ověřen následovně:
% odstranění CHSK nebo DOC =
CHSK nebo DOC odp. vody - CHSK nebo DOC výtoku
= ----------------------------------------------- . 100
CHSK nebo DOC odp. vody
Vynášením denně naměřených úbytků do grafu se zdůrazní
všechny trendy, např. adaptace.X.2.2.1 Využití stanovení CHSK/DOC
Z denně naměřených hodnot se podle kap. 1.2.1 vypočítá
procentuální úbytek DR.
Z řady hodnot DR se spočítá jejich průměr a podle
rovnice (6) standardní odchylka:
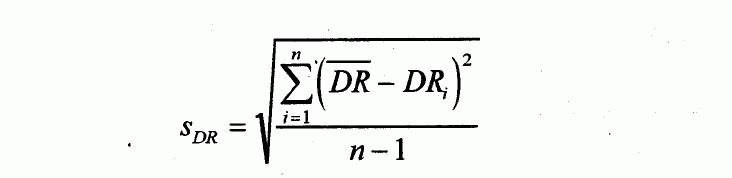
(6)
kde
sL = standardní odchylka hodnot Dri,
---
DR = průměr hodnot Dri ,
n = počet stanovení.
Odlehlé hodnoty DR se eliminují vhodnou statistickou
metodou např. podle Nalimova (6) při 95% hladině
významnosti, střední hodnota a standardní odchylka jsou
potom znovu vypočítány s vyloučením odlehlých hodnot
DR.
Výsledná hodnota se počítá dle rovnice (7)
---
DRc = DRc +/- Tn-1;alfa
---------- (7)
odmocnina n
kde
tn-1;alfa - tabulková hodnota t pro n dvojic hodnot e
a Eo a statistickou n mez spolehlivosti P (P=1-alfa), kde
P = 95 % (l).
Výsledkem je průměr s mezemi tolerance při 95% hladině
významnosti s udanou standardní odchylkou, počtem dat
hodnot DR bez odlehlých hodnot a počtem odlehlých
hodnot.
Např.:
Dr = (98,6 +/- 2,3%) úbytku DOC,
s = 4,65% úbytku DOC,
n = 18,
x = počet odlehlých hodnot.
X.2.2.2 Použití výsledků specifické analýzy
Odstranění zkoušené látky z vodné fáze (Rw) v % se
počítá podle 1. 2. 2.
X.3 ZÁVĚREČNÁ ZPRÁVA
X.3.1 PROTOKOL O ZKOUŠCE
V protokolu o zkoušce by měly být uvedeny pokud je to
možné následující údaje:
— provozní podmínky, které jsou zaznamenány do
formuláře uvedeného v příloze č. 3 této metody;
— druh použitého zkušebního zařízení (zařízení pro
průkaznou zkoušku OECD nebo zařízení s porézní
nádobkou);
— způsob provozování zařízení: spřažená nebo nespřažená
zařízení;
— druh odpadních vod: syntetické nebo komunální
odpadní vody, u komunálních odpadních vod datum a
místo odběru;
— druh inokula, datum a místo odběru;
— popis použitých analytických metod, pokud byly
prováděny specifické analýzy;
— grafické vyjádření závislosti úbytku CHSK nebo DOC na
čase ve fázi rozběhové a vyhodnocovací;
— výsledek stanovení obsahu zkoušené látky
prostřednictvím CHSK nebo DOC v zásobním roztoku;
— při provádění specifické analýzy: grafické vyjádření
procentuálního úbytku zkoušené látky z kapalné fáze
během rozběhové a vyhodnocovací fáze v závislosti
na čase;
— střední úbytek DOC nebo CHSK zkoušené látky a
standardní odchylka výsledků získaných během
vyhodnocovací fáze, kdy úbytek zkoušené látky je
konstantní;
— grafické vyjádření koncentrace aktivovaného kalu v
závislosti na čase;
— poznámky týkající se aktivovaného kalu (odstraňování
přebytečného kalu ze zařízení, tvorba shluků,
použití chloridu železitého atd.);
— proměřované koncentrace zkoušené látky;
— výsledky analýz kalu;
— všechny informace o zkoušené látce a o referenční
látce, pokud byla použita;
— vědecké zdůvodnění všech odchylek a změn metody.
X.3.2 INTERPRETACE VÝSLEDKŮ
Příčinou nízké hodnoty úbytku zkoušené látky z vodné
fáze může být inhibice mikroorganismů způsobená touto
látkou. Projevuje se to především rozpouštěním a
ztrátou kalu, zakalováním kapalné fáze a snížením
účinnosti odstraňování CHSK nebo DOC v zařízení.
Někdy hraje roli fyzikálně-chemická adsorbce. Vztah
mezi biologickým působením na látku a její fyzikálně-
chemickou adsorpcí je možné rozlišit po odpovídající
desorpci.
K rozlišení úplného nebo částečného biologického
rozkladu od adsorbce je nutno provést další zkoušky.
Nabízí se zde více možností. Nejlepším postupem je
použití kapalné fáze ze sedimentační nádoby jako
inokula v některé ze zkoušek snadné biologické
rozložitelnosti (nejlépe v respirometrické zkoušce).
Vysoké hodnoty úbytku DOC nebo CHSK jsou zpravidla
způsobovány biologickým rozkladem, nízké hodnoty úbytku
naproti tomu nelze odlišit od jiných mechanizmů
odstranění látky. Pokud např. rozpustná sloučenina
vykazuje stupeň adsorbce 98 % a denně je odstraňováno
10 % kalu, dochází až ke 40 % odstranění látky v
tomto kalu. Je-li denně odstraňováno 30 % kalu, může
eliminace na základě adsorbce a odstranění kalu
stoupnout na 65 % (4):
Při používání specifických analýz je třeba brát na
zřetel vliv struktury látky na specifickou analýzu.
Úbytek látky stanovený specifickou analýzou nemůže být
interpretován jako mineralizace látky.
X.4 LITERATURA
(l) OECD, Paris 1981, Test Guideline 303 A, Decision of
the Council C (81) 30 final.
(2) Annex V C9 Degradation Test - Chemical Oxygen
Demand, Commission Directive 84/449/EEC,Official
Journal of the European Communities, No L 251,19.
9. 1984).
(3) H. A. Painter and E. F. King, WRC Porous Pot method
for asessing biodegradability. Technical report
TR7O. June 1978, Water Research Center, Velká
Británie.
(4) Wierich P. and Gerike P., The Fate of Soluble,
Recalcitrant, and Absorging Compounds in Activated
Sludge Plants, Ecotoxicology and Enviromental
Safety, Vol 5, Nr. 2 - June 1981, str. 161 - 171.
(5) Council Directives 82/242/EEC und 82/243/EEC,
Official Journal of the European Communities, No
L109, 22. 4. 1982, amending Council Directives
73/404/EEC und 73/405/EEC on biodegradability of
detergents, Official Journal of the European
Communities, No L347, 17. 12. 1973.
(6) Streuli, H., Fehlerhafte Interpretation und
Anwendung von Ausreissetest, insbesondere bei
Rindversuchen zur Überprüfung analytisch-chemischer
Untersuchungsmethoden, Fressenius-Zeitschrift für
Analytische Chemie (1980), str. 406 - 408.
PŘÍLOHA 1
Obrázek 1
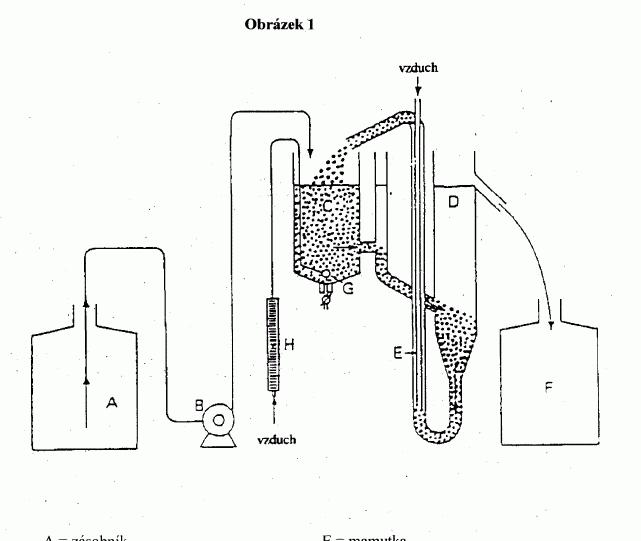
A = zásobník E = mamutka
B = dávkovací zařízení F = zásobník na výtok
C = aerační komora (objem 3 litry) G = aerátor
D = sedimentační nádoba H = průtokoměr (nepovinně)
Obrázek 2
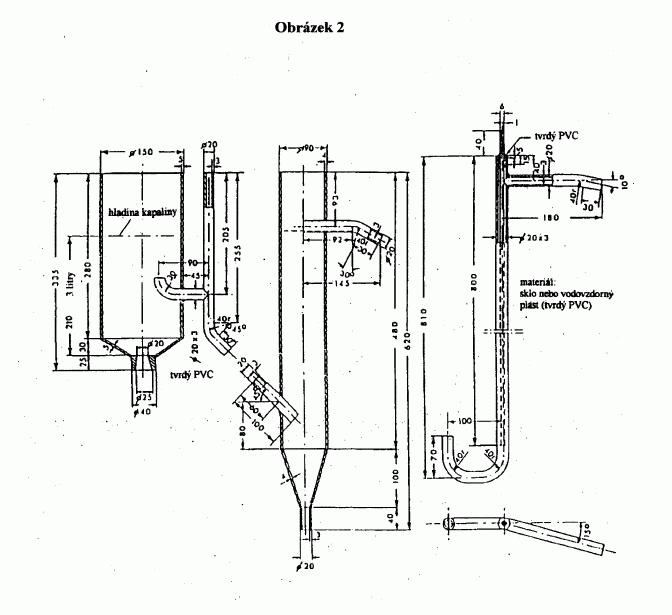
PŘÍLOHA 2
Obrázek 1
Zařízení používané pro stanovení biologické rozložitelnosti
A = zásobník E = zásobník na výtok
B = dávkovací čerpadlo F = vzduchovací kámen
C = porézní aerační nádobka G = rotametr
D = vnější nepropustná nádoba
Obrázek 2
Detaily třílitrové vzduchovací porézní nádobky
PŘÍLOHA 3
Provozní podmínky simulační zkoušky s aktivovaným kalem
Označ v každé skupině
Zařízení:
průkazná zkouška OECD
zařízení s porézní nádobkou
Způsob provozu:
samostatná jednotka
spřažená zařízení
nespřažená zařízení
Přeočkování:
žádné
aktivovaným kalem
kapalnou fází vzniklou odstraněním sedimentu
Střední doba zdržení:
3 hodiny
6 hodin
Živné médium:
komunální odpadní voda
syntetická odpadní voda
Inokulum:
z čistírny odpadních vod
směsné inokulum
aktivovaný kal
Přidávání zkoušené látky:
na začátku
postupně
po vytvoření kalu
Analýzy:
specifická
CHSK
DOC
XI. METODA PRO STANOVENÍ BIOLOGICKÉ ROZLOŽITELNOSTI – ZKOUŠKA
INHIBICE DÝCHÁNÍ AKTIVOVANÉHO KALU – metoda C.11 podle přílohy
směrnice 92/69/EHS
XI.1 METODA
XI.1.1 ÚVOD
Popsaná metoda hodnotí vliv zkoušené látky na mi
kroorganizmy měřením intenzity jejich dýchání za defino
vaných podmínek v přítomnosti různých koncentrací
zkoušené látky.
Účelem této metody je poskytnout rychlou vyhledávací
metodu, kterou je možné určit látky, které mohou
nepříznivě ovlivnit aerobní mikrobiální čistírny vod,
a naznačit vhodné koncentrace zkoušených látek, které
nejsou inhibující a které je možno použít ve zkouškách
biologické rozložitelnosti.
Definitivní zkoušce může předcházet zkouška pro nale
zení pracovní oblasti. Může poskytnout informace o
oboru koncentrací, které je možné použít v hlavní
zkoušce.
Do schématu zkoušky jsou zařazeny dvě kontroly, jedna
na začátku a druhá na konci řady pokusů. Každou dávku
aktivovaného kalu je také nutno kontrolovat s použitím
referenční látky.
Tato metoda se nejsnáze aplikuje na látky, které díky
své rozpustnosti a nízké těkavosti zůstávají ve vodě.
U látek s nízkou rozpustností v médiích používaných ve
zkoušce může být nemožné stanovit EC
50
. Pokud má zkoušená látka sklon k rozkladu oxidační
fosforylací mohou výsledky založené na absorpci kyslíku
vést k nesprávným závěrům,
Pro provedení zkoušky je užitečné znát následující
informace:
— rozpustnost ve vodě,
— tlak par,
— strukturní vzorec,
— čistota zkoušené látky.
Doporučení:
Aktivovaný kal může obsahovat potenciálně patogenní
organizmy a je třeba s ním zacházet opatrně.
XI.1.2 DEFINICE A JEDNOTKY
Respirační rychlost je spotřeba kyslíku mikroorganizmy
odpadních vod v aerobním kalu, obecně vyjádřená jako
mg O
2
na 1 mg kalu za hodinu. Pro výpočet inhibičního účinku zkoušené látky při
určité koncentraci se respirační rychlost vyjadřuje
jako procento průměrné hodnoty dvou kontrolních
respiračních rychlostí:
2Rs
(1 - ------------- ) = %inhibice
RC1 + RC2
kde:
Rs = rychlost spotřeby kyslíku při použité koncentraci
zkoušené látky,
Rc1 = rychlost spotřeby kyslíku v kontrolní zkoušce 1,
Rc2 = rychlost spotřeby kyslíku v kontrolní zkoušce 2.
EC50 v této zkoušce je koncentrace zkoušené látky, při
které respirační rychlost činí 50 % hodnoty
vycházející z kontrolní zkoušky za podmínek popsaných v
této metodě.XI.1.3 REFERENČNÍ LÁTKY
Jako referenční látku se doporučuje používat známý
inhibitor dýchání 3,5-dichlorfenol. Ověřením EC
50
u
každé dávky aktivovaného kalu by mělo být
zkontrolováno, že kal není abnormálně citlivý.XI.1.4 PRINCIP ZKUŠEBNÍ METODY
Rychlost dýchání aktivovaného kalu vyživovaného
standardním množstvím syntetické odpadní vody se měří
po době kontaktu 30 minut, 3 hodin nebo v obou časech.
Měří se také rychlost dýchání téhož aktivovaného kalu
v přítomnosti různých koncentrací zkoušené látky za
jinak stejných podmínek. Inhibiční efekt zkoušené
látky při určité koncentraci se vyjadřuje jako procento
průměrné rychlosti dýchání ze dvou kontrolních pokusů.
Hodnota EC
50
se vypočítá ze stanovení při různých
koncentracích.XI.1.5 KRITÉRIA KVALITY
Výsledky zkoušky jsou platné, jestliže:
— respirační rychlosti dvou kontrolních pokusů se od
sebe liší nejvýše o 15 %,
— EC
50
(pro 30 minut nebo pro 3 hodiny) 3,5-
dichlorfenolu leží v přijatém rozmezí 5 - 30 mg.l-1
.XI.1.6 POPIS ZKUŠEBNÍ METODY
XI.1.6.1 Činidla
XI.1.6.1.1 Roztoky zkoušené látky
Roztoky zkoušené látky se připravují čerstvé na
začátku studie s použitím zásobního roztoku. Použije-li
se níže popsaný postup, je vhodná koncentrace
zásobního roztoku 0,5 g.l
-1
.XI.1.6.1.2 Roztok kontrolní látky
Roztok 3,5-dichlorfenolu lze připravit například
rozpuštěním 0,5 g 3,5-dichlorfenolu v 10 ml 1 M NaOH,
zředěním destilovanou vodou přibližně na 30 ml,
přidáním 0,5 M H2SO4 do bodu začínajícího srážení ( je
třeba asi 8 ml 0,5 M H2SO4) a konečným doplněním směsi
destilovanou vodou na 1 litr. pH musí potom ležet mezi
7 a 8.
XI.1.6.1.3 Syntetická odpadní voda
Používaná syntetická odpadní voda se připraví
rozpuštěním následujícího množství látek v 1 litru
vody:
— 16 g peptonu,
— 11 g masového extraktu,
— 3 g močoviny,
— 0,7 g NaCl,
— 0,4 g CaCl
2
.2H2
O, — 0,2 g MgSO
4
.7H2
O, — 2,8 g K
2
HPO4
. Poznámka 1: Tato syntetická odpadní voda má stonásobnou
koncentraci oproti vodě popsané v technické zprávě
OECD "Návrh metody stanovení biologické rozložitelnosti
povrchově aktivních látek používaných v syntetických
detergentech" (11.6.1976), s přídavkem
monohydrogenfosforečnanu draselného.
Poznámka 2: Nepoužije-li se připravené médium ihned,
je nutné je přechovávat v temnu při 0 - 4 st. C ne déle než jeden týden za
podmínek, které nezpůsobují žádné změny v jeho složení.
Médium je také možné před uschováním sterilizovat, nebo
je možné pepton a masový extrakt přidat krátce před
provedením zkoušky. Před použitím je nutné médium
důkladně promíchat a upravit pH.
XI.1.6.2 Aparatura
Měřicí aparatura: Přesná konstrukce není podstatná.
Musí však mít volný prostor nad kapalinou a sonda musí
přesně zapadat do hrdla odměrné baňky.
Z běžného laboratorního vybavení je třeba zejména toto:
— měřicí přístroje,
— provzdušňovací zařízení,
— měřič pH a monitorovací zařízení,
— kyslíková elektroda.
XI.1.6.3 Příprava inokula
Jako mikrobiální inokulum pro zkoušku se používá akti
vovaný kal z čistírny odpadních vod čistící převážně
domovní odpadní vody.
Je-li to nutné, je možné při dodání kalu do laboratoře
odstranit hrubé částice krátkodobým usazením (např.
15 minut) a dekantovat horní vrstvu jemnějších tuhých
částic pro použití. Alternativně je možné kal po
několik sekund.promíchat.
Lze-li mimoto předpokládat, že je přítomna látka
mající inhibiční účinek, je nutné kal promýt vodovodní
vodou nebo izotonickým roztokem. Po zcentrifugování se
roztok nad usazeninou dekantuje (tento postup se
opakuje třikrát).
Malé množství kalu se zváží a vysuší. Z výsledku je
možné vypočítat množství vlhkého kalu, které je nutné
suspendovat ve vodě, aby se získal aktivovaný kal
v oblasti koncentrací suspendovaných tuhých látek ve
směsné kapalině mezi 2 a 4 g.l
-1
. Dodrží-li se níže
doporučený postup získá se zkušební médium s
koncentrací kalu 0,8 a 1,6 g.l-1
. Není-li možné kal použít v den kdy byl shromážděn
přidá se ke každému litru aktivovaného kalu, při
praveného tak, jak je popsáno výše, 50 ml syntetické
odpadní vody, potom se provzdušňuje přes noc při 20
+/- 2 st. C. Poté se udržuje za provzdušňování pro
použití během dne. Před použitím se zkontroluje pH a
je-li třeba, upraví se na 6 - 8. Obsah suspendovaných
tuhých látek ve směsné kapalině je třeba stanovit, jak
je popsáno v předchozím odstavci.
Požaduje-li se použití stejné dávky kalu v následující
dny (nejvýše po čtyři dny), přidává se na konci každého
pracovního dne dalších 50 ml syntetické odpadní vody
na litr kalu.
XI.1.6.4 Provedení zkoušky
Trvání/doba kontaktu: 30 minut a (nebo) 3 hodiny,
během kterých probíhá provzdušňování
Voda: Pitná voda (v případě potřeby zbavená chlóru)
Přívod vzduchu: Čistý vzduch, prostý oleje. Průtok
0,1 - 1 l.min-1.
Měřicí aparatura: Baňka s plochým dnem, jaká se
používá pro stanovení BSK.
Měřič obsahu kyslíku: Vhodná kyslíková elektroda, se
zapisovačem.
Živný roztok: Syntetická odpadní voda (viz výše).
Zkoušená látka: Roztok zkoušené látky se připraví
čerstvý na začátku zkoušky.
Referenční látka: např. 3,5-dichlorfenol (nejméně tři
koncentrace)
Kontrolní zkouška: Naočkovaný vzorek bez zkoušené
látky
Teplota: 20 +/- 2 st. C
Dále je uveden navržený experimentální postup, kterého
je možné použít jak pro zkoušenou, tak pro referenční
látku, pro dobu kontaktu tři hodiny:
Používá se několika nádob (např. jednolitrových
kádinek).
Je třeba použít alespoň pět koncentrací, odstupňovaných
o konstantní faktor nepřevyšující pokud možno 3,2.
V okamžiku "0" se 16 ml syntetické odpadní vody doplní
vodou na 300 ml. Přidá se 200 ml mikrobiálního inokula
a výsledná směs (500 ml) se převede do první nádoby
(první kontrola C1).
Nádoby, používané v pokusu, je nutné nepřetržitě
provzdušňovat, aby bylo zaručeno, že koncentrace
rozpuštěného kyslíku nepoklesne pod 2,5 mg.l
-1
a aby
těsně před měřením rychlosti dýchání činila
koncentrace kyslíku přibližně 6,5 mg.l-1
. V okamžiku "15 minut" (15 minut je libovolně zvolený,
avšak vhodný interval) se opakuje totéž až na to, že
se k 16 ml syntetické odpadní vody před doplněním vodou
na 300 ml a přidáním mikrobiálního inokula na celkový
objem 500 ml přidá 100 ml zásobního roztoku zkoušené
látky. Tato směs se pak převede do druhé nádoby a
provzdušňuje se jako výše. Tento postup se opakuje v 15-
minutových intervalech s různými objemy zásobního
roztoku zkoušené látky, čímž se získá řada nádob
obsahujících různé koncentrace zkoušené látky. Nakonec
se připraví druhá kontrolní nádoba.
Po třech hodinách se zaznamená pH, dobře promíchaný
vzorek obsahu první nádoby se převede do měřicí
aparatury a v době do 10 minut se změří rychlost
dýchání.
Stanovení se opakuje u obsahu každé z nádob v
15minutových intervalech tak, že doba kontaktu v každé
nádobě je tři hodiny.
Referenční látka se zkouší na každé dávce mikrobiálního
inokula týmž způsobem.
Mají-li se měření provádět po 30 minutách kontaktu, je
třeba použít jiného režimu (např. použití více než
jednoho měřiče kyslíku).
Vyžaduje-li se měření chemické spotřeby kyslíku,
připraví se další nádoby, obsahující zkoušenou látku,
syntetickou odpadní vodu a čistou vodu, ale ne
aktivovaný kal. Spotřeba kyslíku se měří a zaznamená po
době provzdušňování 30 minut a (nebo) tři hodiny (doba
kontaktu).
XI.2 VÝSLEDKY A VYHODNOCENÍ
Rychlost dýchání se vypočítá ze záznamu zapisovače mezi
přibližně 6,5 mg.l
-1
a 2,5 mg.l-1
, nebo za
desetiminutovou periodu, je-li rychlost dýchání nízká.
Část respirační křivky, ze které se vyhodnocuje
rychlost dýchání, musí být lineární. Jestliže rychlosti dýchání v obou kontrolních pokusech
neleží v rozmezí 15 % od sebe navzájem, nebo EC
50
(za
30 minut nebo tři hodiny) referenční látky neleží v
akceptovaném rozmezí (5 - 30 mg.l-1
pro 3,5-
dichlorfenol), je zkouška neplatná a musí se opakovat. Pro každou zkušenou koncentraci (viz bod 1. 2) se
vypočte inhibice v %. Inhibice v % se vynese proti
koncentraci na logaritmicko-normálním (nebo
logaritmicko-pravděpodobnostním) papíru a odečte se
hodnota EC
50
. Standardními postupy je možné stanovit pro hodnoty
EC
50
95% meze spolehlivosti.XI.3 ZPRÁVA
XI.3.1 PROTOKOL O ZKOUšCE
Je-li to možné, má protokol o zkoušce obsahovat tyto
informace:
— zkoušená látka: chemické identifikační údaje,
—- systém použitý při zkoušce: zdroj, koncentrace a
veškerá předběžná úprava aktivovaného kalu,
— experimentální podmínky:
— pH reakční směsi před měřením respirace,
— teplota při zkoušce,
— ba trvání zkoušky,
— referenční látka a její změřená EC
50
, — abiotická spotřeba kyslíku (pokud k ní dochází).
— výsledky:
— veškeré naměřené hodnoty,
— křivka inhibice a metoda výpočtu EC
50
, — EC
50
a je-li možné 95% meze spolehlivosti, EC20
a EC80, — veškerá pozorování a veškeré odchylky od této
zkušební metody, které mohly ovlivnit výsledek.
XI.3.2 INTERPRETACE VÝSLEDKŮ
Hodnotu EC
50
je třeba považovat pouze za orientační
hodnotu pravděpodobné toxicity zkoušené látky buď při
zpracování odpadních vod aktivovaným kalem, nebo pro
mikroorganizmy v odpadních vodách, protože složité
interakce, ke kterým dochází v životním prostředí,
nelze přesně simulovat laboratorní zkouškou. Mimoto,
zkoušené látky, které mohou mít inhibiční účinky na
oxidaci amoniaku, mohou také způsobovat atypické
inhibiční křivky. Proto je nutné interpretovat tyto
křivky opatrně.XI.4 LITERATURA
(1) International Standard ISO 8192-1986.
(2) Broecker, B., Zahn, R., Water Research 11, 1977,
str. 165
(3) Brown, D., Hitz, H.R., Schaefer, L., Chemosphere
10, 1981, str. 245
(4) ETAD (Ecological and Toxicological Association of
Dyestuffs Manufacturing Industries - Ekologická a
toxikologická asociace průmyslu výroby barviv),
Recommended Method No 103, také popsáno v:
(5) Robra, B., Wasser/Abwasser 117, 1976, str. 80
(6) Schefer, W., Textilveredlung 6, 1977, str. 247
(7) OECD, Paris, 1981, Test Guideline 209, Decision
of the Council C(81) 30 final.
XII. METODA PRO STANOVENÍ BIOLOGICKÉ ROZLOŽITELNOSTI
– MODIFIKOVANÁ ZKOUŠKA SCAS – METODA C.12 PODLE PŘÍLOHY SMĚRNICE
92/69/EHS
XII.1 METODA
XII.1.1 ÚVOD
Cílem této metody je hodnocení potenciální úplné
biologické rozložitelnosti netěkavých organických látek
rozpustných ve vodě, jsou-li vystaveny poměrně vysokým
koncentracím mikroorganizmů po dlouhé časové období.
Životaschopnost mikroorganizmů se udržuje po tuto dobu
denními přídavky živin z usazené odpadní vody. (Pro
potřebu během víkendů lze odpadní vodu přechovávat při
4 oC. Alternativně je možné použít syntetickou odpadní
vodu podle potvrzující zkoušky OECD.)
Při interpretaci výsledků (viz 3. 2) je nutné brát
v úvahu, že může docházet k fyzikálně-chemické
adsorpci na suspendovaných tuhých látkách.
V důsledku dlouhé doby zdržení kapalné fáze (36 hodin)
a průběžného přidávání živin nesimuluje zkouška
podmínky existující v čistírně odpadních vod. Výsledky
získané při pokusech s různými látkami ukazují, že
zkouška má vysoký potenciál biologického rozkladu.
Podmínky poskytované zkouškou jsou vysoce příznivé pro
výběr a adaptaci mikroorganizmů schopných rozkládat
zkoušenou látku. (Postup je možné použít také k
získávání aklimatizovaných inokulí pro použití v
jiných zkouškách.)
V této metodě se používá k hodnocení výsledné bio
logické rozložitelnosti zkoušené látky hodnota
koncentrace rozpuštěného organického uhlíku (DOC). DOC
se doporučuje raději stanovit po okyselení a přečištění
než jako rozdíl C
celk.
- Canorg
. .Současné použití specifické analytické metody může
umožnit určení primárního rozkladu látky (úbytek
výchozí chemické struktury).
Metoda je použitelná pouze pro ty organické látky,
které v koncentracích používaných ve zkoušce:
— jsou rozpustné ve vodě (alespoň 20 mg rozpuštěného
organického uhlíku na litr),
— mají zanedbatelnou tenzi par,
— nepůsobí inhibičně na bakterie,
—- významně se neadsorbují ve zkušebním systému,
— neztrácejí se ze zkoušeného roztoku pěněním.
Je nutné stanovit obsah organického uhlíku ve zkoušené
látce.
Při interpretaci získaných výsledků, zejména v
případech, kdy výsledky jsou nízké nebo marginální,
jsou cenné informace o relativních podílech hlavních
složek ve zkoušeném vzorku
Pro interpretaci nízkých výsledků a při volbě vhodné
koncentrace při zkoušce mohou být užitečné informace o
toxicitě látky pro mikroorganizmy.
XII.1.2 DEFINICE A JEDNOTKY
CT = koncentrace zkoušené látky na začátku
provzdušňovací periody, vyjádřená jako množství
organického uhlíku přítomného nebo přidaného k
usazené odpadní vodě (mg.l-1),
Ct = koncentrace rozpuštěného organického uhlíku v
kapalině nad usazeninou, ve zkoušce, na konci
provzdušňovací periody (mg.l-1),
Cc = koncentrace rozpuštěného organického uhlíku v
kapalině nad sedimentem, v kontrolní zkoušce, na
konci provzdušňovací periody (mg.l-1).
Biologický rozklad je v této metodě definován jako
úbytek organického uhlíku.
Biologický rozklad je možné vyjádřit jako:
1. Procentický úbytek Dda množství denně přidávané
látky:
CT - (C1 - Cc)
Dda = ----------------- . 1000 (1)
CT
kde Dds = rozklad/denní přídavek
2. Procentický úbytek Dssd množství látky přítomného na
začátku každého dne:
2CT + Cti - Cci - 3Ct(i+1) + 3Cc(i+1)k
Dssd = ---------------------------------------------------- . 100 (2(a))
CT + Cti - Cci
2CT - 2(Ct - Cc )
= ------------------- . 100 (2(b))
2CT + (C1 - Cc )
kde Dred = rozklad/denní přídavek;
indexy i a (i + 1) se vztahují ke dni měření.
Rovnice 2(a) se doporučuje, mění-li se DOC v odcházející vodě den ode dne, zatímco rovnici 2(b) lze
používat, zůstává-li DOC v odcházející vodě den ode
dne relativně konstantní.
XII.1.3 REFERENČNí LÁTKY
XII.1.4 PRINCIP ZKUŠEBNí METODY
Aktivovaný kal z čistírny odpadních vod se vpraví do
semikontinuální jednotky pro aktivovaný kal (SCAS,
semi-continuous activated sludge unit). Přidají se
zkoušená látka a usazená domovní odpadní voda a směs se
provzdušňuje 23 hodin. Provzdušňování se pak ukončí,
kal se nechá usadit a kapalina nad usazeninou se
odstraní.
Kal zbylý v provzdušňovací komoře se pak smísí s
další alikvotní částí zkoušené látky a odpadní vody a
cyklus se opakuje.
Biologický rozklad se určí stanovením obsahu
rozpuštěného organického uhlíku v kapalině nad
sedimentem. Tato hodnota se porovná s hodnotou,
zjištěnou pro kapalinu získanou z kontrolní nádoby, do
které byla dávkována pouze usazená odpadní voda.
Použije-li se specifická analytická metoda, je možné
měřit změny koncentrace výchozí chemické látky v
důsledku biologického rozkladu (primární biologický
rozklad).
XII.1.5 KRITÉRIA KVALITY
Reprodukovatelnost této metody, založené na úbytku
rozpuštěného organického uhlíku, nebyla ještě
stanovena. (Pokud se uvažuje primární biologický
rozklad, dosahuje se velmi přesných hodnot pro látky,
které se rozkládají ve vysokém stupni.)
Citlivost metody je ve velké míře určena variabilitou
slepé zkoušky a v menší míře přesností stanovení
rozpuštěného organického uhlíku a obsahem zkoušené
látky v kapalině na začátku každého cyklu.
XII.1.6 POPIS PRACOVNÍHO POSTUPU
XII.1.6.1 Příprava
Sestaví se dostatečný počet čistých provzdušňovacích
jednotek, alternativně je možné použít originální
zkušební jednotku SCAS o obsahu 1,5 l, a trubic pro
přívod vzduchu (obrázek 1) pro každou zkoušenou látku
a pro kontrolní zkoušky. Stlačený vzduch přiváděný do
zkušebních jednotek, přečištěný vatovým filtrem, musí
být prostý organického uhlíku a musí být předem
nasycen vodou, aby se snížily ztráty vypařováním.
Vzorek směsné kapaliny, obsahující 1 - 4 g
suspendovaných tuhých látek v 1 litru, se získá z
čistírny pracující s aktivovaným kalem, čistící
převážně domovní odpadní vody. Pro každou
provzdušňovací jednotku je třeba přibližně 150 ml
směsné kapaliny.
Zásobní roztoky zkoušené látky se připravují s
použitím destilované vody; normálně požadovaná
koncentrace je 400 mg.l
-1
jako organický uhlík, což
představuje koncentraci zkoušené látky 20 mg.l-1
uhlíku na začátku každého cyklu provzdušňování,
nedochází-li k biologickému rozkladu. Dovoluje-li to toxicita pro mikroorganizmy jsou
přípustné vyšší koncentrace.
Měří se obsah organického uhlíku zásobních roztoků.
XII.1.6.2 Experimentální podmínky
Zkoušku je třeba provádět při 20 - 25 oC.Používá se
vysoká koncentrace aerobních mikroorganizmů (1 - 4 g.l
-1
suspendovaných látek), a efektivní doba zdržení je
36 hodin. Uhlíkaté látky v přiváděné odpadní vodě se v
široké míře oxidují, normálně během osmi hodin po
začátku každého cyklu provzdušňování. Potom kal
endogenně dýchá po zbytek provzdušňovací periody, a v
této době je jediným dostupným substrátem zkoušená
sloučenina, pokud se také rychle nemetabolizuje. Tyto
skutečnosti spolu s denně opakovaným očkováním,
používá-li se jako médium domovní odpadní voda,
vytvářejí vysoce příznivé podmínky jak pro
aklimatizaci, tak pro vysoký stupeň rozkladu.XII.1.6.3 Provedení zkoušky
Získá se vzorek směsné kapaliny z vhodné čistírny
čistící aktivovaným kalem převážně domovní odpadní
vody nebo vzorek kapaliny z laboratorní jednotky a
udržuje se v aerobních podmínkách až do použití v
laboratoři. Do každé aerační i kontrolní jednotky se
naplní 150 ml směsné kapaliny (používá-li se
originální jednotka pro zkoušku SCAS, je třeba
uvedené objemy násobit 10) a zahájí se provzdušňování.
Po 23 hodinách se provzdušňování ukončí a kal se nechá
45 minut usadit. Postupně se otevřou kohouty všech
nádob a odeberou se 100 ml podíly kapaliny nad
usazeninou. Ke kalu zbylému v každé aerační jednotce
se přidá 100 ml usazené domovní odpadní vody získané
bezprostředně před použitím. Opět se zahájí
provzdušňování. V této etapě se nepřidávají žádné
zkoušené látky, a do jednotek se denně přidává domovní
odpadní voda pouze do té doby, než se po usazení
získá čirá kapalina nad usazeninou. To trvá obvykle
až dva týdny, během kterých se obsah rozpuštěného
organického uhlíku v kapalině nad usazeninou na konci
každého aeračního cyklu přiblíží konstantní hodnotě.
Na konci této fáze se jednotlivé usazené kaly smísí a
do každé jednotky se předloží 50 ml výsledného
směsného kalu.
Do kontrolních jednotek se přidá 95 ml usazené odpadní
vody a 5 ml vody, a do zkušebních jednotek se přidá
95 ml usazené odpadní vody plus 5 ml příslušného
zásobního roztoku zkoušené látky (450 mg.l
-1
). Znovu
se zahájí provzdušňování a pokračuje se v něm
23 hodin. Kal se pak nechá 45 minut usadit, kapalina
nad usazeninou se odebere a analyzuje na obsah
rozpuštěného organického uhlíku. Výše uvedený postup plnění a odběru se opakuje v
průběhu zkoušky denně.
Může se ukázat nutným očistit před usazováním stěny
jednotek, aby se předešlo hromadění tuhých látek nad
hladinou kapaliny. Pro každou jednotku se používá
samostatná stěrka nebo kartáč, aby se předešlo
vzájemné kontaminaci.
V ideálním případě se rozpuštěný organický uhlík
stanoví v kapalinách nad usazeninami denně, i když
jsou přípustné méně časté analýzy. Před analýzou se
kapaliny zfiltrují přes promyté 0,45 m membránové
filtry nebo se zcentrifugují. Membránové filtry jsou
vhodné, je-li zaručeno, že ani neuvolňují uhlík, ani
ve filtračním kroku neabsorbují příslušnou látku.
Teplota vzorku po dobu, kdy je v odstředivce, nesmí
přesáhnout 40 st. C.
Doba trvání zkoušky pro látky, u kterých dochází k
malému nebo žádnému biologickému rozkladu není určena,
ale na základě zkušenosti lze doporučit, aby trvala
obecně nejméně 12 týdnů, avšak ne déle než 26 týdnů.
XII.2 VÝSLEDKY A VYHODNOCENÍ
Hodnoty koncentrace rozpuštěného organického uhlíku
v čiré kapalině nad usazeninami ve zkušebních
jednotkách a v kontrolních jednotkách se vynesou proti
času.
Po skončení biologického rozkladu se koncentrace
zjištěná ve zkoušce přiblíží hodnotě v kontrolní
jednotce. Jakmile se ve třech po sobě následujících
měřeních zjistí, že rozdíl mezi oběma úrovněmi je
konstantní, provede se takový počet dalších měření,
který je postačující pro statistické vyhodnocení
výsledků, a vypočte se procentní hodnota biologického
rozkladu zkoušené látky (Dda nebo Dred, viz 1. 2).
XII.3 ZPRÁVA
XII.3.1 PROTOKOL O ZKOUŠCE
Je-li to možné, má protokol o zkoušce obsahovat tyto
informace:
— veškeré informace o druhu odpadní vody, typu použité
jednotky a o experimentálních výsledcích týkajících
se zkoušené látky, referenční látky ( pokud byla
použita) a slepé zkoušky,
— teplotu,
— křivku úbytku s popisem, způsob výpočtu (viz 1. 2),
— datum a lokalitu, kde byly odebrány aktivovaný kal
a odpadní voda, stav adaptace, koncentrace atd.,
— vědecké důvody pro veškeré změny v postupu zkoušky,
— podpis a datum.
XII.3.2 INTERPRETACE VÝSLEDKŮ
Protože látky zkoušené touto metodou nejsou snadno
biologicky rozložitelné, bude normálně jakýkoli úbytek
DOC, ke kterému dojde pouze v důsledku biologického
rozkladu, během dnů nebo týdnů, postupný, s výjimkou
případů, kdy aklimatizace je náhlá, jak je to
indikováno náhlým vymizením zkoušené látky po několika
týdnech.
Někdy může hrát významnou úlohu fyzikálně-chemická
adsorpce; to je indikováno úplným nebo částečným
úbytkem přidaného DOC na začátku. K čemu dojde potom,
závisí na činitelích jako je míra adsorpce a
koncentrace suspendovaných látek v nepoužité
odcházející vodě. Obvykle rozdíl mezi koncentrací DOC
v kapalinách nad usazeninou u kontroly a ve zkoušce
postupně vzrůstá z počáteční nízké hodnoty a tento
rozdíl pak, pokud nedojde k aklimatizaci, zůstává na
nové hodnotě po zbytek experimentu,.
Je-li třeba rozlišit mezi biologickým rozkladem (nebo
částečným biologickým rozkladem) a adsorpcí, jsou
nezbytné další zkoušky. Je možné je provést řadou
způsobů, ale nejpřesvědčivější je použití kapaliny nad
usazeninou nebo kalu jako inokula ve zkoušce vybrané
ze základního souboru (nejlépe v respirometrické
zkoušce).
Zkoušené látky, u kterých v této zkoušce dochází k
vysokému neadsorpčnímu úbytku DOC, je třeba považovat
za potenciálně biologicky rozložitelné. Částečný
neadsorpční úbytek ukazuje, že u látky dochází alespoň
k určitému biologickému rozkladu.
Nízké nebo nulové úbytky DOC mohou být způsobeny
inhibicí mikroorganizmů zkoušenou látkou, což se může
projevit také lyzí a ztrátou kalu, takže kapalina nad
usazeninou je zakalená. Zkoušku je nutné opakovat s
nižší koncentrací zkoušené látky.
Vyšší citlivosti je možné dosáhnout použitím specifické
analytické metody nebo sloučeniny značené 14C. V
případě zkoušené látky značené uhlíkem 14C se
zachycením 14CO
2
potvrdí, že došlo k biologickému
rozkladu.Tam, kde jsou výsledky uvedeny také jako primární
biologický rozklad, je třeba, pokud je to možné,
uvést také vysvětlení změny chemické struktury, která
vede ke ztrátě odezvy u mateřské zkoušené látky.
Je nutné uvést potvrzení platnosti metody spolu s
odezvou zjištěnou u média ve slepé zkoušce.
XII.4 LITERATURA
(1) OECD, Paris, 1981. Test Guideline 302 A, Decision
of the Council C(81) 30 final.
PŘÍLOHA 1
Zkouška SCAS: příklad výsledků
-------------------------------------------------------------------------------
Látka CT Cl - Cc Procento Doba trvání
(mg.l-1) (mg.l-1) biolog. zkoušky
rozkladu Dda (dny)
-------------------------------------------------------------------------------
4 - 17,2 2,0 85 40
acetylaminobenzen
sulfonan
tetrapropylenbenzen 17,3 8,4 51,4 40
sulfonan
4 – nitrofenol 16,9 0,8 95,3 40
diethylenglykol 16,5 0,2 98,8 40
anilin 16,9 1,7 95,9 40
cyklopentantetra- 17,9 3,2 81,1 120
karboxylát
-------------------------------------------------------------------------------
PŘÍLOHA 2
Příklad zkušební aparatury
XIII. METODA PRO STANOVENÍ BIOAKUMULACE - PRŮTOKOVÁ ZKOUŠKA NA
RYBÁCH – metoda C.13 podle přílohy směrnice Komise 98/73/ES ze
dne 18. září 1998, kterou se po dvacáté čtvrté přizpůsobuje
technickému pokroku směrnice rady 67/548/EHS o sbližování
správních a právních předpisů týkajících se klasifikace, balení
a označování nebezpečných látek
XIII.1 METODA
Tato bioakumulační metoda je replikou metody OECD
TG 305 (1996).
XIII.1.1 Úvod
V této metodě je popsán postup pro charakterizování
potenciálu látek bioakumulovat se v rybách za
průtokových podmínek. Ačkoliv jsou průtokové režimy
preferovány, semistatické režimy se připouštějí,
jsouli splněna kritéria validace.
V metodě jsou dostatečně popsány podrobnosti pro
provedení zkoušky, přičemž je poskytnuta dostatečná
volnost pro přizpůsobení experimentálního uspořádání
podmínkám v jednotlivých laboratořích a různým
vlastnostem zkušebních látek. Metoda je nejefektivnější
pro stabilní organické chemikálie s hodnotou logPov od
1,5 do 6,0 (1), ale může být také použita na
superlipofilní látky (s hodnotou log Pov > 6,0).
Předběžně odhadnutý bioakumulační faktor (BCF), někdy
označován jako KB, bude pro takové superlipofilní látky
pravděpodobně vyšší než hodnota bioakumulačního faktoru
v rovnovážném stavu (BCFss), která je očekávána
z laboratorních experimentů. Předběžné odhady pro
organické látky s hodnotou log Pov až asi 9,0 lze
získat pomocí rovnice Binteina et al (2). Mezi
parametry, které charakterizují bioakumulační
potenciál, patří rychlostní konstanta příjmu (k1),
rychlostní konstanta vylučování (k2) a BCFss.
Zkušební látky značení radioizotopy mohou usnadnit
analýzu vzorků vody a ryb a mohou být použity
v případě, že by měla být provedena identifikace a
kvantifikace produktů odbourávání. Měříli se celkový
obsah radioaktivního zůstatku (například spálením nebo
solubilizací tkáně), zakládá se hodnota BCF na výchozí
sloučenině, všech zadržených metabolitech a také na
asimilovaném uhlíku. Hodnoty BCF založené na celkovém
obsahu radioaktivního zbytku tedy nemohou být přímo
srovnatelné s hodnotou BCF získanou specifickou
chemickou analýzou pouze výchozí sloučeniny.
V metodách se značením radioaktivními izotopy mohou být
pro stanovení výchozí sloučeniny zařazeny purifikační
postupy, a jeli to považováno za nezbytné, mohou být
charakterizovány hlavní metabolity. Je možné rovněž
kombinovat studii metabolismu ryb se studií
bioakumulace analýzou a identifikací reziduí v tkáních.
XIII.1.2 Definice a jednotky
Biokoncentrace/Bioakumulace je nárůst koncentrace
zkušební látky v organismu (v jeho specifické tkáni)
nebo na něm vzhledem ke koncentraci zkušební látky
v okolním médiu.
Bioakumulační faktor (BCF nebo KB) je koncentrace
zkušební látky v rybách nebo na nich nebo v jejich
specifikovaných tkáních (C
f
v µg/g (ppm)) dělená
koncentrací chemikálie v okolním médiu (Cw
v µg/ml
(ppm)), a to v každém okamžiku fáze příjmu při této
zkoušce. Bioakumulační faktor v rovnovážném stavu (BCFss nebo
KB) se po dlouhou dobu výrazně nemění; koncentrace
zkušební látky v okolním médiu je po tuto dobu
konstantní.
Plató nebo rovnovážný stav je stav dosažený tehdy,
jeli při grafickém vyjádření křivka časové závislosti
koncentrace zkušební látky v rybách (C
f
) rovnoběžná
s časovou osou a tři po sobě jdoucí analýzy Cf
vzorků
odebraných v intervalech alespoň dvou dnů se neliší
více než o +/-20 % a neníli mezi těmito třemi dobami
odběru žádný výrazný rozdíl. Analyzujíli se sdružené
vzorky, požadují se čtyři po sobě jdoucí analýzy.
V případě zkušebních látek, jejichž příjem probíhá
pomalu, jsou vhodnější sedmidenní intervaly. Bioakumulační faktory vypočtené přímo z rychlostních
konstant kinetiky (k
1
/k2
) se nazývají kinetické
koncentrační faktory (BCFk). Rozdělovací koeficient oktanolvoda (P
ov
) je rovnovážný
poměr mezi rozpustností chemikálie v noktanolu a ve
vodě (metoda A.8) a označuje se také jako Kow
.
Logaritmus hodnoty Pov se používá jako ukazatel
potenciálu chemikálie bioakumulovat se ve vodních
organismech. Expozice nebo fáze příjmu je časový úsek, během něhož
jsou ryby vystaveny působení zkušební chemikálii.
Rychlostní konstanta příjmu (k1) je číselná hodnota
definující rychlost nárůstu koncentrace zkušební látky
v testovacích rybách nebo na nich (nebo v jejich
specifikovaných tkáních), jsouli ryby této chemikálii
vystaveny (k1 se vyjadřuje ve jednotce den–1).
Poexpoziční nebo vylučovací fáze je časový úsek po
přemístění testovacích ryb z média obsahujícího
zkušební látku do média, které tuto látku neobsahuje,
během něhož se studuje vylučování látky z testovacích
ryb (nebo její čistý úbytek v nich).
Rychlostní konstanta vylučování (k2) je číselná hodnota
definující rychlost poklesu koncentrace zkušební látky
v testovacích rybách (nebo v jejich specifikovaných
tkáních) po jejich přemístění z média obsahujícího
zkušební látku do média, které tuto látku neobsahuje
(k2 se vyjadřuje ve jednotce den–1).
XIII.1.3 Princip zkušební metody
Zkouška má dvě fáze: fázi expozice (příjem) a
poexpoziční fázi (vylučování). Během fáze příjmu jsou
dvě oddělené skupiny ryb stejného druhu exponovány
alespoň dvěma koncentracím zkušební látky. Poté jsou
přemístěny do média, které zkušební látku neobsahuje,
aby začala fáze vylučování. Fáze vylučování je vždy
nezbytná, neníli příjem látky během fáze příjmu
nevýznamný (např. jeli BCF menší než 10). Koncentrace
zkušební látky v rybách nebo na nich (nebo v jejich
specifikovaných tkáních) se sleduje v průběhu obou fází
zkoušky. Vedle těchto dvou zkušebních koncentrací se za
stejných podmínek, s výjimkou přítomnosti zkušební
látky, udržuje kontrolní skupina ryb, aby mohly být na
odpovídající kontrolní skupině porovnány možné
nepříznivé účinky pozorované při bioakumulačních
zkouškách a aby byly získány pozaďové koncentrace
zkušební látky.
Fáze příjmu tvá 28 dnů, neníli prokázáno, že rovnováhy
je dosaženo dříve. Délku fáze příjmu a dobu potřebnou
k ustavení rovnovážného stavu lze předpovědět pomocí
rovnice v příloze 3. Fáze vylučování poté začne po
přemístění ryb do jiné nádrže bez zkušební látky. Jeli
to možné, vypočítají se bioakumulační faktory nejlépe
jako poměr (BCFss), tj. poměr koncentrace v rybách (C
f
)
a ve vodě (Cw
) ve zřetelném rovnovážném stavu, a jako
kinetický bioakumulační faktor (BCFk), tj. poměr
rychlostních konstant příjmu (k1) a vylučování (k2) za
předpokladu kinetiky prvního řádu. Neřídíli se zjevně
naměřené hodnoty kinetikou prvního řádu, měl by být
použit složitější model (příloha 5). Nedojdeli k rovnovážnému stavu do 28 dnů, měla by být
fáze příjmu prodloužena do jeho dosažení nebo na
60 dnů, podle toho, co nastane dříve; poté začne fáze
vylučování.
Rychlostní konstanta příjmu, rychlostní konstanta
vylučování (úbytku) (nebo konstanty, jsouli použity
složitější modely), bioakumulační faktor a, jeli to
možné, intervaly spolehlivosti každého z těchto
parametrů se vypočítají z modelu, který popisuje
naměřené koncentrace zkušební látky v rybách a ve vodě.
Faktor BCF se vyjadřuje jako funkce celkové živé
hmotnosti ryby. Pro zvláštní účely však mohou být
použity specifikované tkáně nebo orgány (svalovina,
játra), jeli ryba dostatečně velká nebo jeli možné ji
rozdělit na jedlý (vykostěný) podíl a nejedlý podíl
(vnitřnosti). Vzhledem k tomu, že u mnoha organických
látek existuje zřetelný vztah mezi potenciálem
bioakumulace a lipofilií, existuje také odpovídající
vztah mezi obsahem tuku v testovacích rybách a
pozorovanou bioakumulací takové látky. Aby se tedy
snížilo kolísání výsledků pro tyto látky s vysokou
lipofilií (tj. s log Pov > 3), měla by být bioakumulace
vztažena vedle celkové hmotnosti těla také k obsahu
tuku.
Obsah tuku by měl být stanoven pokud možno na stejném
biologickém materiálu, jaký je použit ke stanovení
koncentrace zkušební látky.
XIII.1.4 Informace o zkušební látce
Před prováděním zkoušek bioakumulace by měly být o
zkušební látce známy tyto informace:
a) rozpustnost ve vodě,
b) rozdělovací koeficient oktanolvoda P
ov
(označovaný
také jako Kow, stanovený metodou HPLC, viz A.8), c) hydrolýza,
d) fototransformace ve vodě stanovená ozářením
slunečním nebo simulovaným slunečním světlem za
podmínek zkoušky bioakumulace (3),
e) povrchové napětí (tj. u látek, u nichž nelze
stanovit log P
ov
), f) tlak par,
g) popřípadě ochota k biologickému odbourávání.
Další požadovanou informací je toxicita pro druh ryby,
který má být použit, nejlépe asymptotická hodnota LC
50
(tj. časově nezávislá). Musí být k dispozici vhodná
analytická metoda o známé správnosti, přesnosti a
citlivosti pro kvantitativní stanovení zkušební látky
ve zkušebních roztocích a v biologickém materiálu a
dále podrobnosti o přípravě a uchovávání vzorků. Měly
by být také známy meze stanovitelnosti zkušební látky
jak ve vodě, tak v rybích tkáních. Jeli použita
zkušební látka značená 14C, měla by být známá aktivita
nečistot vyjádřená v procentech.XIII.1.5 Platnost zkoušky
Aby zkouška platila, měly by platit následující
podmínky:
— kolísání teploty je menší než +/-2 st.C,
— koncentrace rozpuštěného kyslíku neklesne pod 60%
nasycení,
— koncentrace zkušební látky v nádrži je udržována
v intervalu +/-20 % kolem střední hodnoty
naměřených hodnot během fáze příjmu,
— mortalita nebo jiné nepříznivé účinky/choroby jak
u kontrolních, tak u exponovaných ryb je na konci
zkoušky menší než 10 %; jestliže je zkouška
prodloužena na několik týdnů nebo měsíců, měl by
být úhyn nebo jiné nepříznivé účinky v obou
skupinách ryb menší než 5 % za měsíc nebo by
neměl překročit celkem 30 %.
c1.6 Referenční sloučeniny
Použití referenčních sloučenin o známém bioakumulačním
potenciálu je popřípadě užitečné pro kontrolu
experimentálního postupu. Zatím nelze ještě doporučit
žádné specifické látky.
XIII.1.7 Popis zkušební metody
XIII.1.7.1 Přístroje a pomůcky
V případě všech částí zařízení je třeba se důsledně
vyhýbat použití materiálů, které mají schopnost
rozpouštět, sorbovat nebo vyluhovat a mají nepříznivý
účinek na ryby. Lze použít standardní pravoúhlé nebo
válcové nádrže vyrobené z inertního materiálu a mající
vhodný objem s ohledem na náplň. Použití měkkých trubek
z plastu by mělo být minimalizováno. Měly by být
použity trubky z teflonu (R), z korozivzdorné oceli
a/nebo ze skla. Zkušenosti ukázaly, že pro látky
s vysokými absorpčními koeficienty, jako jsou
syntetické pyrethroidy, je potřebné silanizované sklo.
V těchto případech musí být zařízení po použití
zlikvidováno.
XIII.1.7.2 Voda
Ve zkoušce se používá přírodní voda a měla by být
získána z nekontaminovaného zdroje stálé kvality.
Ředicí voda musí mít kvalitu, která umožní přežití
zvoleného druhu ryby po dobu aklimatizace a v průběhu
fází zkoušky, aniž by vykazoval abnormální klinický
zjev nebo chování. V ideálním případě by mělo být
prokázáno, že testovací druh může v ředicí vodě přežít,
růst a rozmnožovat se (např. zkouškou s laboratorní
kulturou nebo zkouškou toxicity během životního cyklu).
Voda by měla být charakterizována alespoň hodnotou pH,
tvrdostí, celkovým obsahem nerozpuštěných látek,
celkovým obsahem organického uhlíku a podle možnosti
také obsahem amoniaku a dusičnanů, alkalitou a
v případě mořských druhů salinitou. Všechny parametry,
které jsou důležité pro optimální prospívání ryb, jsou
známy, v příloze I jsou přesto uvedeny doporučené
maximální koncentrace pro řadu parametrů sladkovodní a
mořské vody.
Voda by měla mít po celou dobu zkoušky stejnou kvalitu.
Hodnota pH by měla být v rozmezí 6,0 až 8,5, avšak
během zkoušky by se pH nemělo lišit o více než +/-0,5.
Pro ujištění, že voda nebude mít přílišný vliv na
výsledky zkoušky (například tvorbou komplexů se
zkušební látkou) nebo nepříznivý vliv na stav obsádky
ryb, by měly být odebírány v pravidelných intervalech
její vzorky pro analýzu. Stanovení těžkých kovů (např.
Cu, Pb, Zn, Hg, Cd, Ni), hlavních aniontů, kationtů
(např. Ca, Mg, Na, K, Cl, SO
4
), pesticidů (např.
celkový obsah organofosforových a organochlorových
pesticidů), celkový obsah organického uhlíku a
suspendovaných látek by měl být proveden každé tři
měsíce, jeli kvalita ředicí vody relativně konstantní.
Jeli prokázáno, že kvalita vody je konstantní po dobu
alespoň jednoho roku, mohou být stanovení méně častá a
intervaly lze prodloužit (např. každých šest měsíců). Celkový přirozený obsah částic a rovněž obsah
organického uhlíku (TOC) v ředicí vodě by měl být co
nejnižší, aby nedošlo k absorpci zkušební látky na
organických látkách, což může snížit její biologickou
dostupnost (4). Maximální přijatelná hodnota je 5 mg/l
pro částice (sušina zachycená filtrem 0,45 µm) a 2 mg/l
pro celkový organický uhlík (viz příloha II). Jeli to
nezbytné, měla by být voda před použitím filtrována.
Příspěvek k obsahu organického uhlíku od testovacích
ryb (exkrety) a ze zbytků potravy by měl být co
nejmenší. V průběhu zkoušky by neměla koncentrace
organického uhlíku ve zkušební nádrži překročit
koncentraci organického uhlíku pocházejícího ze
zkušební látky a z rozpouštědla, jeli použito, o více
než 10 mg/l (+/-20 %).
XIII.1.7.3 Zkušební roztoky
Zásobní roztok zkušební látky se připraví ve vhodné
koncentraci. Zásobní roztok by měl být připraven
nejlépe jednoduchým smícháním nebo protřepáním zkušební
látky s ředicí vodou. Použití rozpouštědel nebo
dispersantů (solubilizačních činidel) se nedoporučuje;
může však být v některých případech nezbytné pro
vytvoření zásobního roztoku o vhodné koncentraci.
Rozpouštědly, která mohou být použita, jsou ethanol,
methanol, ethylenglykolmonomethylester,
ethylenglykoldimethylester, dimethylformamid a
triethylenglykol. Dispersanty, které mohou být použity,
jsou Cremophor RH40, Tween 80, 0,01% methylcelulosa a
HCO40. Snadno biologicky odbouratelná činidla je třeba
používat rozvážně, neboť mohou způsobit problémy
s růstem bakterií v průtokových zkouškách. Zkušební
látka může být značena radioaktivními izotopy a měla by
být nejvyšší čistoty (např. > 98%).
Pro průtokové zkoušky je pro zajištění koncentrací
testované látky nezbytný systém, který plynule dávkuje
a ředí zásobní roztok zkušební látky (např. dávkovací
čerpadlo, proporcionální dávkovač, saturační systém).
Přijatelná je výměna nejlépe pěti objemů v každé
zkušební nádrži za den. Upřednostňuje se průtokový
režim, neníli to však možné (např. jsouli testovací
organismy nepříznivě ovlivňovány), může být použita
semistatická technika za předpokladu, že jsou splněna
kritéria validity. Rychlosti průtoku zásobního roztoku
a ředicí vody by měly být kontrolovány jak 48 hodin
před zkouškou, tak poté alespoň denně během zkoušky.
Tato kontrola by měla zhrnovat stanovení rychlosti
průtoku v každé testovací nádrži a měla by zajistit,
aby se rychlost průtoku neměnila o více než 20 %
v rámci jedné nádrže nebo mezi nádržemi.
XIII.1.7.4 Výběr druhů
Důležitými kritérii pro výběr druhu jsou jeho
dostupnost, možnost získat jej ve vyhovující velikosti
a jeho bezproblémové udržování v laboratoři. Dalšími
kritérii pro výběr druhu ryb jsou jeho rekreační,
komerční a ekologický význam a rovněž srovnatelná
citlivost, úspěšné dřívější použití atd. Doporučené
druhy jsou uvedeny v příloze II. Mohou být použity jiné
druhy, avšak zkušební postup musí být upraven, aby byly
vytvořeny vhodné zkušební podmínky. V takovém případě
by měly být uvedeny důvody pro výběr druhu a
experimentální podmínky.
XIII.1.7.5 Chov ryb
Obsádka ryb se nechá aklimatizovat alespoň dva týdny
při zkušební teplotě a krmí se odpovídající potravou
stejného typu jako v průběhu zkoušky.
Po 48 hodinách aklimatizace se zaznamená úhyn a použijí
se následující kritéria:
— úhyn vyšší než 10 % populace za sedm dnů: vyměnit
celou obsádku;
— úhyn 5 až 10 % populace za sedm dnů: nechat
aklimatizovat dalších sedm dnů;
— úhyn nižší než 5 % populace za sedm dnů: násada se
přijímá; dojde li během dalších sedmi dnů k úhynu
vyššímu než 5 %, celá násada se vymění.
Zajistí se, aby ryby použité pro zkoušku nevykazovaly
pozorovatelné nemoci a abnormality. Všechny nemocné
ryby se vymění. Dva týdny před zkouškou nebo v průběhu
zkoušky nesmí být léčeny nemoci u ryb.
XIII.1.8 Provedení zkoušky
XIII.1.8.1 Předběžná zkouška
Může být užitečné provést předběžný experiment s cílem
optimalizovat zkušební podmínky konečné zkoušky, např.
výběr koncentrace (koncentrací) zkušební látky, délka
fáze příjmu a fáze vylučování.
XIII.1.8.2 Délka fáze příjmu
Předpověď délky fáze příjmu lze získat z praktických
zkušeností (např. z dřívější studie nebo z akumulace
podobné chemikálie) nebo z určitých empirických vztahů
využívajících znalosti buď rozpustnosti ve vodě, nebo
rozdělovacího koeficientu oktanolvoda pro zkušební
látku (viz příloha 3).
Fáze příjmu tvá 28 dnů, neníli prokázáno, že rovnováhy
je dosaženo dříve. Nedojdeli k rovnovážnému stavu do
28 dnů, měla by být fáze příjmu prodloužena do jeho
dosažení, přičemž se provádějí další měření, nebo na
60 dnů, podle toho, co nastane dříve.
XIII.1.8.2.2 Délka fáze vylučování
Doba odpovídající polovině délky fáze příjmu je obvykle
dostatečná k tomu, aby došlo k přiměřenému (např. 95%)
snížení obsahu látky v organismu (vysvětlení odhadu viz
příloha 3). Jestliže doba nezbytná pro dosažení 95%
úbytku je neúčelně dlouhá, překračuje například dvakrát
normální délku fáze příjmu (tj. více než 56 dnů), může
být použita kratší doba (tj. dokud není koncentrace
zkušební látky menší než 10 % koncentrace v rovnovážném
stavu). V případě látek se složitějším charakterem
příjmu a vylučování, než jaký je popsán modelem ryby
s jedním kompartmentem řídícím se kinetikou prvního
řádu, však delší fáze vylučování umožní stanovit
rychlostní konstanty úbytku. Délka fáze však může být
určena dobou, po kterou zůstává koncentrace zkušební
látky v rybách nad mezí detekce analytické metody.
XIII.1.8.2.3 Počet testovacích ryb
Počet ryb na jednu zkušební koncentraci se zvolí tak,
aby pro každý odběr byly k dispozici čtyři ryby na
jeden vzorek. Jeli požadována větší statická síla,
bude na vzorek nezbytných více ryb.
Použijí-li se pohlavně dospělé ryby, uvede se, zda byly
v experimentu použity ryby samičího nebo samčího
pohlaví (nebo – uvede se pohlaví ryb použitých
v experimentu). V případě použití obou pohlaví společně
by mělo být před započetím expozice prokázáno, že
rozdíl v obsahu tuku mezi oběma pohlavími není
významný; oddělení samců a samic může být nezbytné.
V každé zkoušce se vyberou ryby podobné hmotnosti, tak
aby hmotnost nejmenší z nich nebyla nižší než dvě
třetiny hmotnosti největší ryby. Všechny by měly být
stejného stáří a měly by pocházet ze stejného zdroje.
Vzhledem k tomu, že se jeví, že stáří a hmotnost ryby
mají často významný vliv na hodnoty BCF (1), musí být
tyto podrobnosti přesně zaznamenány. Doporučuje se
zvážit před zkouškou dílčí vzorek obsádky ryb s cílem
odhadnout střední hmotnost.
XIII.1.8.2.4 Násada
Volí se vysoký poměr množství vody k množství ryb, aby
se minimalizovalo snížení koncentrace C
w
způsobené
přidáním ryb na začátku zkoušky a také proto, aby
nedošlo k poklesu koncentrace rozpuštěného kyslíku. Je
důležité, aby rychlost nasazování byla přiměřená
použitému druh. V každém případě se obvykle doporučuje
rychlost nasazování 0,1 až 1,0 g ryb (živá hmotnost) na
litr vody za den. Vysoká rychlost nasazování může být
zvolena, jeli prokázáno, že požadovaná koncentrace
zkušební látky může být udržována v mezích +/-20 % a že
koncentrace rozpuštěného kyslíku neklesne pod 60%
nasycení. Při volbě režimu nasazování má být přihlédnuto
k obvyklému přirozenému prostředí ryb. Například ryby
žijící u dna mohou vyžadovat při stejném obejmu vody
větší plochu dna než pelagické druhy ryb.
XIII.1.8.2.5 Krmení
Během aklimatizace a po dobu zkoušky se ryby krmí
vhodnou potravou se známým obsahem tuku a celkových
bílkovin podávanou v množství dostatečném pro udržení
zdravého stavu a pro udržení tělesné hmotnosti. Ryby se
krmí denně v průběhu aklimatizace a po dobu zkoušky
množstvím přibližně 1 až 2 % tělesné hmotnosti; tím se
udrží v průběhu zkoušky obsah tuku u většiny druhů ryb
na relativně konstantní úrovni. Množství krmiva by mělo
být například jednou týdně nově přepočítáno, aby byla
udržena odpovídající tělesná hmotnost a obsah tuku.
Hmotnost ryb v každé nádrži může být pro tento výpočet
odhadnuta z hmotnosti ryb naposledy odebraných
z dotyčné nádrže. Ryby, které zůstaly v nádrži, se
neváží.
Nezkrmená potrava a exkrety se odstraňují z nádrží
denně krátce po krmení (30 minut až jednu hodinu).
Nádrže se udržují v celém průběhu zkoušky v co nejvyšší
čistotě, aby byla koncentrace organických látek co
nejnižší, neboť přítomnost organického uhlíku může
snižovat biologickou dostupnost zkušební látky (1).
Poněvadž mnoho krmiv pochází z rybí moučky, mělo by být
krmivo analyzováno na přítomnost zkušební látky. Je
rovněž žádoucí, aby bylo krmivo analyzováno na
přítomnost pesticidů a těžkých kovů.
XIII.1.8.2.6 Světlo a teplota
Fotoperioda je obvykle 12 až 16 hodin a teplota (+/-
2 st.C) by měla odpovídat testovacímu druhu (viz
příloha 2). Druh a charakteristiky osvětlení by měly
být známy. Měla by být věnována pozornost možné
fototransformaci zkušební látky za světelných podmínek
studie. Měly by být použito vhodné osvětlení, aby
nedošlo k expozici ryb fotoproduktům nevyskytujícím se
v přírodě. V některých případech může být vhodné použít
filtr pro odfiltrování UV záření s vlnovou délkou
kratší než 290 nm.
XIII.1.8.2.7 Zkušební koncentrace
Ryby jsou vystaveny za průtokových podmínek alespoň
dvěma koncentracím zkušební látky ve vodě. Vyšší
(nejvyšší) koncentrace zkušební látky se obvykle volí
tak, aby byla na úrovni 1 % její asymptotické hodnoty
akutní LC
50
a aby byla desetkrát vyšší než je mez
detekce této látky ve vodě při použití analytické
metody. Nejvyšší zkušební koncentraci lze také stanovit
dělením akutní 96hodinové LC50
příslušným poměrem
akutní/chronická letální dávka (u některých chemikálií
může koeficient ležet mezi 3 a 100). Jeli to možné,
volí se druhá (další) koncentrace tak, aby se lišila
od výše uvedené faktorem 10. Neníli to možné z důvodu
kritéria 1 % z LC50
nebo z důvodu kritéria meze
detekce, může být použit nižší faktor než 10 nebo by
mělo být zváženo použití zkušební látky značené 14C.
Žádná koncentrace by neměla překročit rozpustnost
látky. Jeli použito rozpouštěcí činidlo, neměla by být jeho
koncentrace vyšší než 0,1 ml/l a mělo by být stejné ve
všech zkušebních nádržích. Jeho příspěvek, společně
s příspěvkem zkušební látky, k celkovému obsahu
organického uhlíku ve zkušební vodě by měl být znám.
Avšak maximální snaha by měla být vynaložena k zamezení
použití takovýchto látek .
XIII.1.8.2.8 Kontroly
Vedle zkušební série by měla být založena kontrola
sestávající z ředicí vody, která popřípadě obsahuje
rozpouštěcí činidlo, pokud bylo zjištěno, že toto
činidlo nemá žádné účinky na ryby. Není-li tomu tak,
měly by být založeny obě kontroly.
XIII.1.8.3 Četnost měření kvality vody
V průběhu zkoušky by měly být v každé nádrži měřeny
množství rozpuštěného kyslíku, TOC, pH a teplota.
Celková tvrdost a popřípadě salinita by měly být měřeny
v kontrolách a v jedné nádrži s vyšší (nejvyšší)
koncentrací. Množství rozpuštěného kyslíku a popřípadě
salinita by měly být měřeny alespoň třikrát – na
začátku, přibližně uprostřed a na konci fáze příjmu – a
jednou týdně ve fázi vylučování. Hodnota TOC by měla
být měřena na začátku zkoušky (24 hodin a 48 hodin před
započetím fáze příjmu) před nasazením ryb a alespoň
jednou týdně jak v průběhu fáze příjmu, tak v průběhu
fáze vylučování. Teplota by měla být měřena denně, pH
na začátku a na konci každé fáze a tvrdost vody jednou
v průběhu zkoušky. Teplota by měla být měřena nejlépe
nepřetržitě alespoň v jedné nádrži.
XIII.1.8.4 Odběr vzorků a analýza ryb a vody
XIII.1.8.4.1 Časový rozvrh odebírání vzorků ryb a vody
Voda ze zkušebních nádrží se pro stanovení koncentrace
zkušební látky odebírá před nasazením ryb a během fáze
příjmu i během fáze vylučování. Voda se odebírá alespoň
ve stejnou dobu jako ryby a před krmením. Během fáze
příjmu se stanovují koncentrace zkušební látky, aby se
ověřilo, že jsou v souladu s kritérii validity.
Ryby se odebírají alespoň pětkrát během fáze příjmu a
alespoň čtyřikrát během fáze vylučování. Vzhledem
k tomu, že v mnoha případech bude obtížné s tímto
počtem vzorků vypočítat rozumně přesný odhad hodnoty
BCF, zejména jdeli o jinou než jednoduchou kinetiku
prvního řádu, může být účelné odebírat vzorky v obou
fázích častěji (viz příloha 4). Dodatečné vzorky se
uloží a analyzují až poté, co se výsledky prvního kola
analýz ukáží jako nedostatečné pro výpočet hodnoty BCF
o požadované přesnosti.
Příklad přijatelného časového rozvrhu odběru vzorků je
uveden v příloze 4. Jiné plány lze snadno odvodit
pomocí jiné předpokládané hodnoty Pov, jejíž pomocí se
vypočítá expoziční doba pro 95% příjem.
V odběru vzorků se pokračuje během fáze příjmu do
ustavení rovnovážného stavu nebo po dobu 28 dnů, podle
toho, co nastane dříve. Neníli rovnovážného stavu
dosaženo do 28 dnů, v odběru se vzorků se pokračuje do
ustavení rovnovážného stavu nebo do 60 dnů, podle toho,
co nastane dříve. Před zahájením fáze vylučování se
ryby přemístí do čistých nádrží.
XIII.1.8.4.2 Odběr vzorků a příprava vzorků
Vzorky vody pro analýzy se odebírají například
odsáváním potrubím z inertního materiálu ze středu
zkušební nádrže. Vzhledem k tomu, že se biologicky
nedostupná frakce zkušební látky nedá často oddělit od
biologicky dostupné frakce ani filtrací, ani
odstředěním (zejména v případě superlipofilních
chemikálií, tj. chemikálií s log Pov > 5) (1), (5),
nemohou být vzorky takto zpracovány. Namísto toho je
třeba učinit opatření pro to, aby nádrže byly udržovány
co nejčistší, a obsah organického uhlíku by měl být
pravidelně monitorován jak během fáze příjmu, tak během
fáze vylučování.
Při každém odběru se z nádrží odebere vhodný počet ryb
(obvykle alespoň čtyři). Odebrané ryby se rychle omyjí
pod tekoucí vodu, osuší se „do sucha“, ihned se usmrtí
nejvhodnější humánní metodou a zváží se.
Ryby a voda se pokud možno analyzují ihned po odběru
s cílem předejít degradaci nebo ztrátám a vypočítat
přibližné rychlosti příjmu a vylučování ještě v průběhu
zkoušky. Okamžitá analýza rovněž zabrání zpoždění ve
stanovení plató při jeho dosažení.
Nedojdeli k okamžité analýze, vzorky se vhodným
způsobem uchovají. Před zahájením studie je třeba
zjistit informace o řádné metodě uchovávání vzorků
s ohledem na dotyčnou zkušební látku – například
hluboké zmrazení, udržování při 4 st.C, délka uchovávání,
vyluhování atd.
XIII.1.8.4.3 Kvalita analytické metody
Vzhledem k tomu, že celý postup je určen hlavně
správností, přesností a citlivostí analytické metody
použité pro analýzu zkušební látky, je třeba
experimentálně kontrolovat, že přesnost a
reprodukovatelnost chemické analýzy a rovněž výtěžek
zkušební látky jak z vody, tak ze vzorů ryb jsou pro
dotyčnou analytickou metodu dostatečné. Kontroluje se
také, zda se zkušební látka nevyskytuje v použité
ředicí vodě.
Hodnoty C
w
a Cf
se podle potřeby korigují podle výtěžku
a pozaďových hodnot kontrol. Vzorky ryb a vody se
zpracovávají tak, aby se minimalizovala kontaminace a
ztráty (např. v důsledku absorpce odběrovým zařízením).XIII.1.8.4.4 Analýza vzorků ryb
Jeli ve zkoušce použit materiál značený radioizotopy,
je možné provést analýzu s celkovou aktivitou (tj.
s výchozí látkou i s metabolity) nebo lze provést
separaci, tak aby mohla být výchozí látka analyzována
samostatně. V rovnovážném stavu nebo na konci fáze
příjmu, podle toho, k čemu dojde dříve, mohou být
stanoveny také hlavní metabolity. Jeli hodnota BCF
vypočtená z celkové aktivity reziduí >=? 1 000 %, může
být účelné, a pro určité kategorie chemikálií, např.
pesticidy, je to důrazně doporučeno, identifikovat a
kvantifikovat produkty odbourávání představující >= 10 %
celkového množství reziduí v tkáních ryb v rovnovážném
stavu. Jsouli produkty odbourávání představující
>= 10 % celkové aktivity reziduí identifikovány a
kvantifikovány, doporučuje se také identifikovat a
kvantifikovat produkty odbourávání ve vodě.
Koncentrace zkušební látky by měla být obvykle
stanovena pro každou jednotlivou zváženou rybu. Neníli
to možné, mohou být vzorky při každém odběru
sdružovány, avšak sdružování omezuje statistické
postupy, které lze na data aplikovat. Pokud na
specifickém statistickém postupu a na síle záleží, měl
by být ve zkoušce nasazen dostatečný počet ryb
vyhovující požadovanému sdružování a požadované síle
(6), (7).
Hodnota BCF by měla být vyjádřena jako funkce celkové
živé hmotnosti a v případě lipofilních látek také jako
funkce obsahu tuku. Obsah tuku v rybách se stanoví
pokud možno při každém odběru. Pro stanovení obsahu
tuku by měla být použita vhodná metoda (odkazy 8 a 2
v příloze 3). Jako standardní metoda může být
doporučena technika extrakce do chloroformu/methanolu
(9). Různé metody nedávají stejné hodnoty (10), je
proto důležité uvést podrobnosti o použité metodě.
Jeli to možné, měla by být analýza tuků provedena na
extraktu připravenému pro analýzu zkušební látky, neboť
tuky musí být často před chromatografickou analýzou
odstraněny. Obsah tuku v rybách (v mg/kg živé
hmotnosti) na konci experimentu by se neměl lišit od
obsahu na počátku od více než +/-25 %. Měl by být
uveden také podíl pevných látek v tkáních, aby bylo
možné provést přepočet koncentrace tuků z živé
hmotnosti na hmotnost sušiny.
XIII.2 DATA
XIII.2.1 Zpracování výsledků
Křivka příjmu zkušební látky se sestrojí vynesením její
koncentrace v rybách nebo na nich (nebo ve
specifikovaných tkáních) v průběhu fáze příjmu proti
hasu v lineárním měřítku. Dosáhlali křivka plató, tj.
začíná být rovnoběžná s časovou osou, vypočítá se
hodnota BCFss v rovnovážném stavu z poměru
Cf v rovnovážném stavu (střední hodnota)
-------------------------------------------
Cw v rovnovážném stavu (střední hodnota)
Neníli rovnovážného stavu dosaženo, je možné vypočítat
hodnotu BCFss s dostatečnou přesností pro posouzení
rizika z „rovnovážného stavu v 80% (1,6/k2) nebo 95%
(3,0/k2) rovnováze. Také koncentrační faktor BCFk se
stanoví jako poměr dvou rychlostních konstant prvního
řádu k
1
/k2
. Rychlostní konstanta vylučování se obvykle
stanoví z křivky vylučování (tj. grafu poklesu
koncentrace zkušební látky v rybách v čase). Rychlostní
konstanta příjmu se poté vypočte pomocí hodnoty k2
a
hodnoty Cf
odvozené z křivky příjmu (viz také
příloha 5). Upřednostňovanou metodou pro získání
hodnoty BCFk a rychlostních konstant k1
a k2
je metoda
nelineárního odhadu parametrů s využitím počítače (11).
K výpočtu hodnot k1
a k2
lze jinak použít grafické
metody. Neníli zjevně křivka vylučování křivkou
prvního řádu, měly by být použity složitější modely
(viz odkazy v příloze 3) a měl by být konzultován
biostatistik.XIII.2.2 Interpretace výsledků
Výsledky by měly být interpretovány opatrně v případě,
že naměřené koncentrace zkušebních roztoků se pohybují
na úrovních blízkých mezi detekce analytické metody.
Jasně vymezené křivky příjmu a úbytku jsou ukazatelem
dobré kvality dat o bioakumulaci. Rozdíl konstant
příjmu/vylučování pro dvě zkušební koncentrace by měl
být nižší než 20 %. Pozorované významné rozdíly
v rychlostech příjmu/vylučování mezi dvěma použitými
zkušebními koncentracemi by měly být zaznamenány a mělo
by být uvedeno jejich možné vysvětlení. Interval
spolehlivosti hodnot BCF u dobře navržených studií se
všeobecně blíží +/-20 %.
XIII.3 ZPRÁVY
Protokol o zkoušce musí obsahovat následující
informace:
XIII.3.1 Zkušební látka
— fyzikální povaha a popřípadě fyzikálněchemické
vlastnosti,
— chemické identifikační údaje (včetně obsahu
organického uhlíku, jeli to třeba),
— v případě značení radioaktivními izotopy jejich
přesná poloha a aktivita příměsí, vyjádřená
v procentech.
XIII.3.2 Testovací druh
— vědecký název, kmen, zdroj, případné předběžné
ošetření, aklimatizace, stáří, rozpětí velikostí
atd.
XIII.3.3 Zkušební podmínky
— použitý zkušební postup (např. průtokový nebo
semistatický),
— typ a charakteristiky použitého osvětlení a
fotoperioda (fotoperiody),
— uspořádání zkoušky (např. počet a velikost zkušebních
nádrží, rychlost výměny objemu vody, počet
opakování, počet ryb v jednom opakování, počet
zkušeních koncentrací, délka fází příjmu a
vylučování, četnost odběru vzorků ryb a vzorků
vody),
— metoda přípravy zásobních roztoků a častost jejich
obnovování (jeli použito rozpouštěcí
činidlo,musí být uvedena jeho koncentrace a jeho
příspěvek k obsahu organického uhlíku ve vodě),
— nominální zkušební koncentrace, střední hodnoty
naměřených koncentrací ve zkušebních nádržích,
jejich směrodatné odchylky a metody jejich
stanovení,
— zdroj ředicí vody, popis jakékoliv předchozí úpravy,
výsledky jakéhokoliv prokazování schopnosti
zkušebních ryb žít v této vodě a charakteristiky
vody: hodnota pH, tvrdost, teplota, koncentrace
rozpuštěného kyslíku, úroveň zbytkového chloru
(jeli měřena), obsah celkového organického
uhlíku, obsah suspendovaných látek, (popřípadě)
salinita zkušebního média a výsledky jakýchkoliv
jiných provedených měření,
— kvalita vody ve zkušebních nádržích, hodnota pH,
tvrdost vody, obsah TOC, teplota a koncentrace
rozpuštěného kyslíku,
— podrobné informace o krmení (například typ krmiva,
zdroj, složení – alespoň pokud možno obsah tuku a
bílkovin, podávané množství a četnost),
— informace o zpracování vzorků ryb a vody, včetně
podrobností o přípravě, uchovávání, o extrakci a
analytických postupech (a přesnosti), pokud jde o
zkušební látku a obsah tuku (jeli měřen).
XIII.3.4 Výsledky
— výsledky jakýchkoliv provedených předběžných studií,
— úhyn kontrolních ryb a ryb v každé expoziční nádrži a
jakékoliv pozorované neobvyklé chování,
— obsah tuku v rybách (jeli stanoven při zkoušce),
— křivky (včetně všech naměřených dat) příjmu a
vylučování zkušební chemikálie rybami, doba
dosažení rovnovážného stavu,
— hodnoty C
f
a Cw
(popřípadě se směrodatnými odchylkami
a rozpětím) pro všechny odběry (hodnota Cf
se
vyjadřuje v µg/g živé hmotnosti (ppm) celého těla
nebo specifikované tkáně, např. tuku, a Cw
se
vyjadřuje v µg/ml (ppm)); hodnoty Cw
pro kontroly
(měly by být uvedeny také hodnoty pozadí), — bioakumulační faktor v rovnovážném stavu (BCFss)
a/nebo kinetický koncentrační faktor (BCFk) a
popřípadě 95% intervaly spolehlivosti pro
rychlostní konstanty příjmu a vylučování (úbytku)
(vše vztaženo na celý organismus a na celkový
obsah tuku v rybě, jeli stanoven, nebo na její
specifikovanou tkáň), intervaly spolehlivosti a
směrodatné odchylky (jsouli k dispozici) a
metody výpočtu/analýzy dat pro každou použitou
koncentraci zkušební látky,
— v případě použití látek značených radioaktivními
izotopy a jeli to nutné, musí být uvedena
akumulace jakýchkoliv detekovaných metabolitů,
— všechny zvláštnosti zkoušky, všechny odchylky od
těchto postupů a ostatní relevantní informace.
Všem výsledkům typu „nedetekováno při uvedené mezi
detekce“ by mělo být předcházeno předběžným odzkoušením
metod a uspořádání experimentu, neboť takové výsledky
nelze použít pro výpočet rychlostních konstant.
XIII.4 LITERATURA
(1) Connell D.W. (1988). Bioaccumulation behaviour of
persistent chemicals with aquatic organisms. Rev.
Environ. Contam. Toxicol. 102, pp. 117156.
(2) Bintein S., Devillers J., Karcher W. (1993).
Nonlinear dependence of fish bioconcentration on
noctanol/water partition coefficient. SAR and
QSAR in Environmental Research, 1, pp. 29390.
(3) OECD, Paris (1996). Direct phototransformation of
chemicals in water. Environmental Health and
Safety Guidance Document Series on Testing and
Assessment of Chemicals. No 3.
(4) Kristensen P. (1991). Bioconcentration in fish:
comparison of bioconcentration factors derived
from OECD and ASTM testing methods; influence of
particulate organic matter to the bioavailability
of chemicals. Water Quality Institute, Denmark.
(5) US EPA 822R94002 (1994) Great Lake Water Quality
Initiative Technical Support Document for the
Procedure to Determine Bioaccumulation Factors.
July 1994.
(6) US FDA (Food and Drug Administration) Revision.
Pesticide analytical manual, 1, 5600 Fisher's
Lane, Rockville, MD 20852, July 1975.
(7) US EPA (1974). Section 5, A(1). Analysis of Human
or animal Adipose Tissue, in Analysis of
Pesticide Residues in Human and Environmental
Samples, Thompson J. F. (ed.) Research Triangle
Park, N.C. 27711.
(8) Compaan H. (1980) in „The determination of the
possible effects of chemicals and wastes on the
aquatic environment: degradation, toxicity,
bioaccumulation“, Ch. 2.3, Part II. Government
Publishing Office, the Hague, Netherlands.
(9) Gardner et al, (1995). Limn. & Oceanogr. 30, pp.
10991105.
(10) Randall R. C., Lee H., Ozretich R. J., Lake J. L.,
Pruell R. J. (1991). Evaluation of selected lipid
methods for normalising pollutant
bioaccumulation. Envir. Toxicol. Chem. 10, pp
14311436.
(11) CEC, Bioconcentration of chemical substances in
fish: the flowthrough method Ring Test
Programme, 1984 to 1985. Final report March 1987.
Authors: P. Kristensen, N. Nyholm.
(12) ASTM E102284 (Reapproved 1988). Standard
Practice for conducting Bioconcentration Tests
with Fishes and Saltwater Bivalve Molluscs.
PŘÍLOHA 1
Chemické charakteristiky přijatelné ředicí vody
--------------------------------------------------------------- ------------------------
Látka Koncentrační limit
--------------------------------------------------------------- ------------------------
1 Nerozpuštěné látky 5 mg/l
2 Celkový obsah organického uhlíku 2 mg/l
3 Neionizovaný amoniak 1 µg/l
4 Zbytkový chlor 10 µg/l
5 Celkové organofosforové pesticidy 50 ng/l
6 Celkové organochlorové pesticidy a polychlorované bifenyly 50 ng/l
7 Celkový organický chlor 25 ng/l
8 Hliník 1 µg/l
9 Arsen 1 µg/l
10 Chrom 1 µg/l
11 Kobalt 1 µg/l
12 Měď 1 µg/l
13 Železo 1 µg/l
14 Olovo 1 µg/l
15 Nikl 1 µg/l
16 Zinek 1 µg/l
17 Kadmium 100 ng/l
18 Rtuť 100 ng/l
19 Stříbro 100 ng/l
--------------------------------------------------------------- ------------------------
PŘÍLOHA 2
Doporučené druhy ryb pro zkoušení
--------------------------------------------------------------- --------------------------
Doporučený druh Doporučené rozpětí Doporučená celková délka
zkušební teploty těla testovacích jedinců
(st.C) (cm)
--------------------------------------------------------------- --------------------------
1 Danio rerio1 (Teleostei, Cyprinidae) 20 25 3,0 +/- 0,5
(HamiltonBuchanan), danio pruhované
2 Pimephales promelas (Teleostei, 20 25 5,0 +/- 2,0
Cyprinidae) (Rafinesque), střevle
3 Cyprinus carpio (Teleostei, 20 25 5,0 +/- 3,0
Cyprinidae) (Linnaeus), kapr obecný
4 Oryzias latipes (Teleostei, 20 25 4,0 +/- 1,0
Poeciliidae) (Temminck and
Schlegel), halančík japonský
5 Poecilia reticulata (Teleostei, 20 25 3,0 +/- 1,0
Poeciliidae) (Peters), živorodka
duhová
6 Lepomis macrochirus (Teleostei, 20 25 5,0 +/- 2,0
Centrarchidae) (Rafinesque),
slunečnice
7 Oncorhynchus mykiss (Teleostei, 13 17 8,0 +/- 4,0
Salmonidae) (Walbaum), pstruh duhový
8 Gasterosteus aculeatus (Teleostei 18 20 3,0 +/- 1,0
Gasterosteidae) (Linnaeus), koljuška
tříostná
--------------------------------------------------------------- --------------------------
1 Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B.,
Vol. 252, p. 231
V různých zemích byly použity různé druhy estuarinních a
mořských druhů, například:
ryba z čeledi Scienidae (Smuhovití) Leiostomus xanthurus halančík Cyprinodon variegatus ryba z čeledi Argentinidae Menidia beryllina (Stříbronicovití) ryba z čeledi Enbiotocidae Cymatogaster aggregata (Příbojkovití) platýz z čeledi Pleuronectidae Parophrys vertulus vranka z čeledi Cottidae Leptocottus armatus koljuška tříostná Gasterosteus aculeeatus mořčák z čeledi Moronidae Dicentracus labrax ouklej obecná Alburnus alburnus
Dostupnost ryb
Sladkovodní ryby uvedené v seznamu se snadno chovají a/nebo
jsou dobře dostupné po celý rok, zatímco dostupnost mořských
nebo estuarijních ryb je omezena na určité země. Lze je množit
a chovat buď v rybích farmách, nebo v laboratoři za
kontrolovaných zdravotních a parazitologických podmínek tak,
aby ryby byly zdravé a byly známého původu. Tyto ryby jsou
dostupné v mnoha částech světa.
PŘÍLOHA 3
Předpověď délky fáze příjmu a fáze vylučování
1. Předpověď délky fáze příjmu
Před provedením zkoušky lze získat odhad hodnoty k
2
a
odtud lze získat dobu nezbytnou pro dosažení určitého
stupně rovnovážného stavu (v procentech) z empirických
vztahů mezi k2
a rozdělovacím koeficientem noktanol/voda
(Pov) nebo mezi k2
a rozpustností ve vodě (s).
Odhad hodnoty k2 (den-1)
lze získat například z následujícího empirického vztahu (1):
log10 k2 = - 0,414 log10 (Pov) + 1,47 (r2 = 0,95) (1)
Další vztahy viz odkaz 2.
Není-li rozdělovací koeficient
(Pov)
znám, lze jej odhadnout (3) ze znalosti rozpustnosti látky
ve vodě (s) pomocí vztahu:
log10 (Pov) = 0,862 log10(s) + 0,710(r2 = 0,994) (2)
kde s = rozpustnost (v mol/l): (n = 36).
Tyto vztahy platí pouze pro chemikálie s hodnotou log Pov
od 2 do 6,5 (4).
Dobu, za kterou dojde k dosažení určitého stupně rovnovážného stavu
vyjádřeného v procentech, lze získat pomocí odhadu hodnoty k2,
z obecné rovnice kinetiky popisující příjem a vylučování (kinetika prvního řádu):
dCf
----- = k1 . Cw - k2 . Cf
dt
nebo je-li Cw konstanta:
k1
Cf = ----- . Cw (1 - e-k2t) (3)
k2
Blíží-li se rovnovážný stav (t->nekonečno), může být rovnice 3 zjednodušena (5), (6) na
k1
Cf = ------ . Cw nebo Cf /Cw , = k1 /k2 = BCF
k2
Pak
k1 /k2 . Cw
přiblížením koncentrace v rybách v "rovnovážném stavu"(Cf,s).
Rovnice 3 může být přepsána na rovnici:
Cf
Cf = Cf,s (1 - e-k2t) nebo ----- = 1 - e-k2t (4)
Cfs
Použitím rovnice 4 lze předpovědět dobu potřebnou k dosažení
určitého stupně rovnovážného stavu vyjádřeného v procentech,
je-li hodnota k2 předem odhadnuta z rovnice 1 nebo 2.
Je pravidlem, že statisticky optimální délka fáze příjmu pro
získání statisticky přijatelných dat
(BCFk)
je doba nezbytná k tomu, aby křivka sestrojená vynesením
logaritmu koncentrace zkušební látky v rybách proti času v lineárním měřítku dosáhla svého středního bodu, popřípadě
1,6 k2,
neboli 80 % rovnovážného stavu, ale ne více než
3,0 k2,
neboli 95 % rovnovážného stavu (7).
Doba nezbytná pro dosažení 80 % rovnovážného stavuje při použití rovnice 4:
1,6
0,80 = 1 - e-kt2 80 nebo t80 = ------ (5).
k2
Podobně 95 % rovnovážného stavu je dosaženo:
3,0
t95 = ----- (6).
k2
Například délka fáze příjmu (up) pro zkušební látku s log
Pov = 4 je (při použití rovnic 1, 5 a 6):
log10 k2 = - 0,414 . (4) + 1,47 k2 = 0,652 den-1
up (80 %) = 1,6/0,652, tj. 2,45 dnů (59 hodin)
nebo up (95 %) = 3,0/0,652, tj. 4,60 dnů (110 hodin).
Podobně pro zkušební látku s hodnotou
s = 10-5 mol/l (log(s) = 5,0)
je délka fáze (při použití rovnic 1, 2, 5 a 6):
log10 (Pov) = 0,862 (- 5,0) + 0,710 = 5,02
log10 k2 = - 0,414 (5,02) + 1,47
k2 = 0,246 den-1
up (80 %) = 1,6/0,246, tj. 6,5 dnů (156 hodin)
nebo up (95 %) = 3,0/0,246, tj. 12,2 dnů (293 hodin).
Rovnice
teq = 6,54 x 10-3 Pov + 55,31 (hodin)
může být eventuelně použita pro výpočet doby potřebné pro dosažení efektivního rovnovážného stavu (4).2. Předpověď délky fáze vylučování
Předpověď doby nezbytné pro snížení obsahu látky
v organismu na určitou procentuální úroveň počáteční
koncentrace může být rovněž získána z obecné rovnice
kinetiky popisující příjem a vylučování (kinetika prvního
řádu) (1), (8):
V případě fáze vylučování se
Cw předpokládá rovna nule. Rovnice může
být zjednodušena na rovnici:
dCf
----- = k1 . Cw nebo Cf = Cf,0 . e-k2t
dt
kde
Ct,0
je koncentrace na počátku fáze vylučování. 50 % vyloučení
bude dosaženo v čase (t50):
Cf 1 0,693
----- = --- e-k2t nebo t50 = -------
Ct,0 2 k2
Podobně 95 % vyloučení bude dosaženo v čase
3,0
t95 = -----
k2
Jeli pro první fázi zvoleno dosažení 80% příjmu (1,6/k2)
a pro fázi vylučování je zvoleno dosažení 95% úbytku
(3,0/k2), je délka fáze vylučování přibližně dvojnásobkem
délky fáze příjmu.
Je však důležité poznamenat, že odhady jsou založeny na
předpokladu, že se příjem a vylučování řídí kinetikou
prvního řádu. Neřídíli se zjevně kinetikou prvního řádu,
měl by být použit složitější model (např. odkaz (1)).
Literatura (k příloze 3)
(1) Spacie A., Hamelink J. L. (1982). Alternative models
for describing the bioconcentration of organics in
fish. Environ. Toxicol. and Chem. 1, pp. 309320.
(2) Kristensen P. (1991). Bioconcentration in fish:
comparison of BCFs derived from OECD and ASTM
testing methods; influence of particulate matter to
the bioavailability of chemicals. Danish Water
Quality Institute.
(3) Chiou C. T., Schmedding D. W. (1982). Partitioning of
organic compounds in octanolwater systems.
Environ. Sci. Technol. 16 (1), pp. 410.
(4) Hawker D. W., Connell D. W. (1988). Influence of
partition coefficient of lipophilic compounds on
bioconcentration kinetics with fish. Wat. Res. 22
(6), pp. 701707.
(5) Branson D. R., Blau G. E., Alexander H. C., Neely W.
B. (1975). Transactions of the American Fisheries
Society, 104 (4), pp. 785792.
(6) Ernst W. (1985). Accumulation in Aquatic organisms.
In: Appraisal of tests to predict the environmental
behaviour of chemicals. Ed. by Sheehman P., Korte
F., Klein W., Bourdeau P. H. Part 4.4, pp. 243255.
SCOPE, 1985, John Wiley & Sons Ltd N.Y.
(7) Reilly P. M., Bajramovic R., Blau G. E., Branson D.
R., Sauerhoff M. W. (1977). Guidelines for the
optimal design of experiments to estimate
parameters in first order kisnetic models, Can. J.
Chem. Eng. 55, pp. 614622.
(8) Könemann H., Van Leeuwen K. (1980). Toxicokinetics in
fish: Accumulation and Elimination of six
Chlorobenzenes by Guppies. Chemosphere, 9, pp.
319.
PŘÍLOHA 4
Teoretický příklad plánu odběru vzorků pro bioakumulační
zkoušky látek s logP
ov
= 4
--------------------------------------------------------------------
Odběr Plán dob odběru vzorků Počet Počet ryb na vzorek
vzorků ryb vzorků
vody
Minimální Dodatečný
požadovaná odběr
četnost vzorků
(dny)
--------------------------------------------------------------------
Fáze –1 2(*) Přídavek 45 až 80
příjmu 0 2 ryb
1. 0,3 0,4 2 4
(2) (4)
2. 0,6 0,9 2 4
(2) (4)
3. 1,2 1,7 2 4
(2) (4)
4. 2,4 3,3 2 4
(2) (4)
5. 4,7 2 6
--------------------------------------------------------------------
Fáze Přenesení ryb do
vylučování vody neobsahující
zkušební chemikálii
6. 5,0 5,3 4
(4)
7. 5,9 7,0 4
(4)
8. 9,3 11,2 4
(4)
9. 14,0 17,5 6
(4)
--------------------------------------------------------------------
(*) Odběr vzorku vody po dodání alespoň tří „objemů nádrže“.
Hodnoty v závorkách jsou počty vzorků (vody, ryb), které mají
být odebrány, je prováděn dodatečný odběr.
Poznámka: Předběžný odhad k
2
pro logPov
rovný 4,0 je 0,652 den-1
. Celková délka experimentu
je
stanovena na
3 × up = 3 × 4,6 dnů, tj. 14 dnů. Odhad hodnoty „up“ viz
příloha 3.
PŘÍLOHA 5
Omezení modelu
U většiny bioakumulačních dat se předpokládá, že jsou „rozumně“
dobře popsány jednoduchým modelem se dvěma kompartmenty/dvěma
parametry, jak je patrné z přímky, která aproximuje body pro
koncentrace v rybách během fáze vylučování, jeli vynesena
na semilogaritmickém papíru. (Nelzeli tyto body popsat
přímkou, měl by být použit složitější model (viz například
Spacie a Hamelik, odkaz 1 v příloze 3).
Grafická metoda stanovení rychlostní konstanty vylučování
(úbytku) k
2
Koncentrace zkušební látky nalezená v každém vzorku ryb se
vynese na semilogaritmickém papíru proti času odběru vzorků.
Směrnice této přímky je rovna k
2
.Je třeba si všimnout, že odchylky od přímky mohou znamenat
složitější model vylučování, než je kinetika prvního řádu. Pro
analýzu typů vylučování, které se odchylují od kinetiky prvního
řádu, mohou být použity grafické metody.
Grafická metoda stanovení rychlostní konstanty příjmu k1
Při dané konstantě k2se k1vypočte následujícím způsobem: CLk2k1= ------------------- (1) Cwx (1 - e-k2t) Hodnota Cfse odečte ze středního bodu hladké křivky příjmu vytvořené vynesením logaritmu koncentrace proti času (v lineárním měřítku).
Metoda výpočtu rychlostních konstant příjmu a vylučování
(úbytku) s využitím počítače
Upřednostňovanou metodou pro získání hodnoty bioakumulačního
faktoru a rychlostních konstant k
1
a k2
je metoda nelineárního
odhadu parametrů s využitím počítače. Těmito programy se
naleznou hodnoty k1
a k2
založené na sadě po sobě jdoucích dat
koncentrací a na modelu:
k1
Cf = Cw . ---- x (1 - e-k2t) 0 < t < tc (2)
k2 (2)
k1
Cf = Cw . ---- x (e-k2 (t - t )tc - e-k2t) t < tc (3)
k2
kde tc = čas konce fáze příjmu.
Tento přístup poskytuje odhady směrodatné odchylky k1
a k2
.
Vzhledem k tomu, že ve většině případů lze odhadnout k2
z křivky vylučování s relativně vysokou přesností a vzhledem
k tomu, že mezi těmito dvěma parametry k1
a k2
existuje silná
korelace, jsouli odhadovány současně, může být účelné nejdříve
vypočítat k2
pouze z dat vylučování a následně vypočítat k1
z dat příjmu pomocí nelineární regrese.XIV. METODA PRO STANOVENÍ RŮSTU NA NEDOSPĚLÝCH RYBÁCH – METODA
C.14 PODLE PŘÍLOHY SMĚRNICE KOMISE 2001/59/ES ZE DNE 6. SRPNA
2001, KTEROU SE PO DVACÁTÉ OSMÉ PŘIZPŮSOBUJE TECHNICKÉMU
POKROKU SMĚRNICE RADY 67/548/EHS O SBLIŽOVÁNÍ SPRÁVNÍCH A
PRÁVNÍCH PŘEDPISŮ TÝKAJÍCÍCH SE KLASIFIKACE, BALENÍ A
OZNAČOVÁNÍ NEBEZPEČNÝCH LÁTEK (DÁLE JEN „SMĚRNICE 2001/59/ES“)
XIV.1 METODA
Metoda růstové zkoušky pro stanovení toxicity je
replikou metody OECD TG 215 (2000).
XIV.1.1 ÚVOD
Zkouška je určena k posouzení účinků dlouhodobé
expozice chemickým látkám na růst nedospělých ryb. Je
založena na metodě pro posouzení účinků chemických
látek na růst nedospělého pstruha duhového (Oncorynchus
mykiss) při průtokových podmínkách, která byla vyvinuta
v Evropské unii a testována v okružních testech (1, 3).
Mohou být použity také jiné dobře popsané druhy. Byly
například získány zkušenosti z růstových zkoušek
s daniem pruhovaným (Danio rerio) (2, 4, 5) a
halančíkem japonským (Oryzias latipes) (6, 7, 8).
Viz také obecný úvod, část C.
XIV.1.2 DEFINICE
Nejnižší koncentrace s pozorovanými účinky (Lowest
observed effect concentration, LOEC): je nejnižší
zkoušená koncentrace zkoušené látky, při níž jsou u
látky pozorovány významné účinky ve srovnání
s kontrolou (na úrovni pravděpodobnosti falešně
pozitivního hodnocení p < 0,05). Všechny zkoušené
koncentrace vyšší než LOEC musí mít stejné nebo
vážnější škodlivé účinky, než účinky pozorované při
koncentraci LOEC.
NOEC (no observed effect concentration, koncentrace bez
pozorovaných účinků): je zkušební koncentrace
bezprostředně nižší než LOEC.
ECx: je pro tuto metodu koncentrace zkoušené látky,
která vyvolává x% změnu rychlosti růstu ryb ve srovnání
s kontrolami.
Velikost násady: je živá hmotnost ryb v jednotce objemu
vody.
Hustota obsádky: je počet ryb v jednotce objemu vody.
Individuální specifická rychlost růstu ryby: vyjadřuje
rychlost růstu jedince vycházející z jeho výchozí
hmotnosti.
Průměrná specifická rychlost růstu pro nádrž: vyjadřuje
střední rychlost růstu populace v nádrži při určité
koncentraci.
Pseudospecifická rychlost růstu: vyjadřuje rychlost
růstu jednotlivce vycházející ze střední počáteční
hmotnosti populace v nádrži.
XIV.1.3 PODSTATA ZKUŠEBNÍ METODY
Nedospělé ryby v exponenciální fázi růstu se po zvážení
umístí do zkušebních nádrží a vystaví se řadě
subletálních koncentrací zkoušené látky nejlépe za
průtokových podmínek, nebo, pokud možno za vhodných
semistatických podmínek (statické podmínky s obnovením
média). Zkouška trvá 28 dnů. Ryby se krmí denně. Přísun
potravy se řídí počáteční hmotností ryb a může být po
14 dnech nově vypočten. Na konci zkoušky se ryby opět
zváží. Účinky na rychlost růstu se analyzují pomocí
regresního modelu s cílem odhadnout koncentraci, která
vyvolává x% změnu rychlosti růstu, tj. ECx (např. EC10,
EC20 nebo EC30). Data mohou být popřípadě porovnána
s hodnotami pro kontrolní skupiny s cílem stanovit
nejnižší koncentraci s pozorovanými účinky (LOEC) a tím
i koncentraci bez pozorovaných účinků (NOEC).
XIV.1.4 INFORMACE O ZKOUŠENÉ LÁTCE
Výsledky zkoušky akutní toxicity (viz zkušební metoda
C.1) provedené nejlépe na druhu zvolenému pro tuto
zkoušku již musí být předloženy. To znamená, že jsou
známy rozpustnost zkoušené látky ve vodě a tlak jejích
par a je k dispozici vhodná analytická metoda pro
kvantitativní stanovení látky ve zkušebních roztocích,
a to se známou a doloženou správností a známou mezí
stanovitelnosti.
Užitečnými informacemi jsou strukturní vzorec, čistota
látky, její stálost ve vodě a na světle, pKa, P
o/v
a
výsledky zkoušky snadné biologické rozložitelnosti (viz
zkušební metoda C.4).XIV.1.5 VALIDITA ZKOUŠKY
Má-li být zkouška platná, musí být splněny následující
podmínky:
— mortalita v kontrolních zkouškách nesmí být na konci
zkoušky větší než 10 %,
— nárůst střední hodnoty hmotnosti ryb v kontrolní
skupině (skupinách) musí být dostatečný na to, aby
umožnil rozeznat minimální významnou změnu
rychlosti růstu. Okružní test (3) ukázal, že u
pstruha duhového musí střední hmotnost ryb
v kontrolních skupinách vzrůst alespoň o polovinu
(tj. o 50 %) jejich počáteční hmotnosti za 28 dnů;
např. počáteční hmotnost: 1 g/rybu (= 100 %),
konečná hmotnost po 28 dnech: >= 1,5 g/rybu
(>= 150 %),
— koncentrace rozpuštěného kyslíku musí dosahovat
alespoň 60 % hodnoty nasycení vzduchem (ASV) po
celou dobu zkoušky,
— teplota vody se po celou dobu zkoušky nesmí mezi
zkušebními nádržemi lišit o více než +/- 1 st.C a
měla by být udržována v rozpětí 2 st.C v rozsahu
teplot stanovených pro zkušební druh (dodatek 1).
XIV.1.6 POPIS ZKUŠEBNÍ METODY
XIV.1.6.1 Přístroje a pomůcky
Normální laboratorní vybavení a zejména:
a) oxymetr a pH metr;
b) vybavení pro stanovení tvrdosti vody a alkality;
c) vhodné zařízení pro regulaci teploty a pro její
pokud možno nepřetržité sledování;
d) nádrže z chemicky inertního materiálu o vhodném
objemu vzhledem k doporučenému nasazování a obsádce
(viz bod 1.8.5 a dodatek 1);
e) vhodné přesné váhy (tj. vážící s přesností na +/-
0,5 %).
XIV.1.6.2 Voda
Jako zkušební voda může být použita jakákoli voda,
v níž zkušební druh dlouhodobě přežívá a roste. Měla by
mít po celou dobu zkoušky stejnou kvalitu. Hodnota pH
vody by měla být v rozmezí 6,5 až 8,5, avšak během
zkoušky by se pH nemělo lišit o více než +/- 0,5.
Doporučuje se tvrdost nad 140 mg/l (jako CaCO
3
).
S cílem zajistit, aby ředicí voda neměla nadměrný vliv
na výsledek zkoušky (například v důsledku tvorby
komplexů zkušební látky), by měly být v určitých
intervalech odebírány vzorky k analýze. Jeli kvalita
ředicí vody relativně konstantní, mělo by být stanovení
těžkých kovů (např. Cu, Pb, Zn, Hg, Cd a Ni), hlavních
aniontů a kationtů (např. Ca, Mg, Na, K, Cl a SO4
),
pesticidů (např. celkový obsah organických fosforových
a chlorových pesticidů), celkový obsah organického
uhlíku a suspendovaných látek provedeno např. každé tři
měsíce. Jeli prokázáno, že kvalita vody je konstantní
po dobu alespoň jednoho roku, mohou být stanovení méně
častá a intervaly lze prodloužit (např. každých šest
měsíců). Některé chemické charakteristiky přijatelné
ředicí vody jsou uvedeny v dodatku 2.XIV.1.6.3 Zkušební roztoky
Zkušební roztoky o zvolených koncentracích se připraví
ředěním zásobního roztoku.
Zásobní roztok by měl být připraven nejlépe jednoduchým
mechanickým mícháním nebo protřepáváním zkoušené látky
v ředicí vodě (např. mechanickým mícháním nebo
sonifikací). Pro dosažení vhodné koncentrace zásobního
roztoku mohou být použity saturační kolony.
V některých případech může být pro vytvoření zásobního
roztoku o vhodné koncentraci nezbytné použití
rozpouštědel nebo dispergátorů (solubilizačních
činidel). Ke vhodným rozpouštědlům patří aceton,
ethanol, methanol, dimethylsulfoxid, dimethylformamid a
triethylenglykol. Ke vhodným dispergátorům patří
Cremophor RH40, Tween 80, 0,01% methylcelulosa a HCO-
40. Snadno biologicky rozložitelná činidla (např.
aceton) nebo vysoce těkavé sloučeniny je třeba používat
rozvážně, neboť mohou způsobit problémy s růstem
bakterií v průtokových zkouškách. Jeli použito
solubilizační činidlo, nesmí mít významné účinky na
růst ryb ani viditelné nepříznivé účinky na nedospělé
ryby, což musí být prokázáno na kontrolní skupině
vystavené pouze rozpouštědlu.
Při průtokových zkouškách je pro zajištění řady
koncentrací nezbytný systém, který nepřetržitě dávkuje
a ředí zásobní roztok zkoušené látky (např. dávkovací
čerpadlo, zařízení pro proporcionální ředění, saturační
systém). Průtok zásobních roztoků a ředicí vody by měl
být v průběhu zkoušky kontrolován v určitých
intervalech, nejlépe denně, a neměl by se v průběhu
zkoušky měnit o více než 10 %. Okružní test (3) ukázal,
že u pstruha duhového je přijatelná výměna vody 6 litrů
na gram ryb za den (viz bod 1.8.2.2).
U semistatických zkoušek (s obnovením média) bude
častost obnovování média záviset na stálosti zkoušené
látky, avšak doporučuje se obnovovat vodu denně.
Neníli podle předběžných zkoušek stálosti (viz
bod 1.4) koncentrace zkoušené látky mezi obnoveními
média stálá, (tj. nepohybuje se v intervalu 80 – 120 %
nominální koncentrace nebo klesá pod 80 % naměřené
počáteční koncentrace), měla by být zvážena průtoková
zkouška.
XIV.1.6.4 Výběr druhů
Pstruh duhový (Oncorhynchus mykiss) je doporučeným
druhem pro tuto zkoušku, neboť u něj bylo v okružních
testech získáno nejvíce zkušeností (1, 3). Mohou však
být použity jiné dobře popsané druhy, může však být
nutné zkušební postup upravit, aby byly vytvořeny
vhodné zkušební podmínky. Jsou například zkušenosti
s daniem pruhovaným (Danio rerio) (4, 5) a halančíkem
japonským (Oryzias latipes) (6, 7, 8). V takovém
případě by měly být uvedeny v závěrečné zprávě důvody
pro výběr druhu a experimentální podmínky.
XIV.1.6.5 Chov ryb
Testovací ryby by měly pocházet z jednoho chovu
(nejlépe ze stejného tření), který se alespoň dva týdny
před zkouškou udržuje v podmínkách kvality vody a
osvětlení, které jsou podobné podmínkám použitým ve
zkoušce. V průběhu chovu a v průběhu zkoušky by měly
být krmeny množstvím potravy odpovídajícím minimálně
2 % tělesné hmotnosti za den a nejlépe 4 % tělesné
hmotnosti za den.
Po 48hodinové aklimatizaci se zaznamená mortalita a
použijí se následující kritéria:
— mortality vyšší než 10 % populace za sedm dnů:
vyměnit celou obsádku;
— mortality od 5 % do 10 % populace: aklimatizace
dalších sedm dnů; jeli mortalita během
následujících sedmi dnů vyšší než 5 %, vymění se
celá obsádka,
— mortalita nižší než 5 % populace za sedm dnů: obsádka
se přijme.
Dva týdny před zkouškou nebo v průběhu zkoušky nesmí
být léčeny u ryb žádné nemoci.
XIV.1.7 USPOŘÁDÁNÍ ZKOUŠKY
„Uspořádáním zkoušky“ se rozumí výběr počtu zkušebních
koncentrací a jejich odstupňování, počet nádrží pro
každou koncentraci a počet ryb v nádrži. Uspořádání by
mělo být v ideálním případě zvoleno s ohledem na:
a) cíl studie;
b) metodu statistické analýzy, která bude použita;
c) dostupnost a cenu prostředků pro experiment.
Požadováno je stanovení statistické významnosti,
s jakou má být daná velikost změny (např. změny
rychlosti růstu) rozeznána, nebo přesnost, s jakou má
být odhadnuta hodnota EC
x
(např. x = 10, 20 nebo 30,
pokud možno ne méně než 10). Bez toho nelze stanovit
přesný rozsah studie.
Je důležité vzít na vědomí, že uspořádání, které je
optimální při použití jedné metody statistické analýzy
(nejlépe využívá prostředky), není nezbytně optimální
pro jinou metodu. Doporučené uspořádání pro odhad
LOEC/NOEC tedy nebývá stejné jako uspořádání pro
analýzu regresí.
V mnoha případech se regresní analýze dává přednost
před analýzou variance, a to z důvodů diskutovaných
Stephanem a Rogersem (9). Neníli však nalezen vhodný
regresní model (r2 < 0,9), měl by být stanoven poměr
NOEC/LOEC.
XIV.1.7.1 Uspořádání pro analýzu regresí
Pro uspořádání zkoušky, která má být analyzována
regresí, jsou důležité tyto zřetele:
a) koncentrace použité ve zkoušce musí v každém případě
pokrývat koncentraci vyvolávající účinek (např.
EC
10,20,30
) a rozsah koncentrací, při nichž dochází
ke sledovanému účinku. Přesnost, s jakou mohou být
odhadnuty koncentrace vyvolávajících účinek, bude
nejlepší, budeli koncentrace vyvolávající účinek
ležet uprostřed rozsahu zkušebních koncentrací. Při
výběru vhodných zkušebních koncentrací mohou být
užitečné předběžné orientační zkoušky. b) aby mohl být vytvořen uspokojivý statistický model,
měla by zkouška zahrnovat alespoň jednu kontrolní
nádrž a pět dalších nádrží o různých koncentracích.
Podle vhodnosti by při použití solubilizačního
činidla měla být vedle zkušebních skupin nasazena
jedna kontrolní skupina vystavená koncentraci
solubilizačního činidla použité při nejvyšší
zkušební koncentraci (viz body 1.8.3 a 1.8.4);
c) může být použita vhodná geometrická nebo
logaritmická řada koncentrací (10) (viz dodatek 3).
Upřednostňuje se logaritmické stupňování
koncentrací;
d) jeli k dispozici více než šest nádrží, měly by být
další nádrže použity buď pro duplicitní stanovení,
nebo by měly být použity pro koncentrace rozložené
v rozsahu koncentrací tak, aby se zmenšily
rozestupy mezi koncentracemi. Obě použití lze
doporučit stejnou měrou.
XIV.1.7.2 Uspořádání pro odhad NOEC/LOEC analýzou variance
(ANOVA)
Pro každou koncentraci by měly být nejlépe k dispozici
nádrže pro duplicitní stanovení, statistická analýza by
měla být provedena pro každou jednotlivou nádrž (11).
Bez duplicitních nádrží není možné zohlednit jinou
variabilitu mezi nádržemi, než jaká je důsledkem
rozdílů mezi jednotlivými rybami. Zkušenosti ale
ukazují (12), že variabilita mezi nádržemi byla velmi
malá ve srovnání s variabilitou v rámci nádrže
(tj. mezi rybami). Relativně přijatelnou alternativou
je tedy provedení statistické analýzy pro jednotlivé
ryby.
Zpravidla se použije alespoň pět zkušebních koncentrací
tvořících geometrickou řadu s faktorem nepřekračujícím
3,2.
Provádí-li se zkouška s duplicitními nádržemi, měl by
být počet duplicitních kontrolních nádrží, a tedy i
počet ryb, dvojnásobkem počtu ryb pro každou zkoušenou
koncentraci, který by měl být pro všechny koncentrace
stejný (13, 14, 15). Nejsouli naproti tomu duplicitní
nádrže použity, měl by být v kontrolní skupině stejný
počet ryb jako ve skupině pro každou zkušební
koncentraci.
Jeli ANOVA založena na nádržích namísto jednotlivých
rybách (což by znamenalo buď ryby jednotlivě označit
nebo použít „pseudospecifickou“ rychlost růstu (viz bod
2.1.2)), je nezbytné počet nádrží dostatečně znásobit,
aby bylo možné stanovit odchylku pro nádrže v rámci
jednotlivé koncentrace. To znamená, že by měl být počet
stupňů volnosti pro chybu v analýze variance alespoň 5
(11). Jsouli duplicitně použity pouze kontroly,
existuje nebezpečí, že bude variabilita chyby
vychýlena, neboť může narůstat se střední hodnotou
dotyčné rychlosti růstu. Vzhledem k tomu, že rychlost
růstu s největší pravděpodobností klesá s rostoucí
koncentrací, povede to k nadhodnocení variability.
XIV.1.8 POSTUP
XIV.1.8.1 Výběr a vážení testovacích ryb
Je důležité minimalizovat rozdíly v hmotnostech ryb na
začátku zkoušky. Vhodná rozpětí velikostí ryb různých
druhů doporučených pro tuto zkoušku jsou uvedena
v dodatku 1. Rozpětí individuálních hmotností na
začátku zkoušky by mělo být pro celou násadu ryb
použitých ve zkoušce nejlépe +/- 10 % aritmetického
průměru hmotností a v žádném případě by nemělo
překročit 25 %. Doporučuje se zvážit před zkouškou
menší vzorek ryb s cílem odhadnout střední hodnotu
hmotnosti.
24 hodin před zahájením zkoušky se obsádka ryb přestane
krmit. Poté se provede náhodný výběr ryb. Za použití
běžného anestetika (např. vodný roztok
trikainmethansulfonátu (MS 222) o koncentraci 100 mg/l
neutralizovaný přídavkem dvou dílů hydrogenuhličitanu
sodného na jeden díl MS 222) se ryby jednotlivě
s přesností uvedenou v dodatku 1 zváží za účelem
stanovení živé hmotnosti (po osušení do sucha). Ryby
s hmotností v požadovaném rozsahu se náhodně rozdělí do
nádrží. Zaznamená se celková živá hmotnost ryb v každé
zkušební nádrži. Při manipulaci s rybami za použití
anestetik (včetně osušení a zvážení) může u nedospělých
ryb, a zejména u druhů o malé velikosti, dojít ke
stresu a poranění. S nedospělými rybami se tedy musí
manipulovat s nejvyšší opatrností, aby nedošlo u
zkušebních ryb ke stresu a poranění.
Ryby se opět zváží po 28 dnech zkoušky (viz bod 1.8.6).
Považujeli se však za nezbytné nově vypočítat přísun
potravy, mohou být ryby opět zváženy po 14 dnech
zkoušky (viz bod 1.8.2.3). Ke stanovení změn velikosti
ryb, na jejichž základě se upravuje přísun potravy,
může být použita jiná metoda, např. fotografická
metoda.
XIV.1.8.2 Podmínky expozice
XIV.1.8.2.1 Délka expozice
Zkouška trvá více než 28 dnů.
XIV.1.8.2.2 Velikost násady a hustota obsádky
Je důležité, aby velikost násady a hustota obsádky
vyhovovaly použitému zkušebnímu druhu (viz dodatek 1).
Jeli hustota obsádky příliš vysoká, dojde ke stísnění
vedoucímu ke snížené rychlosti růstu a popřípadě
k nemocem. Jeli příliš nízká, může vyvolat
teritoriální chování, což by mohlo rovněž ovlivnit
růst. V každém případě by měla být velikost násady tak
nízká, aby bylo možné udržet koncentraci rozpuštěného
kyslíku na alespoň 60 % ASV bez provzdušňování. Okružní
test (3) ukázal, že u pstruha duhového je velikost
násady 16 ryb o hmotnosti 3 – 5 g do objemu 40 litrů
přijatelná. Doporučené obnovování vody během zkoušky je
6 litrů na gram ryb za den.
XIV.1.8.2.3 Krmení
Ryby by měly být krmeny dostatečným množstvím vhodného
krmiva (dodatek 1), aby byla umožněna přijatelná
rychlost růstu. Je třeba dbát na to, aby nedošlo
k růstu mikroorganismů a k zakalení vody. U pstruha
duhového by mělo těmto požadavkům vyhovovat množství
odpovídající 4 % jejich tělesné hmotnosti za den (3,
16, 17, 18). Denní množství může být rozděleno na dva
stejné podíly a podáno rybám dvakrát za den s odstupem
alespoň pěti hodin.
Množství se řídí počáteční hmotností ryb v jednotlivé
zkušební nádrži. Ryby se opět zváží 14. den a množství
se nově vypočte. 24 hodin před vážením se ryby
přestanou krmit. Nespotřebovaná potrava a výkaly se ze
zkušebních nádrží každý den odstraní důkladným odsátím
ze dna každé nádrže.
XIV.1.8.2.4 Světlo a teplota
Fotoperioda a teplota vody by měly vyhovovat zkušebním
druhům (dodatek 1).
XIV.1.8.3 Zkušební koncentrace
Obvykle je nutných pět koncentrací zkoušené látky, a to
bez ohledu na uspořádání zkoušky (viz bod 1.7.2). Při
volbě vhodných zkušebních koncentrací by měla pomoci
předcházející znalost toxicity zkoušené látky (např. ze
zkoušek akutní toxicity nebo z orientačních studií).
Použijeli se méně než pět koncentrací, mělo by být
uvedeno odůvodnění. Nejvyšší zkušební koncentrace by
neměla překročit rozpustnost látky ve vodě.
Použijeli se k usnadnění přípravy zásobního roztoku
solubilizační činidlo, neměla by být jeho konečná
koncentrace vyšší než 0,1 ml/l a měla by být ve všech
zkušebních nádržích stejná (viz bod 1.6.3). Měla by
však být vynaložena maximální snaha takové látky
nepoužívat.
XIV.1.8.4 Kontrolní skupiny
Počet kontrolních skupin v ředicí vodě závisí na
uspořádání zkoušky (viz body 1.7 až 1.7.2). Použijeli
se solubilizační činidlo, měl by být nasazen stejný
počet kontrolních skupin se solubilizačním činidlem
jako s ředicí vodou.
XIV.1.8.5 Častost analytických stanovení a měření
Během zkoušky se v pravidelných intervalech (viz níže)
stanovují koncentrace zkoušené látky
Při průtokových zkouškách se průtok zásobních roztoků
toxické látky a ředicí vody kontroluje v určitých
intervalech, nejlépe denně, a neměl by se v průběhu
zkoušky měnit o více než 10 %. Očekávají-li se změny
koncentrace zkoušené látky v rozmezí +/- 20 %
nominálních hodnot (tj. od 80 – 120 %, viz body 1.6.2 a
1.6.3), doporučuje se, aby byly nejnižší a nejvyšší
zkoušené koncentrace analyzovány na začátku zkoušky a
poté v týdenních intervalech. U zkoušek, u nichž se (na
základě dat o stálosti látky) nepředpokládá, že se bude
koncentrace zkoušené látky pohybovat v rozmezí +/- 20 %
nominální hodnoty, je nezbytné analyzovat všechny
zkušební koncentrace, a to stejně často jako u
stabilních látek.
U semistatických zkoušek (s obnovením média), u nichž
se má zkušební koncentrace pohybovat v rozmezí +/- 20 %
nominálních hodnot, se doporučuje analyzovat nejvyšší a
nejnižší zkušební koncentrace na začátku studie ihned
po jejich přípravě a bezprostředně před obnovením a
poté v týdenních intervalech. U zkoušek, u nichž se
nepředpokládá, že se bude zkušební koncentrace
pohybovat v rozmezí +/- 20 nominální hodnoty, musí být
všechny koncentrace analyzovány stejně často jako u
stabilnějších látek.
Doporučuje se zakládat výsledky na naměřených
koncentracích. Lze-li však prokázat, že po celou dobu
zkoušky byla koncentrace zkoušené látky v roztoku
uspokojivě udržována v rozmezí +/-20 % nominální
hodnoty, mohou být výsledky založeny na nominálních
nebo naměřených hodnotách.
Může být nezbytné vzorky filtrovat (např. přes
filtr velikostí pórů 0,45 µm) nebo odstředit.
Doporučuje se odstřeďování. Filtrace je přípustná jen
neadsorbujeli se zkoušená látka na filtry.
V průběhu zkoušky se měří v každé zkušební nádrži
množství rozpuštěného kyslíku, pH a teplota. Celková
tvrdost, alkalita a popřípadě solnost se měří
v kontrolních nádržích a v jedné nádrži s nejvyšší
koncentrací. Množství rozpuštěného kyslíku a solnost
(podle potřeby) se měří alespoň třikrát (na začátku,
uprostřed a na konci zkoušky). U semistatických zkoušek
se doporučuje měřit množství rozpuštěného kyslíku
častěji, nejlépe před každým obnovením média a po něm,
nebo alespoň jednou týdně. pH se měří na začátku a na
konci každé výměny vody u statických zkoušek a alespoň
týdně u průtokových zkoušek. Tvrdost vody a alkalita se
měří v každé zkoušce jednou. Teplota se měří nejlépe
nepřetržitě alespoň v jedné zkušební nádrži.
XIV.1.8.6 Pozorování
Hmotnost: na konci každé zkoušky se musí ryby, které
přežily, zvážit za účelem XIV.stanovení živé hmotnosti
(po osušení do sucha), a to buď jako skupina pro každou
zkušební nádrž, nebo jednotlivě. Vážení ryb jako skupin
se upřednostňuje před vážením jednotlivých ryb, které
vyžaduje, aby byly ryby jednotlivě označeny. V případě
vážení jednotlivých ryb pro stanovení individuální
specifické rychlosti růstu by neměla zvolená technika
označení vyvolávat u ryb stres (alternativou ke značení
ryb vymražením značky může být popřípadě použití
barevného rybářského vlasce).
Ryby se v průběhu zkoušky vyšetřují denně a
zaznamenávají se jakékoli odchylky (hemoragie,
odbarvení) a neobvyklé chování. Každý úhyn se zaznamená
a uhynulé ryby se co nejdříve odstraní. Uhynulé ryby se
nenahrazují, neboť velikost násady a hustota obsádky by
měly být dostatečné na to, aby nedošlo k ovlivnění
růstu v důsledku změn počtu ryb. Bude však nutné
upravit množství krmiva.
XIV.2 DATA A ZPRÁVY
XIV.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Doporučuje se, aby se návrhu zkoušky i analýzy výsledků
zkoušky účastnil statistik, neboť tato zkušební metoda
umožňuje značné variace v experimentálním uspořádání,
například v počtu zkušebních nádrží, v počtu zkušebních
koncentrací, v počtu ryb. Pokud jde o možnosti
uspořádání zkoušky, nejsou zde uvedeny žádné pokyny.
Rychlost růstu se nevypočítává pro zkušební nádrže,
v nichž mortalita překročila 10 %. Velikost mortality
se ale uvede pro všechny zkušební koncentrace.
Bez ohledu na použitou metodu je hlavním ukazatelem
specifická rychlost růstu r od okamžiku t
1
do t2
. Může
být definována několika způsoby v závislosti na tom,
zda jsou či nejsou ryby individuálně značeny nebo zda
se požaduje průměrná hodnota pro nádrž.
kde:
r1 = individuální specifická rychlost růstu ryby
r2 = průměrná specifická rychlost růstu pro nádrž
r3 = „pseudospecifická“ rychlost růstu
w1, w2 = hmotnosti určité ryby v čase t1 a t2
loge w1 = logaritmus hmotnosti jednotlivé ryby na
začátku vyšetřovacího intervalu
loge w2 = logaritmus hmotnosti jednotlivé ryby na konci
vyšetřovacího intervalu
loge w1 = průměr logaritmů hodnot w1 pro ryby
v nádrži na začátku vyšetřovacího intervalu
loge w2 = průměr logaritmů hodnot w2 pro ryby v nádrži
na konci vyšetřovacího intervalu
t1, t2 = čas (ve dnech) začátku a konce
vyšetřovacího intervalu
r1, r2, r3 mohou být vypočteny pro interval 0 – 28 dnů
a popřípadě (byloli provedeno měření 14. den) pro
intervaly 0 – 14 a 14 – 28 dnů.XIV.2.1.1 Analýza výsledků regresí (modelování závislosti
koncentrace – odezva)
Touto metodou se závislostí mezi specifickou rychlostí
růstu a koncentrací proloží vhodná matematická funkce,
a to umožní odhadnout „EC
x
“, tj. jakoukoli požadovanou
hodnotu EC. U této metody není nutný výpočet r pro
jednotlivou rybu (r1
) a namísto toho se analýza založí
na průměrné hodnotě r (r2
) pro nádrž. Dává se přednost
posledně uvedené metodě. Je také vhodnější při použití
velmi malých druhů.
Průměrné specifické rychlosti růstu pro nádrž (r
2
) se
graficky vynesou proti koncentraci kvůli kontrole
závislosti odezvy. K vyjádření závislosti r
2
na koncentraci se zvolí
vhodný model; jeho volba musí být řádně zdůvodněna.
Lišíli se pro jednotlivé nádrže počty ryb, které
přežily, prokládá se vážený model s cílem zohlednit
různé velikosti skupin. Metoda proložení modelu musí umožnit odhadnout
například hodnotu EC
20
a stanovit její rozptyl (buď
směrodatnou odchylku nebo interval spolehlivosti). Graf
proloženého modelu se vynese spolu s daty, aby byla
zřejmá vhodnost použitého modelu (9, 19, 20, 21).XIV.2.1.2 Analýza výsledků pro stanovení LOEC
Byloli ve zkoušce použito pro každou koncentraci více
nádrží, může být odhad LOEC založen na analýze variance
(ANOVA) průměrné specifické rychlosti růstu pro nádrž
(viz bod 2.1) následované vhodným srovnáním průměrné
hodnoty r pro každou koncentraci s průměrnou hodnotou r
pro kontrolní skupiny (např. Dunnettovým nebo
Williamsovým testem (13, 14, 15, 22)), aby se zjistila
nejmenší koncentrace, u níž je na úrovni
pravděpodobnosti 0,05 rozdíl významný. Nejsouli
předpoklady pro použití parametrických metod splněny,
kvůli jinému než normálnímu rozdělení (např. se použije
Shapiro-Wilkův test) nebo kvůli heterogennímu rozptylu
(Bartlettův test), měla by být před provedením ANOVA
zvážena transformace dat za účelem homogenizace
rozptylů nebo by měla být provedena vážená ANOVA.
Není-li pro každou koncentraci počet nádrží znásoben,
nebude ANOVA u jednotlivé nádrže citlivá nebo bude
nemožná. V takovém případě je přijatelným kompromisem
založit ANOVA na „pseudospecifické“ rychlosti růstu r3
nebo na jednotlivých rybách.
Průměrná hodnota r3 pro každou koncentraci může být
poté porovnána s průměrnou hodnotou r3 pro kontrolní
skupiny. Hodnotu LOEC lze poté nalézt výše uvedeným
způsobem. Je třeba vzít na vědomí, že tato metoda
neumožňuje zohlednit variabilitu mezi nádržemi ve větší
míře, než s jakou se počítá v důsledku variability mezi
rybami, a ani před ní nechrání. Ukázalo se však (9), že
variabilita mezi nádržemi byla ve srovnání
s variabilitou v rámci nádrže (tj. mezi rybami) velmi
malá. Nejsouli v analýze využity jednotlivé ryby,
musí být ve zprávě uvedena metoda nalezení odlehlých
hodnot a její použití musí být zdůvodněno.
XIV.2.2 INTERPRETACE VÝSLEDKŮ
Výsledky je třeba interpretovat opatrně, leží-li
naměřené hodnoty koncentrací toxické látky v roztocích
blízko meze stanovitelnosti analytické metody, nebo
klesáli u semistatických zkoušek koncentrace zkoušené
látky od okamžiku přípravy roztoku do jeho obnovení.
XIV.2.3 PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat následující
informace:
XIV.2.3.1 Zkoušená látka
— fyzikální stav a relevantní fyzikálněchemické
vlastnosti,
— údaje o chemické identitě včetně údajů o čistotě a
podle potřeby o metodě kvantitativního stanovení
zkoušené látky.
XIV.2.3.2 Testovací druh
— vědecký název, podle možnosti,
— kmen, velikost, původ, jakákoli příprava atd.,
XIV.2.3.3 Zkušební podmínky
— použitý zkušební postup (např.
semistatický/s obnovením, průtokový, nasazování,
hustota obsádky atd.),
— uspořádání zkoušky (např. počet zkušebních nádrží,
zkušební koncentrace a znásobení počtu nádrží,
počet ryb v nádrži),
— metoda přípravy zásobních roztoků a častost
obnovování (jeli použito, uvede se solubilizační
činidlo a jeho koncentrace),
— nominální zkušební koncentrace, střední hodnota
naměřených hodnot v jednotlivých nádržích, její
směrodatná odchylka a metody jejich stanovení a
důkazy toho, že naměřené hodnoty odpovídají
koncentracím zkoušené látky v pravém roztoku,
— charakteristiky ředicí vody: pH, alkalinita, tvrdost,
teplota, koncentrace rozpuštěného kyslíku,
koncentrace zbytkového chloru (jeli měřena), obsah
celkového organického uhlíku, obsah suspendovaných
látek, popřípadě solnost zkušebního média a
výsledky jakýchkoli jiných provedených měření,
— kvalita vody ve zkušebních nádržích: pH, tvrdost,
teplota a koncentrace rozpuštěného kyslíku,
— podrobné informace o krmení (např. druh krmiva
(krmiv), původ, podávané množství a frekvence
krmení).
XIV.2.3.4 Výsledky
— doklady o tom, že kontrolní skupiny vyhověly kriteriu
přežití, a data o mortalitě pro každou zkušební
koncentraci,
— použité metody statistické analýzy, statistiky
založené na znásobeném počtu nádrží nebo na
jednotlivých rybách, zpracování dat a zdůvodnění
použitých metod,
— data ve formě tabulky o individuálních a středních
hodnotách hmotností ryb v den 0, 14 (byloli
prováděno vážení) a 28, hodnoty průměrných
rychlostí růstu pro nádrž nebo popřípadě
pseudospecifických rychlostí růstu pro intervaly
0 – 28 dnů nebo popřípadě 0 – 14 a 14 – 28 dnů,
— výsledky statistické analýzy (tj. regresní analýzy
nebo ANOVA) nejlépe ve formě tabulky nebo
v grafické formě a hodnota LOEC (p = 0,05) a NOEC
nebo ECx, popřípadě se směrodatnými odchylkami,
— výskyt jakýchkoli neobvyklých reakcí ryb a viditelné
účinky vyvolané zkoušenou látkou.
XIV.3 LITERATURA
(1) Solbe J. F. de LG (1987). Environmental Effects of
Chemicals (CFM 9350 SLD). Report on a UK Ring Test
of a Method for Studying the Effects of Chemicals
on the Growth Rate of Fish. WRc Report No PRD 1388-
M/2.
(2) Meyer, A., Bierman, C. H., Orti, G. (1993). The
phylogenetic position of the zebrafish (Danio
rerio), a model system in developmental biology: an
invitation to the comparative method. Proc. R. Soc.
Lond. B. 252, 231-236.
(3) Ashley S., Mallett M. J., Grandy N. J. (1990). EEC
Ring Test of a Method for Determining the Effects
of Chemicals on the Growth Rate of Fish. Final
Report to the Commission of the European
Communities. WRc Report No EEC 2600-M.
(4) Crossland N. O. (1985). A method to evaluate
effects of toxic chemicals on fish growth.
Chemosphere, 14, 1855-1870.
(5) Nagel R., Bresh H., Caspers N., Hansen P. D.,
Market M., Munk R., Scholz N., Höfte B. B. (1991).
Effect of 3,4-dichloroaniline on the early life
stages of the Zebrafish (Brachydanio rerio):
results of a comparative laboratory study. Ecotox.
Environ. Safety, 21, 157-164.
(6) Yamamoto, Tokio. (1975). Series of stock cultures
in biological field. Medaka (killifish) biology and
strains. Keigaku Publish. Tokio, Japonsko.
(7) Holcombe, G. W., Benoit D. A., Hammermeister, D.
E., Leonard, E. N., Johnson, R. D. (1995). Acute
and long-term effects of nine chemicals on the
Japanese medaka (Oryzias latipes). Arch. Environ.
Contam. Toxicol. 28, 287-297.
(8) Benoit, D. A., Holcombe, G. W., Spehar, R. L.
(1991). Guidelines for conducting early life
toxicity tests with Japanese medaka (Oryzias
latipes). Ecological Research Series EPA-600/3-91-
063. US Environmental Protection Agency, Duluth,
Minnesota.
(9) Stephan C. E., Rogers J. W. (1985). Advantages of
using regression analysis to calculate results of
chronic toxicity tests. Aquatic Toxicology and
Hazard Assessment: Eighth Symposium, ASTM STP 891,
R. C. Bahner, D. J. Hansen, eds., American Society
for Testing and Materials, Filadelfie, 328-338.
(10) Environment Canada (1992). Biological test method:
toxicity tests using early life stages of salmonid
fish (rainbow trout, coho salmon, or atlantic
salmon). Conservation and Protection, Ontario,
Report EPS 1/RM/28, 81 str.
(11) Cox D. R. (1958). Planning of experiments. Wiley
Edt.
(12) Pack S. (1991). Statistical issues concerning the
design of tests for determining the effects of
chemicals on the growth rate of fish. Room Document
4, OECD Ad Hoc Meeting of Experts on Aquatic
Toxicology, WRc Medmenham, UK, 10.– 12. prosinec
1991.
(13) Dunnett C. W. (1955). A Multiple Comparisons
Procedure for Comparing Several Treatments with a
Control, J. Amer. Statist. Assoc., 50, 1096-1121.
(14) Dunnett C. W. (1964). New tables for multiple
comparisons with a control. J. Amer. Statist.
Assoc, 20, 482-491.
(15) Williams D. A. (1971). A test for differences
between treatment means when several dose levels
are compared with a zero dose control. J. Amer.
Statist. Assoc 27, 103-117.
(16) Johnston, W. L., Atkinson, J. L., Glanville N. T.
(1994). A technique using sequential feedings of
different coloured food to determine food intake by
individual rainbow trout, Oncorhynchus mykiss:
effect of feeding level. Aquaculture,120, 123-133.
(17) Quinton, J. C., Blake, R. W. (1990). The effect of
feed cycling and ration level on the compensatory
growth response in rainbow trout, Oncorhynchus
mykiss. Journal of Fish Biology, 37, 33-41.
(18) Post, G. (1987). Nutrition and Nutritional
Diseases of Fish. Chapter IX in Testbook of Fish
Health. T.F.H. Publications, Inc. Neptune City, New
Jersey, USA. 288 str.
(19) Bruce, R. D., Versteeg D. J. (1992). A statistical
procedure for modelling continuous toxicity data.
Environ. Toxicol. Chem. 11, 1485-1494.
(20) DeGraeve, G. M., Cooney, J. M., Pollock, T. L.,
Reichenbach, J. H., Dean, Marcus, M. D., McIntyre,
D. O. (1989). Precision of EPA seven-day fathead
minnow larval survival and growth test; intra and
interlaboratory study. Report EA-6189 (American
Petroleum Institute Publication, No 4468). Electric
Power Research Institute, Palo Alto, CA.
(21) Norbert-King T. J. (1988). An interpolation estimate for
chronic toxicity: the ICp approach. US Environmental Protection
Agency. Environmental Research Lab., Duluth, Minnesota. Tech.
Rep. No 05-88 of National Effluent Toxicity Assesment Center.
Sept. 1988. 12 str.
(22) Williams D. A. (1972). The comparison of several
dose levels with a zero dose control. J. Amer.
Statist. Assoc., 28, 510-531.
DODATEK 1
DRUHY RYB DOPORUČNÉ KE ZKOUŠENÍ A VHODNÉ ZKUŠEBNÍ PODMÍNKY
------------------------------------------------- --------------------------------------------------------------------------
Druhy Doporučený Fotoperioda Doporučené Doporučená Velikost Hustota Krmivo Délka zkoušky
rozsah (h) rozpětí přesnost měření násady obsádky (d)
zkušební počáteční (g/l) (l-1)
teploty hmotnosti
(st.C) ryb
(g)
------------------------------------------------- --------------------------------------------------------------------------
Doporučené
druhy: 12,5-16,0 12-16 1-5 na 100 mg 1,2-2,0 4 sušené >= 28
Oncorhynchus krmivo pro
mykiss plůdek
pstruh lososovitých
duhový ryb
Jiné dobře
popsané
druhy: 21-25 12-16 0,050- na 1 mg 0,2-1,0 5-10 živé krmivo >= 28
Danio rerio 0,100 (Brachionus
danio 21-25 12-16 na 1 mg 0,2-1,0 5-20 Artemia) >= 28
pruhované 0,050- živé krmivo
Oryzias 0,100 (Brachionus
latipes Artemia)
halančík
japonský
------------------------------------------------- --------------------------------------------------------------------------
DODATEK 2
NĚKTERÉ CHEMICKÉ CHARAKTERISTIKY PŘIJATELNÉ ŘEDICÍ VODY
Látka Koncentrace Nerozpuštěné látky < 20 mg/l Celkový organický uhlík < 2 mg/l Nedisociovaný amoniak < 1µg/l Zbytkový chlor < 10 µg/l Celkové organofosforové pesticidy < 50 ng/l Celkové organochlorové pesticidy a polychlorované bifenyly < 50 ng/l Celkový organický chlor < 25 ng/l
DODATEK 3
LOGARITMICKÁ ŘADA KONCENTRACÍ VHODNÁ PRO ZKOUŠKU TOXICITY (9)
Sloupec (počet koncentrací mezi 100 a 10, nebo mezi 10 a 1) (1)
-------------------------------------------------------
1 2 3 4 5 6 7
100 100 100 100 100 100 100
32 46 56 63 68 72 75
10 22 32 40 46 52 56
3,2 10 18 25 32 37 42
1,0 4,6 10 16 22 27 32
2,2 5,6 10 15 19 24
1,0 3,2 6,3 10 14 18
1,8 4,0 6,8 10 13
1,0 2,5 4,6 7,2 10
1,6 3,2 5,2 7,5
1,0 2,2 3,7 5,6
1,5 2,7 4,2
1,0 1,9 3,2
1,4 2,4
1,0 1,8
1,3
1,0
-------------------------------------------------------
1 Ze sloupců může být zvolena řada pěti (nebo více) po
sobě jdoucích koncentrací. Mezilehlé body pro
koncentrace ve sloupci (x) jsou uvedeny ve sloupci
(2x + 1). Uvedené hodnoty mohou být koncentracemi
vyjádřenými v objemových nebo hmotnostních procentech
(mg/l nebo µg/l). Hodnoty mohou být podle potřeby
násobeny nebo děleny jakoukoli mocninou 10. Řada ve
sloupci 1 by mohla být použita při značné nejistotě,
pokud jde stupeň toxicity.
XV. METODA PRO STANOVENÍ TOXICITY NA RYBÍCH EMBRYÍCH A
POTĚRU - KRÁTKODOBÁ ZKOUŠKA – metoda C.15 podle přílohy
směrnice 2001/59/ES
XV.1 METODA
Tato zkouška krátkodobé toxicity je replikou
metody OECD TG 212 (1998).
XV.1.1 ÚVOD
Tato zkouška krátkodobé toxicity na rybím embryu
a váčkovém plůdku je krátkodobou zkouškou, při
níž jsou exponována životní stádia od čerstvě
oplodněných jiker do stadia váčkových plůdků. Při
zkoušce na embryu a na váčkovém plůdku se nekrmí,
zkouška by tedy měla být ukončena dokud je
váčkový plůdek stále vyživován ze žloutkového
váčku.
Zkouška je určena k zjištění letálních a
v omezené míře subletálních účinků chemických
látek na specifická stadia a testovací druhy.
Tato zkouška by měla poskytnout užitečné
informace, neboť by a) mohla být přechodem mezi
letálními a subletálními zkouškami, b) mohla být
použita jako screeningová zkouška pro úplnou
zkoušku toxicity na časných vývojových stadiích
nebo pro zkoušky chronické toxicity a c) mohla by
být použita pro zkoušení na druzích, u nichž
nejsou dostatečně rozvinuty chovné techniky, aby
pokryly období od endogenního k exogennímu
vyživování.
Je třeba mít na paměti, že pouze zkoušky
pokrývající celý životní cyklus ryb obecně
umožňují odhadnout chronickou toxicitu chemické
látky pro ryby a že jakékoli omezení expozice
nějakého životního stadia může snížit citlivost a
tím podhodnotit chronickou toxicitu. Očekává se
tedy, že zkouška na embryu a váčkovém plůdku je
méně citlivá než úplná zkouška na časných
vývojových stádiích, zejména pokud jde o vysoce
lipofilní chemické látky (log P
o/v
> 4) a
chemické látky se specifickým mechanismem účinku.
V citlivostech těchto dvou zkoušek se však
očekávají menší rozdíly v případě chemických
látek s nespecifickým, narkotickým mechanismem
účinku (1). Před publikováním této zkoušky bylo nejvíce
zkušeností s touto zkouškou na embryu a váčkovém
plůdku získáno u sladkovodní ryby Danio rerio
Hamilton-Buchanan (Teleostei, Cyprinidae – obecný
název danio pruhované). Podrobnější pokyny pro
zkoušku s tímto druhem jsou tedy uvedeny
v dodatku 1. To nevylučuje použití jiného druhu,
pro který jsou zkušenosti rovněž k dispozici
(tabulky IA a IB).
XV.1.2 DEFINICE
Nejnižší koncentrace s pozorovanými účinky
(Lowest observed effect concentration, LOEC): je
nejnižší zkoušená koncentrace zkoušené látky, při
níž jsou pozorovány významné účinky ve srovnání
s kontrolou (na úrovni pravděpodobnosti falešně
pozitivního hodnocení p < 0,05). Všechny
zkoušené koncentrace vyšší než LOEC musí mít
stejné nebo vážnější škodlivé účinky, než účinky
pozorované při koncentraci LOEC.
NOEC (no observed effect concentration,
koncentrace bez pozorovaných účinků): je zkušební
koncentrace bezprostředně nižší než LOEC.
XV.1.3 PODSTATA ZKUŠEBNÍ METODY
Embrya a váčkové plůdky se vystaví rozsahu
koncentrací zkoušené látky rozpuštěné ve vodě.
Zkouška umožňuje volit mezi semistatickým a
průtokovým uspořádáním. Volba závisí na povaze
zkoušené látky. Zkouška se zahájí umístěním
oplodněných jiker do zkušebních nádrží a ukončí
se těsně před tím, než dojde k úplné absorpci
žloutkového váčku čerstvých plůdků v některé ze
zkušebních nádrží, nebo než začne v kontrolních
skupinách docházet k úhynu v důsledku hladovění.
Posoudí se letální a subletální účinky a
porovnají se s kontrolními hodnotami s cílem
stanovit nejnižší koncentraci s pozorovanými
účinky, tedy koncentraci bez pozorovaných účinků.
Účinky mohou být eventuálně analyzovány za
použití regresního modelu s cílem odhadnout
koncentraci, která způsobuje určitý procentuálně
vyjádřený účinek (tj. LC/ECx, kde x je definovaný
procentuální účinek).
XV.1.4 INFORMACE O ZKOUŠENÉ LÁTCE
Měly by být dostupné výsledky zkoušky akutní
toxicity (viz metoda C.1) provedené nejlépe na
druhu zvolenému pro tuto zkoušku. Výsledky mohou
být užitečné při výběru vhodného rozsahu
zkušebních koncentrací ve zkoušce na časných
vývojových stádiích. Měly by být známy
rozpustnost látky ve vodě (včetně rozpustnosti ve
zkušební vodě) a tlak par látky. Měla by být
k dispozici vhodná analytická metoda pro
kvantitativní stanovení látky ve zkušebních
roztocích, a to se známou a doloženou správností
a známou mezí stanovitelnosti.
Užitečnými informacemi o zkoušené látce pro účely
stanovení zkušebních podmínek jsou strukturní
vzorec, čistota látky, stálost na světle, pKa,
P
o/v
a výsledky zkoušky snadné biologické
rozložitelnosti (viz metoda C.4).XV.1.5 VALIDITA ZKOUŠKY
Má-li být zkouška platná, musí být splněny
následující podmínky:
— celková míra přežití oplodněných jiker
v kontrolních skupinách a podle potřeby
v nádržích, do nichž bylo přidáno pouze
rozpouštědlo, musí být vyšší nebo rovna
limitům stanoveným v dodatcích 2 a 3,
— koncentrace rozpuštěného kyslíku musí ležet
mezi 60 a 100 % nasycení vzduchem (ASV) po
celou dobu zkoušky,
— teplota vody se po celou dobu zkoušky nesmí
mezi zkušebními nádržemi nebo den ode dne
lišit o více než +/- 1,5 st.C a měla by být
udržována v rozpětí teplot stanoveném pro
zkušební druh (dodatky 2 a 3).
XV.1.6 POPIS ZKUŠEBNÍ METODY
XV.1.6.1 Zkušební nádrže
Mohou být použity jakékoli nádrže ze skla nebo
z jiného inertního materiálu. Rozměry zkušebních
nádrží by měly být dostatečné k tomu, aby
vyhovovaly velikosti násady (viz bod 1.7.1.2).
Doporučuje se, aby byly nádrže umístěny ve
zkušebním prostoru náhodně. Uspořádání do
náhodných bloků s možností expozice v každém
bloku se upřednostňuje před zcela náhodným
uspořádáním, když existují systémové účinky
v laboratoři, které mohou být blokovým
uspořádáním kontrolovány. Jeli použito blokové
uspořádání, mělo by být zohledněno při následné
analýze dat. Nádrže by měly být chráněny před
nežádoucími rušivými vlivy.
XV.1.6.2 Výběr druhů ryb
Doporučené druhy ryb jsou uvedeny v tabulce 1A.
To nevylučuje použití jiného druhu (příklady jsou
uvedeny v tabulce 1B), zkušební postup musí být
ale upraven, aby byly vytvořeny vhodné zkušební
podmínky.V takovém případě by měly být uvedeny
důvody pro výběr druhu a experimentální podmínky.
XV.1.6.3 Chov matečných ryb
Podrobnosti o chovu matečných ryb v uspokojivých
podmínkách jsou uvedeny v metodě OECD TG 210 (1)
a v literatuře (2, 3, 4, 5, 6).
XV.1.6.4 Chov embryí a plůdků
Embrya a čerstvě vykulené plůdky mohou být
exponovány v hlavní nádrži v menších nádobách
s pletivovými stěnami nebo uzávěry, aby jimi mohl
proudit zkušební roztok. Nevířivého průtoku
nádobami lze dosáhnout jejich zavěšení do ramen,
pomocí nichž lze pohybovat nádobami nahoru a
dolů, přičemž organismy zůstanou stále ponořeny;
lze rovněž použít syfonový systém přítoku a
výpusti. Oplodněné jikry lososovitých ryb mohou
ležet na podložce nebo pletivu s dostatečně
velkými oky, aby jimi mohly plůdky po vylíhnutí
propadnout. K přemístění embryí a plůdků
v semistatické zkoušce s každodenní úplnou
výměnou média je vhodné použít Pasteurovy pipety.
(viz bod 1.6.6).
Jsouli k udržení jiker v hlavní nádrži použity
nádoby, mřížky nebo pletiva, měly by být po
vylíhnutí plůdků odstraněny (1), pokud ovšem
nemají být ponechány k zamezení úniku ryb. Jeli
třeba plůdky přemístit, neměly by být vystaveny
vzduchu a neměly by se k jejich vytažení z nádob
používat síťky (taková opatrnost není nutná u
méně křehkých druhů, např. u kapra). Okamžik
přemístění se liší podle druhu a nemusí být vždy
nutný. U semistatických technik mohou být použity
kádinky nebo mělké nádobky a podle potřeby mohou
být opatřeny sítem umístěným nepatrně nad dnem
kádinky. Jeli objem těchto nádob dostatečný, aby
vyhovoval požadavkům na nasazování (viz
bod 1.7.1.2) nemusí být přemístění embryí nebo
plůdků nutné.
_________________________________________________________
(1) OECD, Paris 1992, Test Guideline 210, Fish, Early-life
Toxicity TestXV.1.6.5 Voda
Pro tuto zkoušku je vhodná jakákoliv voda, která
vyhovuje chemickým charakteristikám přijatelné
ředicím vody, jak jsou uvedeny v dodatku 4 a
v níž testovací druhy kontrolních skupin
přežívají alespoň tak, jak je uvedeno v dodatcích
2 a 3. Měla by mít po celou dobu zkoušky stejnou
kvalitu. pH by se nemělo měnit o více než +/-
0,5. Pro ujištění, že ředící voda nebude mít
přílišný vliv na výsledky zkoušky (například
tvorbou komplexů se zkoušenou látkou) nebo
nepříznivý vliv na stav matečných ryb, by měly
být odebírány v pravidelných intervalech její
vzorky pro analýzu. Jeli kvalita ředicí vody
relativně konstantní, mělo by být stanovení
těžkých kovů (např. Cu, Pb, Zn, Hg, Cd a Ni),
hlavních aniontů a kationtů (např. Ca, Mg, Na, K,
Cl a SO4), pesticidů (např. celkový obsah
organických fosforových a chlorových pesticidů),
celkový obsah organického uhlíku a suspendovaných
látek provedeno např. každé tři měsíce. Jeli
prokázáno, že kvalita vody je konstantní po dobu
alespoň jednoho roku, mohou být stanovení méně
častá a intervaly lze prodloužit (např. každých
šest měsíců).
XV.1.6.6 Zkušební roztoky
Zkušební roztoky o zvolených koncentracích se
připraví ředěním zásobního roztoku.
Zásobní roztok by měl být nejlépe připraven
jednoduchým mechanickým mícháním nebo
protřepáváním zkoušené látky v ředicí vodě (např.
mechanickým mícháním a sonifikací). Pro dosažení
vhodné koncentrace zásobního roztoku mohou být
použity saturační kolony. Neměla by být používána
rozpouštědla nebo dispergátory (solubilizační
činidla), v některých případech však může být
použití takových látek pro vytvoření zásobního
roztoku o vhodné koncentraci nezbytné. Ke vhodným
rozpouštědlům patří aceton, ethanol, methanol,
dimethylformamid a triethylenglykol. Ke vhodným
dispergátorům patří Cremophor RH40, Tween 80,
0,01% methylcelulosa a HCO-40. Snadno biologicky
rozložitelná činidla (např. aceton) nebo vysoce
těkavé sloučeniny je třeba používat rozvážně,
neboť mohou způsobit problémy s růstem bakterií
v průtokových zkouškách. Jeli použito
solubilizační činidlo, nesmí mít významné účinky
na přežití ani viditelné nepříznivé účinky na
časná vývojová stádia, což musí být prokázáno na
kontrolní skupině vystavené pouze rozpouštědlu.
Měla by však být vynaložena maximální snaha
takové látky nepoužívat.
U semistatických technik mohou být použity dva
různé postupy obměny; buď i) se do čistých nádob
připraví nové zkušební roztoky a přežívající
jikry a plůdky se s malým objemem starého roztoku
opatrně přemístí do nových nádob, aniž by se
vystavily vzduchu, nebo ii) se testovací
organismy ponechají v nádobě a vymění se určitý
podíl (alespoň tři čtvrtiny) zkušební vody.
Častost obnovování média bude záviset na stálosti
zkoušené látky, avšak doporučuje se obnovovat
médium denně. Neníli podle předběžných zkoušek
stálosti (viz bod 1.4) koncentrace zkoušené látky
mezi obnoveními média stálá, (tj. nepohybuje se
v intervalu 80 – 120 % nominální koncentrace nebo
klesá pod 80 % naměřené počáteční koncentrace),
měla by být zvážena průtoková zkouška. V každém
případě je třeba dbát na to, aby plůdky nebyly
při obnovování vody vystaveny stresu.
Při průtokových zkouškách je pro zajištění řady
koncentrací nezbytný systém, který nepřetržitě
dávkuje a ředí zásobní roztok zkoušené látky
(např. dávkovací čerpadlo, zařízení pro
proporcionální ředění, saturační systém). Průtok
zásobních roztoků a ředicí vody by měl být
kontrolován v určitých intervalech, nejlépe
denně, a neměl by se v průběhu zkoušky měnit o
více než 10 %. Jako vhodný by shledán průtok
zajišťující výměnu alespoň pěti objemů nádrže za
24 h (2).
XV.1.7 POSTUP
Užitečné informace o provádění zkoušek toxicity
na rybím embryu a váčkovém plůdku jsou dostupné
v literatuře, přičemž některé literární zdroje
(7, 8, 9) jsou uvedeny v tomto textu v oddílu
s literaturou.
XV.1.7.1 Podmínky expozice
XV.1.7.1.1 Délka expozice
Zkouška se zahájí nejlépe do 30 minut po
oplodnění jiker. Embrya se ponoří do zkušebního
roztoku před započetím rýhování blastuly, nebo co
nejdříve po něm, a v každém případě před počátkem
stádia gastruly. U jiker získaných od komerčního
dodavatele nemusí být možné zahájit zkoušku ihned
po oplodnění. Vhledem k tomu, že citlivost
zkoušky může být závažně ovlivněna zpoždění
začátku zkoušky, měla by být zkouška zahájena do
osmi hodin po oplodnění. Vzhledem k tomu, že se
plůdky v průběhu expozice nekrmí, ukončí se
zkouška těsně před tím, než dojde k úplné
absorpci žloutkového váčku u plůdků v některé ze
zkušebních nádrží, nebo než začne v kontrolních
skupinách docházet k úhynu v důsledku hladovění.
Délka zkoušky bude záviset na použitém druhu.
Některé doporučené délky zkoušky jsou uvedeny
v dodatcích 2 a 3.
XV.1.7.1.2 Nasazování
Počet oplodněných jiker na začátku zkoušky by měl
být dostatečný ke splnění statistických
požadavků. Měly by být k expozici náhodně
rozděleny a na jednu koncentraci by mělo být
rozděleno alespoň 30 jiker rovným dílem (nebo
alespoň jak je to jen možné s ohledem na to, že u
některých druhů může být obtížné získat stejně
velké podíly) mezi alespoň tři další zkušební
nádrže. Velikost násady (biomasa v jednotce
objemu) by měla být tak nízká, aby bylo možné
udržet koncentraci rozpuštěného kyslíku na
alespoň 60 % ASV bez provzdušňování. U
průtokových zkoušek se doporučuje nasazování
nepřekračující 0,5 g/l za 24 h a v žádném
okamžiku nepřekračující 5 g/l roztoku (2).
XV.1.7.1.3 Světlo a teplota
Fotoperioda a teplota zkušební vody by měly
vyhovovat zkušebním druhům (dodatky 2 a 3). Pro
sledování teploty může sloužit další zkušební
nádrž.
XV.1.7.2 Zkušební koncentrace
Obvykle je nezbytných pět koncentrací zkoušené
látky lišících se od sebe faktorem
nepřekračujícím 3,2. Při výběru rozsahu
zkušebních koncentrací by měla být zohledněna
křivka závislosti hodnoty LC
50
na délce expozice
ve studii akutní toxicity. Za určitých okolností
může být oprávněné použít méně než pět
koncentrací, např. v limitní zkoušce, a užší
rozsah koncentrací. Použití méně než pěti
koncentrací by mělo být zdůvodněno. Koncentrace
látky, které jsou vyšší než 96hodinová LC50
nebo
vyšší než 100 mg/l, podle toho, co je nižší,
nemusí být zkoušeny. Látky by neměly být zkoušeny
pro koncentrace vyšší, než je jejich rozpustnost
ve zkušební vodě.
Použijeli se k usnadnění přípravy zásobního
roztoku solubilizační činidlo (viz bod 1.6.6),
neměla by být jeho konečná koncentrace ve
zkušební nádrži vyšší než 0,1 ml/l a měla by být
ve všech zkušebních nádržích stejná.
XV.1.7.3 Kontrolní skupiny
Jako další zkušební sady by měly být nasazeny
kontrolní skupina v ředicí vodě (příslušným
způsoben znásobená) a podle potřeby také jedna
kontrolní skupina se solubilizačním činidlem
(příslušným způsoben znásobená).
XV.1.7.4 Častost analytických stanovení a měření
Během zkoušky se koncentrace zkoušené látky
stanovují v pravidelných intervalech.
U semistatických zkoušek, pokud se předpokládá,
že se bude zkušební koncentrace pohybovat
v rozmezí +/- 20 % nominálních hodnot (tj. od 80
do 120 %, viz bod 1.4 a 1.6.6), se doporučuje
analyzovat nejvyšší a nejnižší zkušební
koncentrace na začátku studie ihned po jejich
přípravě a bezprostředně před obnovením alespoň
v nejméně třech nádržích (tj. analýzy se
provedou na vzorku téhož roztoku – ihned po jeho
přípravě a při jeho výměně).
U zkoušek, u nichž se (na základě dat o stálosti
látky) předpokládá, že se bude koncentrace
zkoušené látky pohybovat v rozmezí větším než +/-
20 % nominální hodnoty, je nezbytné analyzovat
všechny zkoušené koncentrace ihned po jejich
přípravě a před jejich výměnou, a to stejně často
(tj. alespoň ve třech okamžicích rovnoměrně
rozložených přes celkovou dobu zkoušky).
Stanovení koncentrací zkoušené látky před
obnovením je třeba provést pro každou koncentraci
pouze u jedné paralelní nádrže. Stanovení se
provádějí v odstupu ne více než 7 dnů. Doporučuje
se zakládat výsledky na naměřených koncentracích.
Lze-li však prokázat, že po celou dobu zkoušky
byla koncentrace uspokojivě udržována v rozmezí
+/- 20 % nominální hodnoty, mohou být výsledky
založeny na nominálních nebo naměřených
počátečních hodnotách.
Pro průtokové zkoušky je vhodný podobný
vzorkovací režim, jako je popsán u semistatických
zkoušek (v tomto případě se však neprovádí měření
Dstarých“ roztoků). Jeli zkouška delší než sedm
dnů, doporučuje se zvýšit počet odběrů v prvním
týdnu (např. tři sady měření) pro ujištění, že
jsou zkušební koncentrace stálé.
Může být nezbytné vzorky odstředit nebo filtrovat
(např. přes filtr s velikostí pórů 0,45 µm).
Vzhledem k tomu, že však odstředění ani filtrace
vždy neoddělí od sebe biologicky dostupný a
biologicky nedostupný podíl zkušební látky,
nemusí být vzorky takto zpracovány.
V průběhu zkoušky se měří v každé zkušební nádrži
množství rozpuštěného kyslíku, pH a teplota.
Celková tvrdost a solnost se měří v kontrolních
nádržích a v jedné nádrži s nejvyšší koncentrací.
Množství rozpuštěného kyslíku a solnost (podle
potřeby) se měří alespoň třikrát (na začátku,
uprostřed a na konci zkoušky). U semistatických
zkoušek se doporučuje měřit množství rozpuštěného
kyslíku častěji, nejlépe před každým obnovením
média a po něm, nebo alespoň jednou týdně. pH se
měří na začátku a na konci každé výměny vody u
semistatických zkoušek a alespoň týdně u
průtokových zkoušek. Tvrdost vody se měří v každé
zkoušce jednou. Teplota se měří denně, nejlépe
nepřetržitě alespoň v jedné zkušební nádrži.
XV.1.7.5 Pozorování
XV.1.7.5.1 Stádia vývoje embrya
Embryonální stádium (tj. stadium gastruly) na
začátku expozice zkoušené látce by mělo být
identifikováno co nejpřesněji. Lze to provést za
použití reprezentativního vzorku vhodně
uchovávaných a očištěných jiker. Popis a
vyobrazení embryonálních stádií lze také nalézt
v literatuře (2, 5, 10, 11).
XV.1.7.5.2 Líhnutí a přežívání
Líhnutí a přežívání se pozoruje alespoň jednou
denně a zaznamenávají se počty. Může být žádoucí
provádět na začátku zkoušky častější pozorování
(např. každých 30 min během prvních tří hodin),
neboť v některých případech mohou být důležitější
doby přežití než pouhé počty úhynů (např.
docházíli k akutním toxickým účinkům). Uhynulá
embrya a plůdky se odstraní ihned po nalezení,
neboť se rychle rozkládají. Při odstraňování
uhynulých jedinců se postupuje s mimořádnou
opatrností, aby se nezasáhlo do sousedních
jiker/plůdků nebo aby se tyto fyzicky
nepoškodily, neboť jsou mimořádně subtilní a
citlivé. Kritéria uhynutí se u životních stádií
liší:
— u jiker: zejména v časných stádiích zřetelná
ztráta průsvitnosti a změna ve zbarvení
vyvolané koagulací a/nebo sražením bílkovin
vedoucími k bílému zakalení,
— u embryí: absence pohybu nebo tepu srdce nebo
neprůsvitné zbarvení u druhů, jejichž embrya
jsou za normálních okolností průsvitná,
— u plůdků: nepohyblivost nebo absence dýchacích
pohybů nebo tepu srdce nebo bílé neprůsvitné
zbarvení centrálního nervového systému a
nedostatečná reakce na mechanické podněty.
XV.1.7.5.3 Neobvyklý vzhled
Počet plůdků vykazujících neobvyklý tělesný
vzhled nebo pigmentaci a stav absorpce
žloutkového váčku se zaznamenávají v přiměřených
intervalech závisejících na délce zkoušky a na
povaze popisované odchylky. Je třeba si uvědomit,
že neobvyklá embrya a plůdky se přirozeně
vyskytují a u některých druhů jich může být
v kontrolních skupinách řádově několik procent.
Neobvyklí jedinci by měli být ze zkušební nádrže
odstranění pouze v případě uhynutí.
XV.1.7.5.4 Neobvyklé chování
Odchylky, např. hyperventilace, nekoordinované
plavání a netypická nečinnost se zaznamenávají
v přiměřených intervalech závisejících na délce
zkoušky. Tyto účinky, přestože je obtížné je
kvantifikovat, mohou – jsouli pozorovány –
napomoci interpretovat data o mortalitě,
tj. mohou poskytnout informace o mechanismu
toxického působení látky.
XV.1.7.5.5 Tělesná délka
Na konci zkoušky se doporučuje změřit
individuální délku: může být změřena standardní
délka, délka těla (the fork lenght) nebo celková
délka. Došloli však k uhnití ocasní ploutve
nebo k erozi ploutví, použije se standardní
délka. Obecně by měl být v dobře provedených
zkouškách variační koeficient pro délku mezi
jednotlivými kontrolními skupinami 20 %.
XV.1.7.5.6 Hmotnost
Na konci se zkoušky lze stanovit jednotlivé
hmotnosti; hmotnost za sucha (24 h při 60 st.C) se
upřednostňuje před živou váhou (po osušení do
sucha). Obecně by měl být v dobře provedených
zkouškách variační koeficient pro hmotnost mezi
jednotlivými kontrolními skupinami 20 %.
Tato pozorování povedou k některým nebo ke všem
následujícím údajům, které budou k dispozici pro
statistickou analýzu:
— kumulativní mortalita,
— počet zdravých plůdků na konci zkoušky,
— čas začátku líhnutí a konce líhnutí (tj. 90%
vylíhnutí v každé paralelní skupině),
— počet plůdků vylíhnutých každý den,
— délka (a hmotnost) ryb, které přežily do konce
zkoušky,
— počet plůdků, které jsou deformované nebo mají
neobvyklý vzhled,
— počet plůdků vykazujících neobvyklé chování.
XV.2 DATA A ZPRÁVY
XV.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Doporučuje se, aby se návrhu zkoušky i analýzy
výsledků zkoušky účastnil statistik, neboť tato
zkušební metoda umožňuje značné variace
v experimentálním uspořádání, například v počtu
zkušebních nádrží, v počtu zkušebních
koncentrací, ve výchozím počtu oplodněných jiker
v měřených parametrech. Pokud jde o možnosti
uspořádání zkoušky, nejsou zde uvedeny žádné
pokyny.
Majíli být odhadnuty hodnoty LOEC/NOEC, bude
nezbytné analyzovat odchylky pro každou sadu
paralelních skupin pomocí analýzy variance
(ANOVA) nebo pomocí kontingenční tabulky.
K vícenásobnému porovnání výsledků pro jednotlivé
koncentrace a pro kontrolní skupiny může být
užitečný Dunnettův test (12, 13). K dispozici
jsou další užitečné příklady (14, 15). Vypočte se
a uvede stupeň účinku, který lze prokázat pomocí
ANOVA nebo jiných metod (tj. vypovídací schopnost
zkoušky). Je třeba si uvědomit, že ne všechna
pozorování uvedená v bodě 1.7.5.6 jsou vhodná pro
statistickou analýzu pomocí ANOVA. Například
kumulativní mortalita a počet zdravých plůdků na
konci zkoušky by mohly být analyzovány
probitovými metodami.
Majíli být odhadnuty LC nebo ECx, proloží se
daty vhodná křivka (vhodné křivky), jako např.
logaritmická křivka, a to statistickou metodou,
např. metodou nejmenších čtverců nebo nelineární
metodou nejmenších čtverců. Křivka nebo křivky by
měly být tak parametrizovány, aby bylo možné
přímo odhadnout požadované hodnoty LC nebo ECx a
jejich směrodatné odchylky. To značně usnadňuje
výpočet intervalů spolehlivosti pro hodnoty LC
nebo ECx. Pokud nejsou dobré důvody pro
upřednostnění jiných intervalů spolehlivosti,
uvede se oboustranný 95% interval spolehlivosti.
Metoda proložení by měla pokud možno umožnit
posouzení závažnosti nedostatků proložení.
Proložení lze provést graficky. Regresní analýza
je vhodná pro všechna pozorování uvedená
v bodě 1.7.5.6.
XV.2.2 INTERPRETACE VÝSLEDKŮ
Výsledky by měly být interpretovány opatrně
v případě, že se naměřené koncentrace toxické
látky ve zkušebních roztocích pohybují na
úrovních blízkých mezi stanovitelnosti analytické
metody. Interpretace výsledků pro koncentrace
vyšší než je rozpustnost látky ve vodě by měla
být rovněž opatrná.
XV.2.3 PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat následující
informace:
XV.2.3.1 Zkoušená látka
— fyzikální stav a relevantní fyzikálněchemické
vlastnosti,
— údaje o chemické identitě včetně údajů o
čistotě a podle potřeby o metodě
kvantitativního stanovení zkoušené látky.
XV.2.3.2 Testovací druh
— vědecký název, kmen, počet matečných ryb
(tj. kolik samiček bylo ve zkoušce použito
pro opatření požadovaného počtu jiker), zdroj
a metoda sběru oplodněných jiker a následné
zpracování.
XV.2.3.3 Zkušební podmínky
— použitá zkušební metoda (např. semistatická
nebo průtoková metoda, doba od oplodnění do
začátku zkoušky, nasazování atd.),
— fotoperioda (fotoperiody),
— uspořádání zkoušky (např. počet zkušebních
nádrží a jejich znásobení, počet embryí
v nádrži),
— metoda přípravy zásobních roztoků a častost
obnovení (jeli použito, uvede se
solubilizační činidlo a jeho koncentrace),
— nominální zkušební koncentrace, naměřené
hodnoty ve zkušebních nádržích, jejich
střední hodnoty a směrodatné odchylky a
metody jejich stanovení a jeli zkoušená
látka rozpustná ve vodě v koncentracích
nižších, než jsou vyšetřované koncentrace,
uvede se důkaz toho, že naměřené koncentrace
odpovídají koncentraci zkoušené látky
v roztoku,
— charakteristiky ředicí vody: hodnota pH,
tvrdost, teplota, koncentrace rozpuštěného
kyslíku, koncentrace zbytkového chloru (jeli
měřena), obsah celkového organického uhlíku,
obsah suspendovaných látek, popřípadě
salinita zkušebního média a výsledky
jakýchkoli jiných provedených měření,
— kvalita vody ve zkušebních nádržích: pH,
tvrdost, teplota a koncentrace rozpuštěného
kyslíku.
XV.2.3.4 Výsledky
— výsledky případných předběžných studií stálosti
zkoušené látky,
— doklady o tom, že kontrolní skupiny splnily
obecné požadavky na přijatelnost přežití pro
testovací druh (dodatky 2 a 3),
— údaje o mortalitě nebo přežití v embryonálním
stádiu a ve stádiu plůdku a údaje o celkové
mortalitě nebo přežití,
— doba do vylíhnutí, počet vylíhnutých jedinců,
— údaje o délce (a hmotnosti),
— výskyt a popis morfologických odchylek, pokud
se vyskytly,
— výskyt a popis účinků na chování, pokud se
vyskytly,
— statistická analýza a zpracování dat,
— u zkoušek analyzovaných pomocí ANOVA nejnižší
koncentrace s pozorovanými účinky (LOEC) na
úrovni pravděpodobnosti falešně pozitivního
hodnocení p = 0,05 a koncentrace bez
pozorovaných účinků (NOEC) pro každou
posuzovanou reakci, včetně popisu použité
statistické metody a údaje o tom, jak velký
účinek bylo možné odhalit,
— u zkoušek analyzovaných pomocí regresních
metod, hodnoty LC a ECx a intervaly
spolehlivosti a graf proloženého modelu
použitého pro jejich výpočet,
— vysvětlení jakékoli odchylky od této zkušební
metody.
XV.3 LITERATURA
(1) Kristensen P. (1990). Evaluation of the
Sensitivity of Short Term Fish Early Life
Stage Tests in Relation to other FELS Test
Methods. Final report to the Commission of
the European Communities, 60 str., červen
1990.
(2) ASTM (1988). Standard Guide for Conducting
Early Life-Stage Toxicity Tests with Fishes.
American Society for Testing and Materials. E
1241-88. 26 str.
(3) Brauhn J. L., Schoettger R. A. (1975).
Acquisition and Culture of Research Fish:
Rainbow trout, Fathead minnows, Channel
Catfish and Bluegills. str. 54, Ecological
Research Series, EPA-660/3-75-011, Duluth,
Minnesota.
(4) Brungs W. A., Jones B. R. (1977). Temperature
Criteria for Freshwater Fish: Protocol and
Procedures. str. 128, Ecological Research
Series EPA-600/3-77-061, Duluth, Minnesota.
(5) Laale H. W. (1977). The Biology and Use of
the Zebrafish (Brachydanio rerio) in
Fisheries Research. A Literature Review. J.
Biol. 10, 121-173.
(6) Legault R. (1958). A Technique for
Controlling the Time of Daily Spawning and
Collecting Eggs of the Zebrafish, Brachydanio
rerio (Hamilton-Buchanan) Copeia, 4, 328-330.
(7) Dave G., Damgaard B., Grande M., Martelin J.
E., Rosander B., Viktor T. (1987). Ring Test
of an Embryo-larval Toxicity Test with
Zebrafish (Brachydanio rerio) Using Chromium
and Zinc as Toxicants. Environ. Toxicol.
Chem., 6, 61-71.
(8) Birge J. W., Black J. A., Westerman A. G.
(1985). Short-term Fish and Amphibian Embryo-
larval Tests for Determining the Effects of
Toxicant Stress on Early Life Stages and
Estimating Chronic Values for Single
Compounds and Complex Effluents. Environ.
Toxicol. Chem., 4, 807-821.
(9) Van Leeuwen C. J., Espeldoorn A., Mol F.
(1986). Aquatic Toxicological Aspects of
Dithiocarbamates and Related Compounds. III.
Embryolarval Studies with Rainbow Trout
(Salmo gairdneri). J. Aquatic Toxicology, 9,
129-145.
(10) Kirchen R. V., W. R. West (1969). Teleostean
Development. Carolina Tips 32(4): 1-4.
Carolina Biological Supply Company.
(11) Kirchen R. V., W. R. West (1976). The
Japanese Medaka. Its care and Development.
Carolina Biological Supply Company, North
Carolina. 36 str.
(12) Dunnett C. W. (1955). A Multiple Comparisons
Procedure for Comparing Several Treatments
with Control. J. Amer. Statist. Assoc., 50,
1096-1121.
(13) Dunnett C. W. (1964). New Tables for
Multiple Comparisons with a Control. J. Amer.
Statist. Assoc, 20, 482-491.
(14) Mc Clave J. T., Sullivan J. H., Pearson J.G.
(1980). Statistical Analysis of Fish Chronic
Toxicity Test Data. Proceedings of 4th
Aquatic Toxicology Symposium, ASTM,
Filadelfie.
(15) Van Leeuwen C. J., Adema D. M. M., Hermes J.
(1990). Quantitative Structure-Activity
Relationships for Fish Early Life Stage
Toxicity. Aquatic Toxicology, 16, 321-334.
(16) Environment Canada. (1992). Toxicity Tests
Using Early Life Stages of Salmonid Fish
(Rainbow Trout, Coho Salmon or Atlantic
Salmon). Biological Test Method Series.
Report EPS 1/RM/28, prosinec 1992, 81 str.
(17) Dave G., Xiu R. (1991). Toxicity of Mercury,
Nickel, Lead and Cobalt to Embryos and Larvae
of Zebrafish, Brachydanio rerio. Arch.
Environ. Contam. Toxicol., 21, 126-134.
(18) Meyer A., Bierman C. H., Orti G. (1993). The
phylogenetic position of the Zebrafish (Danio
rerio), a model system in developmental
biology – an invitation to the comperative
methods. Proc. Royal Society of London,
Series B, 252: 231-236.
(19) Ghillebaert F., Chaillou C., Deschamps F.,
Roubaud P. (1995). Toxic Effects, at Three pH
Levels, of Two Reference Molecules on Common
Carp Embryo. Ecotoxicol. Environ. Safety, 32,
19-28.
(20) US EPA, (1991). Guidelines for Culturing the
Japanese Medaka, Oryzias latipes. EPA report
EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
(21) US EPA, (1991). Guidelines for Conducting
Early Life Stage Toxicity Tests with Japanese
Medaka, (Oryzias latipes). EPA report
EPA/600/3-91/063, prosinec. 1991, EPA,
Duluth.
(22) De Graeve G. M., Cooney J. D., McIntyre D.
O., Poccocic T. L., Reichenbach N. G., Dean
J. H., Marcus M. D. (1991). Validity in the
performance of the seven-day Fathead minnow
(Pimephales promelas) larval survival and
growth test: an intra- and interlaboratory
study. Environ. Toxicol. Chem. 10, 1189-1203.
(23) Calow P. (1993). Handbook of Ecotoxicology,
Blackwells, Oxford. Vol. 1, Chapter 10:
Methods for spawning, culturing and
conducting toxicity tests with Early Life
stages of Estuarine and Marine fish.
(24) Balon E. K. (1985). Early life history of
fishes: New developmental, ecological and
evolutionary perspectives, Junk Publ.,
Dordrecht, 280 str.
(25) Blaxter J. H. S. (1988). Pattern and variety
in development, v: W. S. Hoar, D. J. Randall
eds., Fish Physiology, Vol. XIA, Academic
press, 1-58.
TABULKA 1A: Druhy ryb doporučené pro zkoušku
Sladkovodní Oncorhynchus mykiss pstruh duhový (9, 16) Danio rerio danio pruhované (7, 17, 18) Cyprinus caprio kapr obecný (8, 19) Oryzias latipes halančík japonský (20, 21) Pimephales promelas střevle (8, 22)
TABULKA 1B: Příklady dalších dobře popsaných druhů, které
byly také použity
Sladkovodní Mořské
Carassius auratus Menidia peninsulae
karas zlatý (8) (23, 24, 25)
Lepomis macrochirus Clupea harengus
slunečnice modrá (8) sleď (24, 25)
Gadus morhua
treska (24, 25)
Cyprinodon variegatus
(23, 24, 25)
DODATEK 1
NÁVOD K PROVEDENÍ ZKOUŠKY TOXICITY NA EMBRYÍCH A
VÁČKOVÝCH PLŮDCÍCH DANIA PRUHOVANÉHO (BRACHYDANIO RERIO)
ÚVOD
Danio pruhované pochází z indického pobřeží Coromandel,
kde žije v bystřinách. Je běžnou akvarijní rybou z čeledi
kaprovitých. Informace o péči o něj a o jeho chovu jsou
uvedeny v standardních příručkách o tropických rybách.
Přehled jeho biologie a použití ve výzkumu ryb podává
Laale (1).
Ryba zřídka dorůstá délky více než 45 mm. Má válcové tělo
se 7 – 9 horizontálními tmavě modrými stříbřitými pruhy.
Pruhy pokračují přes ocasní a řitní ploutve. Hřbet má
olivově zelený. Samečci jsou štíhlejší než samičky.
Samičky jsou stříbrnější a mají rozšířené břicho, zejména
před třením.
Dospělé ryby dokáží snášet velké kolísání teploty, pH a
tvrdosti vody. Majíli se získat zdravé ryby poskytující
jikry dobré kvality, měly by být zajištěny optimální
podmínky.
Při tření sameček sleduje samičku, doráží na ni a při
vypuzení jiker je oplodní. Jikry, které jsou průsvitné a
nejsou přilnavé, dopadají na dno, kde mohou být pozřeny
rodiči. Na tření má vliv světlo. Při odpovídajícím ranním
světle se ryby třou v prvních hodinách po rozednění.
Samička může klást v odstupu jednoho týdne dávky o
několika tisících jiker.
PODMÍNKY PRO MATEČNÉ RYBY, REPRODUKCE A ČASNÁ VÝVOJOVÁ
STÁDIA
Vybere se vhodný počet zdravých ryb, které se alespoň dva
týdny před předpokládaným třením udržují ve vhodné vodě
(např. dodatek 4). Skupiny ryb by měly mít možnost se
před kladením jiker pro zkoušku alespoň jednou vytřít.
Hustota obsádky ryb by v tomto období neměla přesáhnout
1 gram ryb na litr. Pravidelná výměna vody nebo použití
přečišťovacího systému umožní obsádku zvýšit. Teplota
v chovných nádržích se má udržovat na 25 +/- 2 st.C. Ryby
by měly dostávat rozmanitou stravu, která může obsahovat
například komerční suché krmivo, čerstvě vylíhnuté
Arthemia, chironomidy, dafnie, bílé červy (Enchytraeids).
Dále jsou uvedeny dvě metody, které v praxi vedly
k získání dostatečného množství zdravých oplodněných
jiker pro provedení zkoušky:
i) Osm samiček a 16 samečků se umístí do nádrže
obsahující 50 litrů ředicí vody, chráněné před
přímým světlem a ponechají se alespoň 48 h co
nejvíce v klidu. Na dno nádrže se odpoledne v den
před započetím zkoušky umístí podložka pro tření.
Podložka pro tření se skládá z 5 – 7 mm vysokého
rámu (z plexiskla nebo jiného vhodného materiálu)
s 2 – 5mm hrubým roštem nahoře a s 10 – 30µm jemným
roštem vespod. Na hrubém roštu je připevněn třecí
substrát vyrobený z nylonových vláken. Poté co
byly ryby drženy 12 h v temnu se slabě nasvítí,
čímž se vyvolá tření. Dvě až čtyři hodiny po
vytření se podložka pro tření vyjme a jikry se
seberou. Podložka pro tření zabrání rybám
v požírání jiker a zároveň umožní snadný sběr
jiker. Skupiny ryb by se měly před třením určeným
k produkci jiker pro zkoušku vytřít alespoň jednou.
ii) Pět až deset samečků a samiček se alespoň dva týdny
před zamýšleným třením chová odděleně. Po 5 až
10 dnech se břicha samiček rozšíří a zviditelní se
jejich pohlavní papily. Samečci papily nemají.
Tření se provede v třecích nádržích opatřených
falešným dnem z pletiva (jako výše). Nádrž se
naplní ředicí vodou tak, aby voda sahala 5 – 10 cm
nad rošt. Jedna samička a dva samečci se umístí do
nádrže den před zamýšleným třením. Teplota vody se
postupně zvýší jeden stupeň nad aklimatizační
teplotu. Vypne se osvětlení a nádrž se ponechá co
nejvíce v klidu. Ráno se slabě nasvítí, čímž se
vyvolá tření. Po 2 – 4 h se ryby vyjmou a jikry se
seberou. Jeli potřeba více dávek jiker, než lze
získat od jedné samičky, nasadí se paralelně
dostatečný počet třecích nádrží. Zaznamenáním
reprodukční úspěšnosti (množství a kvality)
jednotlivých samiček před zkouškou, lze vybrat pro
chov samičky s nejvyšší úspěšností.
Jikry se přenesou do zkušebních nádrží skleněnou
trubičkou (o vnitřním průměru ne menším než 4 mm)
opatřenou pružným nasávacím balónkem. Množství vody,
které se přenáší s jikrami, by mělo být co nejmenší.
Jikry jsou těžší než voda a z trubičky vypadnou do vody.
Je třeba zabránit tomu, aby jikry (a plůdky) přišly do
kontaktu se vzduchem. Mikroskopickým vyšetřením vzorku
(vzorků) jiker se ověří, že v prvních stádiích vývoje
nedošlo k nepravidelnostem. Desinfekce jiker není
přípustná.
Mortalita jiker je nejvyšší během prvních 24 h po
oplodnění. V této době je často pozorována mortalita
5 – 40 %. Jikry degenerují v důsledku neúspěšného
oplodnění nebo vývojových vad. Zdá se, že kvalita dávek
jiker závisí na samičce, neboť některé samičky soustavně
kladou jikry dobré kvality, jakou jiné samičky
neposkytují. Rovněž rychlost vývoje a líhnutí se mezi
snůškami liší. Úspěšně oplodněné jikry a plůdky se
žloutkovým váčkem přežívají dobře, obvykle jich přežívá
více než 90 %. Při 25 st.C se z jiker líhnou jedinci po
3 – 5 dnech po oplodnění a žloutkový váček je absorbován
přibližně po 13 dnech po oplodnění.
Embryonální vývoj byl dobře popsán Hisaokou a Battlem
(2). Díky průsvitnosti jiker a plůdků čerstvě po
vylíhnutí lze vývoj ryb dobře sledovat a lze pozorovat
malformace. Přibližně čtyři hodiny po vytření lze
rozlišit neoplodněné jikry od oplodněných (3). K tomuto
vyšetření se jikry a plůdky umístí do nádobky o malém
objemu a prohlížejí se pod mikroskopem.
Zkušební podmínky požadované pro časná vývojová stádia
jsou uvedena v dodatku 2. Optimální hodnoty pH a tvrdosti
vody jsou 7,8 a 250 mg/l, vyjádřeno jako CaCO
3
.VÝPOČTY A STATISTIKA
Navrhuje se dvoufázový přístup. V první fázi se
statisticky analyzují data o mortalitě, nenormálním
vývoji a době líhnutí. Poté se pro ty koncentrace, při
nichž nebyly pozorovány žádné nepříznivé účinky na tyto
parametry, statisticky vyhodnotí tělesná délka. Tento
přístup se doporučuje, neboť toxická látka může
selektivně usmrcovat menší ryby, prodlužovat dobu líhnutí
a indukovat makroskopické malformace a tedy zkreslovat
délku. Kromě toho tak bude pro každou expozici měřen
zhruba stejný počet ryb, čímž se zajistí validita
statistiky zkoušky.
STANOVENÍ LC
50
a EC50
Procento přežití jiker a čerstvých plůdků se vypočte a
zkoriguje na mortalitu v kontrolních skupinách podle
Abbottovy rovnice (4):
C - P'
P = 100 --------- x 100
C
kde:
P = korigované procento přežití
P' = procento přežití pozorované ve zkušební koncentraci
C = procento přežití v kontrolní skupiněPodle možnosti se vhodnou metodou stanoví hodnota LC
50
na
konci zkoušky.
Požadujeli se, aby byly do statistiky pro EC
50
zahrnuty
morfologické odchylky, lze k tomu nalézt návod v práci
Stephana (5).ODHAD LOEC A NOEC
Cílem zkoušky na jikrách a váčkových plůdcích je porovnat
koncentrace, u nichž byl pozorovatelný účinek,
s kontrolními skupinami, tj. stanovit LOEC. Použije se
tedy metoda vícenásobného srovnání (6, 7, 8, 9, 10).
LITERATURA
(1) Laale H. W. (1977). The Biology and Use of the
Zebrafish (Brachydanio rerio) in Fisheries
Research. A Literature Review. J. Fish Biol. 10,
121-173.
(2) Hisaoka K. K., Battle H. I. (1958). The Normal
Development Stages of the Zebrafish Brachydanio
rerio (Hamilton-Buchanan), J. Morph., 102, 311 str.
(3) Nagel R. (1986). Untersuchungen zur Eiproduktion beim
Zebrab‰rbling (Brachydanio rerio Hamilton-
Buchanan). J. Appl. Ichthyol., 2, 173-181.
(4) Finney D. J. (1971). Probit Analysis, 3rd ed.,
Cambridge University Press, Great Britain, 1-333.
(5) Stephan C. E. (1982). Increasing the Usefulness of
Acute Toxicity Tests. Aquatic Toxicology and Hazard
Assessment: Fifth Conference, ASTM STP 766, J. G.
Pearson, R. B. Foster, W. E. Bishop, Eds., American
Society for Testing and Materials, 69-81.
(6) Dunnett C. W. (1955). A Multiple Comparisons
Procedure for Comparing Several Treatments with a
Control. J. Amer. Statist. Assoc., 50, 1096-1121.
(7) Dunnett C. W. (1964). New Tables for Multiple
Comparisons with a Control. J. Amer. Statist.
Assoc, 20, 482-491.
(8) Williams D. A. (1971). A Test for Differences Between
Treatment Means when Several Dose Levels are
Compared with a Zero Dose Control. J. Amer.
Statist. Assoc, 27, 103-117.
(9) Williams D. A. (1972). The Comparison of Several Dose
Levels with a Zero Dose Control. J. Amer. Statist.
Assoc 28, 519-531.
(10) Sokal R. R., Rohlf F. J. (1981). Biometry, the
Principles and Practice of Statistics in Biological
Research, W. H. Freeman, Co., San Francisco.
DODATEK 2
ZKUŠEBNÍ PODMÍNKY, DÉLKA ZKOUŠKY A KRITÉRIA PŘEŽITÍ PRO DOPORUČENÉ DRUHY
------------------------------------------------------------------------- -------------------------------------------
Druh Teplota Salinita Fotoperioda Délka stádií Typická délka Přežití
(st.C) (‰) (h) (d) zkoušky v kontrolních
skupinách
(minimální hodnota
v %)
Embryo Váčkový Úspěšnost Po
plůdek líhnutí vylíhnutí
------------------------------------------------------------------------- -------------------------------------------
SLADKOVODNÍ
Brachydanio 25 +/- 1 — 12-16 3-5 8-10 Pokud možno ihned 80 90
rerio od oplodnění (od
Danio časného stádia
pruhované gastruly) do 5 dnů
po vylíhnutí (8 -
10 dnů)
Oncorhynchus 10 +/- 1 (1) — 0(3) 30-35 25-30 Pokud možno ihned 66 70
mykiss 12 +/- 1 (2) od oplodnění (od
Pstruh duhový časného stádia
gastruly) do 20 dnů
po vylíhnutí (50 -
55 dnů)
Cyprinus 21-25 — 12-16 5 > 4 Pokud možno ihned 80 75
carpio od oplodnění (od
Kapr obecný časného stádia
gastruly) do 4 dnů
po vylíhnutí (8 -
9 dnů)
Oryzias 24 +/- 1 (1) — 12-16 8-11 4-8 Pokud možno ihned 80 80
latipes 23 +/- 1 (2) od oplodnění (od
Halančík časného stádia
japonský gastruly) do 5 dnů
po vylíhnutí (13 -
16 dnů)
Pimephales 25 +/- 2 — 16 4-5 5 Pokud možno ihned 60 70
promelas od oplodnění (od
Střevle časného stádia
gastruly) do 4 dnů
po vylíhnutí (8 -
------------------------------------------------------------------------- ------------------------------------------- 9 dnů)
1 Pro embrya.
2 Pro plůdky.
3 Temno pro embrya a plůdky do jednoho týdne po vylíhnutí, s výjimkou okamžiků
prohlídky. Poté po dobu zkoušky tlumené světlo.
DODATEK 3
ZKUŠEBNÍ PODMÍNKY, DÉLKA ZKOUŠKY A KRITÉRIA PŘEŽITÍ PRO JINÉ DOBŘE POPSANÉ DRUHY
------------------------------------------------------------------------- -------------------------------------------
Druh Teplota Salinita Fotoperioda Délka stádií Typická délka Přežití
(st.C) (‰) (h) (d) zkoušky v kontrolních
skupinách
(minimální hodnota
v %)
Embryo Váčkový Úspěšnost Po
plůdek líhnutí vylíhnutí
------------------------------------------------------------------------- -------------------------------------------
SLADKOVODNÍ
Carassius 24 +/- 1 — — 3-4 > 4 Pokud možno ihned — 80
auratus od oplodnění (od
karas zlatý časného stádia
gastruly) do 4 dnů
po vylíhnutí
(7 dnů)
Leopomis 21 +/- 1 — 16 3 > 4 Pokud možno ihned — 75
macrochirus od oplodnění (od
slunečnice modrá časného stádia
gastruly) do 4 dnů
po vylíhnutí
(7 dnů)
MOŘSKÝ
Menidia 22-25 15-22 12 1,5 10 Pokud možno ihned 80 60
peninsulae od oplodnění (od
časného stádia
gastruly) do 5 dnů
po vylíhnutí (6 -
7 dnů)
Clupea harengus 10 +/- 1 8-15 12 20-25 3-5 Pokud možno ihned 60 80
Sleď od oplodnění (od
časného stádia
gastruly) do 3 dnů
po vylíhnutí (23 -
27 dnů)
Gadus morhua 5 +/- 1 5-30 12 14-16 3-5 Pokud možno ihned 60 80
Treska od oplodnění (od
časného stádia
gastruly) do 3 dnů
po vylíhnutí
(18 dnů)
Cyprinodon 25 +/- 1 15-30 12 — — Pokud možno ihned > 75 80
variegatus od oplodnění (od
časného stádia
gastruly) do
4/7 dnů po
vylíhnutí (28 dnů)
------------------------------------------------------------------------- -------------------------------------------
DODATEK 4
NĚKTERÉ CHEMICKÉ CHARAKTERISTIKY PŘIJATELNÉ ŘEDICÍ VODY
Látka Koncentrace Nerozpuštěné látky < 20 mg/l Celkový organický uhlík < 2 mg/l Nedisociovaný amoniak < 1 µg/l Zbytkový chlor < 10 µg/l Celkové organofosforové pesticidy < 50 ng/l Celkové organochlorové pesticidy a polychlorované bifenyly < 50 ng/l Celkový organický chlor < 25 ng/l
XVI. METODA PRO STANOVENÍ AKUTNÍ ORÁLNÍ TOXICITY PRO
VČELU MEDONOSNOU – metoda C.16 podle přílohy směrnice
2001/59/ES
XVI.1 METODA
Tato zkouška akutní toxicity je replikou metody
OECD TG 213 (1998).
XVI.1.1 ÚVOD
Tato zkouška toxicity je laboratorní metodou
určenou k posouzení orální akutní toxicity
přípravků na ochranu rostlin a jiných chemických
látek pro dospělou dělnici včely medonosné.
Při posuzování a hodnocení toxických
charakteristik látek může být nezbytné stanovení
akutní orální toxicity pro včelu medonosnou,
např. může-li dojít k expozici včel dané chemické
látce. Zkouška akutní orální toxicity se provádí
s cílem stanovit vlastní toxicitu pesticidů a
jiných chemických látek pro včely. Výsledky této
zkoušky by měly být použity pro formulování
potřeby dalšího posuzování. Tato metoda může být
použita zejména ve stupňovaných programech
hodnocení nebezpečnosti pesticidů pro včely
založených na postupném přechodu od laboratorních
zkoušek k semi-polním experimentům (1). Pesticidy
mohou být zkoušeny ve formě účinné látky (ú. l.)
nebo ve formě formulovaných přípravků.
K ověření citlivosti včel a přesnosti zkušebního
postupu se použije referenční látka.
XVI.1.2 DEFINICE
Akutní orální toxicita: je nepříznivý účinek, ke
kterému dojde nejpozději do 96 h od orálního
podání jedné dávky zkoušené látky.
Dávka: je množství požité zkoušené látky. Dávka
se vyjadřuje hmotností (µg) zkoušené látky na
jeden testovací organismus (µg na včelu).
Skutečnou dávku u každé včely nelze vypočítat,
neboť se včely krmí kolektivně. Lze však
odhadnout průměrnou dávku (celkové požité
množství zkoušené látky dělené počtem včel
v klícce).
LD
50
(střední letální dávka) orálně: je
statisticky vypočtená jednotlivá dávka látky,
která může po orálním podáním způsobit úhyn 50 %
jedinců. Hodnota LD50
se vyjadřuje v µg zkoušenou
látky na jednu včelu. U pesticidů muže být
zkoušenou látkou buď účinná látka (ú. l) nebo
formulovaný přípravek obsahující jednu nebo více
účinných látek.Mortalita: jedinec se považuje za uhynulý, jeli
zcela nepohyblivý.
XVI.1.3 PODSTATA ZKUŠEBNÍ METODY
Dospělé dělnice včely medonosné (Apis mellifera)
se exponují řadě dávek zkoušené látky rozptýlené
do cukerného roztoku. Včely jsou poté krmeny
stejným roztokem neobsahujícím zkoušenou látku.
Mortalita se zaznamenává denně během alespoň
48 hodin a porovnává se s kontrolními hodnotami.
Jestliže mortalita v průběhu 24 a 48 h roste,
zatímco kontrolní mortalita zůstává na přijatelné
úrovni, tj. =< 10 %, je vhodné zkoušku
prodloužit na maximálně 96 h. Výsledky zkoušky se
analyzují s cílem vypočítat LD
50
pro 24 h a 48 h
a v případě prodloužené studie pro 72 h a 96 h.XVI.1.4 VALIDITA ZKOUŠKY
Má-li být zkouška platná, musí být splněny
následující podmínky:
— průměrná mortalita u všech kontrolních skupin
nesmí na konci zkoušky překročit 10 %,
— LD
50
pro referenční látku odpovídá
předpokládané hodnotě .XVI.1.5 POPIS ZKUŠEBNÍ METODY
XVI.1.5.1 Včelstvo
Použijí se mladé dospělé včely dělnice z téhož
plemena, tj. včely stejného stáří, stejně
krmené, stejného druhu atd. Včely by měly být
získány z přiměřeně krmeného, zdravého včelstva s
matkou, pokud možno bez nemocí a se známou
anamnézou a fyziologickým stavem. Měly by být
vybrány ráno v den zkoušky nebo by měly být
vybrány večer před zkouškou a drženy v podmínkách
zkoušky do příštího dne. Vhodné jsou včely
z plástů bez plůdků. Včely by neměly být vybírány
brzy na jaře nebo pozdě na podzim, neboť se během
těchto období fyziologicky mění. Musí-li být
zkoušky provedeny brzy na jaře nebo pozdě na
podzim, měly by se včely vylíhnout v inkubátoru a
měly by být živeny plástovým pylem (pyl sebraný
z plástu) a cukrovým roztokem. Včely ošetřované
chemickými látkami, jako jsou antibiotika a
prostředky proti varoáze, by neměly být použity
pro zkoušky toxicity po čtyři týdny od konce
posledního ošetření.
XVI.1.5.2 Podmínky chovu a krmení
Použijí se snadno čistitelné a dobře větrané
klícky. Lze použít jakýkoli vhodný materiál,
např. klícky z korozivzdorné oceli, pletiva,
plastu nebo jednorázové dřevěné klícky atd.
Nasazují se pokud možno skupiny po 10 včelách.
Velikost zkušebních klícek by měla vyhovovat
počtu včel, tj. měla by poskytovat dostatek
prostoru.
Včely by měly být drženy v temnu v experimentální
místnosti při teplotě 25 +/- 2 st.C. Po dobu
zkoušky se zaznamenává relativní vlhkost, která
je obvykle 50 – 70 %. Obsluha, včetně exponování
a pozorování, může být prováděna za (denního)
světla. Jako potrava se používá vodný roztok
cukru o konečné koncentraci 500 g*l
-1
(50%
(m/V)). Po podání zkušební dávky se podává
potrava podle libosti. Systém krmení by měl
umožňovat zaznamenání příjmu potravy pro každou
klícku (viz bod 1.6.3.1). Lze použít skleněnou
trubičku (přibližně 50 mm dlouhou, s průměrem
10 mm, zúženou na otevřeném konci na průměr
asi 2 mm).XVI.1.5.3 Příprava včel
Shromážděné včely se náhodně rozdělí do klícek,
které se náhodně umístí v experimentální
místnosti.
Před začátkem zkoušky mohou včely až 2 h
hladovět. Doporučuje se, aby nebyla včelám před
expozicí podávána potrava, aby byly na začátku
zkoušky rovnocenné, pokud jde o obsah zažívacího
ústrojí. Včely v agónii se před zahájením zkoušky
nahradí zdravými včelami.
XVI.1.5.4 Příprava dávek
Je-li zkoušená látka mísitelná s vodou, může být
rozptýlena přímo v 50% cukerném roztoku. U
technických přípravků a látek s nízkou
rozpustností ve vodě mohou být použita vehikula,
jakou jsou organická rozpouštědla, emulgátory
nebo dispergátory s nízkou toxicitou pro včely
(např. aceton, dimethylformamid,
dimethylsulfoxid). Koncentrace vehikula závisí na
rozpustnosti zkoušené látky a měla by být stejná
pro všechny zkoušené koncentrace. Obecně je
přiměřená 1% koncentrace vehikula a neměla by být
překračována.
Připraví se vhodné kontrolní roztoky, tzn.
Použijí-li se k rozpuštění zkoušené látky
rozpouštědlo nebo dispergátor, použijí se dvě
samostatné kontrolní skupiny: roztok ve vodě a
cukerný roztok s rozpouštědlem/nosičem
v koncentraci použité v dávkách.
XVI.1.6 POSTUP
XVI.1.6.1 Zkušební a kontrolní skupiny
Počet zkoušených dávek a jejich opakování by měl
splňovat statistické požadavky na stanovení LD
50
na úrovni spolehlivosti 95 %. Zpravidla se pro
zkoušku požaduje alespoň pět zkušebních
koncentrací tvořících geometrickou řadu
s faktorem nepřekračujícím 2,2 a pokrývajících
rozsah pro LD50
. Ředicí faktor a počet
koncentrací pro dávkování se však stanoví
s ohledem na směrnici křivky toxicity (dávka
versus mortalita) a s ohledem na statistickou
metodu zvolenou pro analýzu výsledků. Vhodné
koncentrace pro dávky je možné zvolit pomocí
orientační zkoušky.
Každá zkušební koncentrace se podá alespoň třem
paralelním zkušební skupinám o 10 včelách. Vedle
zkušebních skupin se nasadí alespoň tři kontrolní
skupiny, každá o 10 včelách. Nasadí se také
zkušební skupiny pro použité rozpouštědlo nebo
nosič (viz bod 1.5.4).
XVI.1.6.2 Referenční látka
V rámci zkušebních skupin se použije referenční
látka. Vyberou se alespoň tři dávky pokrývající
očekávanou hodnotu LD
50
. Pro každou zkušební
dávku se nasadí alespoň tři paralelní klícky po
deseti včelách. Přednostní referenční látkou je
dimethoát, pro nějž se uvádí LD50
, 24 h, orálně
v rozmezí 0,10 – 0,35 µg účinné látky na včelu
(2). Jsou však přijatelné i jiné referenční
látky, pokud lze předložit dostatek údajů pro
ověření očekávané reakce na dávku
(např. parathion).XVI.1.6.3 Expozice
XVI.1.6.3.1 Podávání dávek
Každé zkušební skupině včel se podá 100 – 200 µl
50% vodného cukerného roztoku obsahujícího
zkoušenou látku ve vhodné koncentraci. Větší
objem je nezbytný u látek s nízkou rozpustností,
nízkou toxicitou nebo nízkou koncentrací ve
formulaci, neboť v cukerném roztoku musí být
použit větší podíl. Sleduje se množství
spotřebované potravy se zkoušenou látkou. Po
spotřebování potravy (obvykle do 3 – 4 h) se
z klícky odebere krmicí zařízení a nahradí se
krmicím zařízením obsahujícím pouze cukerný
roztok. Cukerný roztok se poté podává podle
libosti. U některých sloučenin může vést
odmítnutí potravy s vysokými koncentracemi
k tomu, že je spotřebováno málo potravy nebo že
se nespotřebuje žádná potrava. Po maximálně 6 h
se nespotřebovaná potrava se zkoušenou látkou
nahradí samotným cukerným roztokem. Stanoví se
množství spotřebované potravy se zkoušenou látkou
(např. měřením objemu nebo zvážení nespotřebované
stravy).
XVI.1.6.3.2 Délka zkoušky
Zkouška trvá 48 h od okamžiku, kdy byl zkušební
roztok nahrazen samotným cukerným roztokem.
Vzroste-li mortalita během prvních 24 h o 10 %,
zkouška se prodlouží na 96 h, pokud mortalita
v kontrolních skupinách nepřekročí 10 %.
XVI.1.6.4 Pozorování
Mortalita se zaznamená po 4 h od zahájení zkoušky
a poté po 24 h a 48 h (rozumí se po podání
dávky). Jeli nezbytné pozorování prodloužit,
provedou se další vyhodnocení v 24hodinových
intervalech až do maximálně 96 hodin, pokud
mortalita v kontrolních skupinách nepřekračuje
10 %.
Odhadne se množství spotřebované potravy.
Porovnáním rychlostí spotřebování potravy se
zkoušenou látkou a bez ní lze získat informaci o
přijatelnosti potravy se zkoušenou látkou.
Zaznamená se neobvyklé chování pozorované během
doby zkoušky.
XVI.1.6.5 Limitní zkouška
V některých případech (např. očekává-li se u
látky nízká toxicita) může být provedena limitní
zkouška za použití 100 µg účinné látky na včelu
s cílem prokázat, že LD
50
je vyšší než tato
hodnota. Při ní se postupuje stejným způsobem,
tj. nasadí se tři paralelní zkušební skupiny pro
každou zkušební koncentraci, odpovídající
kontrolní skupiny, stanoví se množství
spotřebované potravy s účinnou látkou a použije
se referenční látka. Dojde-li k úhynům, musí se
provést úplná studie. Jsou-li pozorovány
subletální účinky (viz bod 1.6.4), zaznamenají
se.XVI.2 DATA A ZPRÁVY
XVI.2.1 DATA
Data se shrnou do tabulky, přičemž se pro každou
zkušební skupinu, kontrolní skupiny a skupiny
s referenční látkou uvede počet použitých včel,
mortalita v každém pozorovacím čase a počet včel
s nepříznivě ovlivněným chováním. Údaje o
mortalitě se analyzují vhodnými statistickými
metodami (např. probitovou analýzou, klouzavým
průměrem, proložením binomického rozdělení) (3,
4). Sestrojí se křivky závislosti dávka-odezva
pro každý čas pozorování a vypočtou se směrnice
křivek a střední letální dávky (LD
50
) s 95%
intervalem spolehlivosti. Korekce na mortalitu ve
kontrolních skupinách lze provést Abbottovou
korekcí (4, 5). Pokud nebyla potrava zcela
spotřebována, stanoví se spotřebovaná dávka
zkoušené látky na skupinu. LD50
se vyjádří v µg
zkoušené látky na včelu.XVI.2.2 PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat následující
informace:
XVI.2.2.1 Zkoušená látka
— fyzikální stav a relevantní fyzikálněchemické
vlastnosti (např. stálost ve vodě, tlak par),
— údaje o chemické identitě včetně strukturního
vzorce, čistota, (tj. u pesticidů identita a
koncentrace účinné látky (účinných látek)).
XVI.2.2.2 Testovací druh
— vědecký název, plemeno, přibližné stáří
(v týdnech), metoda výběru včel, datum
výběru,
— informace o včelstvech použitých pro výběr
testovacích včel, včetně informací o
zdravotním stavu, nemocech dospělců, o
případné přípravě atd.
XVI.2.2.3 Zkušební podmínky
— teplota a relativní vlhkost v experimentální
místnosti,
— podmínky chovu včetně typu, velikosti a
materiálu klícek,
— metody přípravy zásobních a zkušebních roztoků
(jeli použito, uvede se rozpouštědlo a jeho
koncentrace),
— metoda přípravy zásobních roztoků a častost
obnovení (jeli použito, uvede se
solubilizační činidlo a jeho koncentrace),
— uspořádání zkoušky, např. použité zkušební
koncentrace a jejich počet, počet kontrolních
skupin, pro každou koncentraci a kontrolu
počet paralelních klícek a počet včel na
klícku,
— datum zkoušky.
XVI.2.2.4 Výsledky
— výsledky předběžné orientační zkoušky, byla-li
provedena,
— primární údaje: mortalita pro každou zkoušenou
koncentraci v každém čase pozorování,
— graf křivek závislosti dávka-odezva na konci
zkoušky,
— hodnoty LD
50
s 95% intervaly spolehlivosti pro
každý doporučený čas pozorování a to pro
zkoušenou látku a pro referenční látku, — statistické metody použité pro stanovení LD
50
, — mortalita v kontrolních skupinách,
— jiné pozorované nebo naměřené biologické
účinky, např. neobvyklé chování včel (včetně
odmítnutí zkušební dávky), rychlost
spotřebování potravy v exponovaných a
neexponovaných skupinách,
— jakákoli odchylka od zde popsaného zkušebního
postupu a jiné důležité informace.
XVI.3 LITERATURA
(1) EPPO/Council of Europe (1993). Decision-
Making Scheme for the Environmental Risk
Assessment of Plant Protection Products –
Honeybees. EPPO bulletin, Vol. 23, N.1,
str. 151 – 165. březen 1993.
(2) Gough, H. J., McIndoe, E. C., Lewis, G. B.
(1994). The use of dimethoate as a reference
compound in laboratory acute toxicity tests
on honeybees (Apis mellifera L.),
1981 – 1992. J. Apicultur. Res. 22,
str. 119 – 125.
(3) Litchfield, J. T., Wilcoxon, F. (1949). A
simplified method of evaluating dose-effect
experiments. J. Pharm. Exper. Ther., 96,
str. 99 – 113.
(4) Finney, D. J. (1971). Probit Analysis. 3rd
ed., Cambridge, London and New York.
(5) Abbott, W. S. (1925). A method for computing
the effectiveness of an insecticide. J. Econ.
Entomol. 18, str. 265 – 267.
XVII. METODA PRO STANOVENÍ AKUTNÍ KONTAKTNÍ TOXICITY PRO
VČELU MEDONOSNOU – metoda C.17 podle přílohy směrnice
2001/59/ES
XVII.1 METODA
Tato zkouška akutní toxicity je replikou metody
OECD TG 214 (1998).
XVII.1.1 ÚVOD
Tato zkouška toxicity je laboratorní metodou
určenou k posouzení akutní kontaktní toxicity
přípravků na ochranu rostlin a jiných chemických
látek pro dospělou dělnici včely medonosné.
Při posuzování a hodnocení toxických
charakteristik látek může být nezbytné stanovení
akutní kontaktní toxicity pro včelu medonosnou,
např. můželi dojít k expozici včel dané chemické
látce. Zkouška akutní kontaktní toxicity se
provádí s cílem stanovit vlastní toxicitu
pesticidů a jiných chemických látek pro včely.
Výsledky této zkoušky by měly být použity pro
formulování potřeby dalšího posuzování. Tato
metoda může být použita zejména ve stupňovaných
programech hodnocení nebezpečnosti pesticidů pro
včely založených na postupném přechodu od
laboratorních zkoušek k semi-polním experimentům
(1). Pesticidy mohou být zkoušeny ve formě účinné
látky (ú. l.) nebo ve formě formulovaných
přípravků. K ověření citlivosti včel a přesnosti
zkušebního postupu se použije referenční látka.
XVII.1.2 DEFINICE
Akutní kontaktní toxicita: je nepříznivý účinek,
ke kterému dojde nejpozději do 96 h od lokální
aplikace jedné dávky zkoušené látky.
Dávka: je množství aplikované zkoušené látky.
Dávka se vyjadřuje v hmotnosti (µg) zkoušené
látky na jednoho zkušebního živočicha (µg na
včelu).
LD
50
(střední letální dávka) kontaktně: je
statisticky vypočtená jednotlivá dávka látky,
která může po kontaktní aplikaci způsobit úhyn
50 % jedinců. Hodnota LD50
se vyjadřuje v µg
zkoušené látky na jednu včelu. U pesticidů muže
být zkoušenou látkou buď účinná látka (ú. l) nebo
formulovaný přípravek obsahující jednu nebo více
účinných látek. Mortalita: jedinec se považuje za uhynulý, jeli
zcela nepohyblivý.
XVII.1.3 PODSTATA ZKUŠEBNÍ METODY
Dospělé dělnice včely medonosné (Apis mellifera)
se exponují řadě dávek zkoušené látky rozpuštěné
ve vhodném nosiči přímou aplikací na hrudník
(jako kapičky). Zkouška trvá 48 h. Jestliže
mortalita v průběhu 24 a 48 h roste, zatímco
kontrolní mortalita zůstává na přijatelné úrovni,
tj. 10 %, je vhodné zkoušku prodloužit na
maximálně 96 h. Mortalita se zaznamenává denně a
porovnává se s kontrolními hodnotami. Výsledky
zkoušky se analyzují s cílem vypočítat LD
50
pro
24 h a 48 h a v případě prodloužené studie pro
72 h a 96 h.XVII.1.4 VALIDITA ZKOUŠKY
Má-li být zkouška platná, musí být splněny
následující podmínky:
— průměrná mortalita u všech kontrolních skupin
nesmí na konci zkoušky překročit 10 %,
— LD
50
pro referenční standard odpovídá
specifikovanému rozsahu.XVII.1.5 POPIS ZKUŠEBNÍ METODY
XVII.1.5.1 Výběr včel
Použijí se mladé dospělé včely dělnice z téhož
plemena, tj. včely stejného stáří, stejně
krmené, stejného druhu atd. Včely by měly být
získány z přiměřeně krmeného, zdravého včelstva s
matkou, pokud možno bez nemocí a se známou
anamnézou a fyziologickým stavem. Měly by být
vybrány ráno v den zkoušky nebo by měly být
vybrány večer před zkouškou a drženy v podmínkách
zkoušky do příštího dne. Vhodné jsou včely
z plástů bez plůdků. Včely by neměly být vybírány
brzy na jaře nebo pozdě na podzim, neboť se během
těchto období fyziologicky mění. Musí-li být
zkoušky provedeny brzy na jaře nebo pozdě na
podzim, měly by se včely vylíhnout v inkubátoru a
měly by být živeny plástovým pylem (pyl sebraný
z plástu) a cukrovým roztokem. Včely ošetřované
chemickými látkami, jako jsou antibiotika a
prostředky proti varoáze, by neměly být použity
pro zkoušky toxicity po čtyři týdny od konce
posledního ošetření.
XVII.1.5.2 Podmínky chovu a krmení
Použijí se snadno čistitelné a dobře větrané
klícky. Lze použít jakýkoli vhodný materiál,
např. klícky z korozivzdorné oceli, pletiva,
plastu nebo jednorázové dřevěné klícky atd.
Velikost zkušebních klícek by měla vyhovovat
počtu včel, tj. klícky by měly poskytovat
dostatek prostoru. Nasazují se pokud možno
skupiny po 10 včelách.
Včely by měly být drženy v temnu v experimentální
místnosti při teplotě 25 +/- 2 st.C. Po dobu
zkoušky se zaznamenává relativní vlhkost, která
je obvykle 50 – 70 %. Obsluha, včetně exponování
a pozorování, může být prováděna za (denního)
světla. Jako potrava se používá vodný roztok
cukru o konečné koncentraci 500 g*l
-1
(50% (m/V))
a podává se za použití včelího krmítka po dobu
zkoušky podle libosti. Lze použít skleněnou
trubičku (přibližně 50 mm dlouhou, s průměrem
10 mm, zúženou na otevřeném konci na průměr
asi 2 mm).XVII.1.5.3 Příprava včel
Shromážděné včely mohou být za účelem aplikace
zkušební látky narkotizovány oxidem uhličitým
nebo dusíkem. Množství anestetika v době expozice
by mělo být minimalizováno. Včely v agónii se
před zahájením zkoušky nahradí zdravými včelami.
XVII.1.5.4 Příprava dávek
Zkušební látka se aplikuje jako roztok v nosiči,
tj. v organickém rozpouštědle nebo ve vodě se
smáčedlem. Jako organické rozpouštědlo se
upřednostňuje aceton, mohou však být použity i
jiná rozpouštědla s nízkou toxicitou pro včely
(např. dimethylformamid, dimethylsulfoxid). U
formulovaných přípravků dispergovaných ve vodě a
u silně polárních organických látek nerozpustných
v organických nosičových rozpouštědlech lze
aplikaci usnadnit jejich rozpuštění ve slabém
roztoku komerčního smáčedla (např. smáčedla
Agral, Cittowett, Lubrol, Triton, Tween).
Připraví se vhodné kontrolní roztoky, tzn.
použijíli se k rozpuštění zkušební látky
rozpouštědlo nebo dispergátor, použijí se dvě
samostatné kontrolní skupiny: roztok ve vodě a
roztok s rozpouštědlem/nosičem.
XVII.1.6 POSTUP
XVII.1.6.1 Zkušební a kontrolní skupiny
Počet zkoušených dávek a jejich paralelních
experimentů by měl splňovat statistické požadavky
na stanovení LD
50
na hladině spolehlivosti 95 %.
Zpravidla se pro zkoušku požaduje alespoň pět
zkušebních koncentrací tvořících geometrickou
řadu s faktorem nepřekračujícím 2,2 a
pokrývajících rozsah pro LD50
. Počet dávek se
však stanoví s ohledem na směrnici křivky
toxicity (dávka versus mortalita) a s ohledem na
statistickou metodu zvolenou pro analýzu
výsledků. Vhodné dávky je možné zvolit pomocí
orientační zkoušky.
Každá zkušební koncentrace se podá alespoň třem
paralelním zkušební skupinám o 10 včelách.
Vedle zkušebních skupin se nasadí alespoň tři
kontrolní skupiny, každá o 10 včelách. Jeli
použito organické rozpouštědlo nebo smáčedlo,
zařadí se další tři kontrolní skupiny po
10 včelách pro rozpouštědlo a smáčedlo.
XVII.1.6.2 Referenční látka
V rámci zkušebních skupin musí být použita
referenční látka. Vyberou se alespoň tři dávky
pokrývající očekávanou hodnotu LD
50
. Pro každou
zkušební dávku se nasadí alespoň tři paralelní
klícky po 10 včelách. Upřednostňovanou referenční
látkou je dimethoát, pro nějž se uvádí LD50
,
24 h, kontaktně v rozmezí 0,10 – 0,30 µg účinné
látky na včelu (2). Jsou však přijatelné i jiné
referenční látky, pokud lze předložit dostatek
údajů pro ověření očekávané reakce na dávku
(např. parathion).XVII.1.6.3 Expozice
XVII.1.6.3.1 Podávání dávek
U narkotizovaných včel se jednotlivě provede
lokální aplikace. Včely se náhodně rozdělí do
různých zkušebních a kontrolních skupin. Objem
1 µl roztoku obsahující zkušební látku ve vhodné
koncentraci se aplikuje mikroaplikátorem na
zádovou oblast hrudníku každé včely. Mohou být
použity i jiné objemy, jeli to opodstatněné. Po
aplikaci se včely umístí do zkušebních klícek a
zásobí se cukerným roztokem.
XVII.1.6.3.2 Délka expozice
Zkouška má trvat nejlépe 48 h. Jestliže mortalita
v průběhu 24 a 48 h roste, je vhodné zkoušku
prodloužit na maximálně 96 h, pokud kontrolní
mortalita nepřekračuje 10 %.
XVII.1.6.4 Pozorování
Mortalita se zaznamená po 4 h od aplikace a poté
po 24 h a 48 h. Jeli nezbytné pozorování
prodloužit, provedou se další vyhodnocení
v 24hodinových intervalech až do maximálně 96 h,
pokud mortalita v kontrolních skupinách
nepřekračuje 10 %.
Zaznamená se neobvyklé chování pozorované během
doby zkoušky.
XVII.1.6.5 Limitní zkouška
V některých případech (např. očekáváli se u
látky nízká toxicita) může být provedena limitní
zkouška za použití 100 µg účinné látky na včelu
s cílem prokázat, že LD
50
je vyšší než tato
hodnota. Postupuje se stejným způsobem, včetně
nasazení tří paralelních zkušebních skupin pro
každou zkušební dávku, odpovídajících kontrolních
skupin a použití referenční látky. Dojdeli
k úhynům, musí se provést úplná studie. Jsou-li
pozorovány subletální účinky (viz bod 1.6.4),
zaznamenají se.XVII.2. DATA A ZPRÁVY
XVII.2.1 DATA
Data se shrnou do tabulky, přičemž se pro každou
zkušební skupinu, kontrolní skupiny a skupiny
s referenční látkou uvede počet použitých včel,
mortalita v každém pozorovacím čase a počet včel
s nepříznivě ovlivněným chováním. Údaje o
mortalitě se analyzují vhodnými statistickými
metodami (např. probitovou analýzou, klouzavým
průměrem, proložením binomického rozdělení)
(3, 4). Sestrojí se křivky závislosti
dávkareakce pro každý čas pozorování (tj. 24 h,
48 h a podle potřeby 72 h, 96 h) a vypočtou se
směrnice křivek a střední letální dávky (LD
50
)
s 95% intervalem spolehlivosti. Korekce na
mortalitu v kontrolních skupinách lze provést
Abbottovou korekcí (4, 5). LD50
se vyjádří v µg
zkušební látky na včelu.XVII.2.2 PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat následující
informace:
XVII.2.2.1 Zkoušená látka
— fyzikální stav a fyzikálněchemické vlastnosti
(např. stálost ve vodě, tlak par),
— údaje o chemické identitě včetně strukturního
vzorce, čistota, (tj. u pesticidů identita a
koncentrace účinné látky (účinných látek)).
XVII.2.2.2 Testovací druh
— vědecký název, plemeno, přibližné stáří
(v týdnech), metoda výběru shromáždění včel,
datum výběru,
— informace o včelstvech použitých pro
shromáždění testovacích včel, včetně
informací o zdravotním stavu, nemocech
dospělců, o případné přípravě atd.
XVII.2.2.3 Zkušební podmínky
— teplota a relativní vlhkost v experimentální
místnosti,
— podmínky chovu včetně typu, velikosti a
materiálu klícek,
— metody aplikace zkoušené látky, např. použité
nosné rozpouštědlo, aplikovaný objem
zkušebního roztoku, použité anestetikum,
— uspořádání zkoušky, např. použité zkušební
dávky a jejich počet, počet kontrolních
skupin, pro každou dávku a kontrolu počet
paralelních klícek a počet včel na klícku,
— datum zkoušky.
XVII.2.2.4 Výsledky
— výsledky předběžné orientační zkoušky, bylali
provedena,
— primární data: data: mortalita pro každou
zkoušenou dávku v každém čase pozorování,
— graf křivek závislosti dávkaodezva na konci
zkoušky;
— hodnoty LD
50
s 95% intervaly spolehlivosti pro
každý doporučený čas pozorování, a to pro
zkoušenou látku a referenční látku, — statistické metody použité pro stanovení LD
50
, — mortalita v kontrolních skupinách,
— jiné pozorované nebo změřené biologické účinky
a jakékoli neobvyklé reakce včel,
— jakákoli odchylka od zde popsaného zkušebního
postupu metody a jiné důležité informace.
XVII.3 LITERATURA
(1) EPPO/Council of Europe (1993). Decision-
Making Scheme for the Environmental Risk
Assessment of Plant Protection Products –
Honeybees. EPPO bulletin, Vol. 23, N.1,
str. 151 – 165. March 1993.
(2) Gough, H. J., McIndoe, E. C., Lewis, G. B.
(1994). The use of dimethoate as a reference
compound in laboratory acute toxicity tests
on honeybees (Apis mellifera L.),
1981 – 1992. J. Apicultur. Research 22,
str. 119 – 125.
(3) Litchfield, J. T. and Wilcoxon, F. (1949). A
simplified method of evaluating dose-effect
experiments. J. Pharmacol. Exper. Ther., 96,
str. 99 – 113.
(4) Finney, D. J. (1971). Probit Analysis. 3rd
ed., Cambridge, London and New York.
(5) Abbott, W. S. (1925). A method for computing
the effectiveness of an insecticide. J. Econ.
Entomol. 18, str. 265 – 267.
XVIII. METODA PRO STANOVENÍ ADSORPCE / DESORPCE
V ROVNOVÁŽNÉM STAVU – metoda C.18 podle přílohy směrnice
2001/59/ES
XVIII.1. METODA
Tato metoda je replikou metody OECD TG 106 pro
stanovení půdní adsorpce/desorpce násadovou
rovnovážnou metodou (Batch Equilibrium Method)
(2000).
XVIII.1.1 ÚVOD
Tato metoda se opírá o okružní testy a seminář o
výběru půd pro vývoj zkoušky adsorpce (1, 2, 3,
4) a rovněž o existující národní metodiky (5, 6,
7, 8, 9, 10, 11).
Studie adsorpce/desorpce jsou užitečné pro
získávání důležitých informací o mobilitě a
distribuci chemických látek v půdních, vodních a
vzdušných složkách biosféry (12, 13, 14, 15, 16,
17, 18, 19, 20, 21). Informace lze použít
k předpovědi nebo např. odhadu dostupnosti
chemické látky pro rozklad, (22, 23),
transformace a příjmu organismy (24), vymývání
půdním profilem, (16, 18, 19, 21, 25, 26, 27,
28); těkání z půdy (21, 29, 30); odtoku z půdního
povrchu do vod (18, 31, 32). Data o adsorpci
mohou být použita pro účely porovnání a
modelování (19, 33, 34, 35).
Rozdělení chemické látky mezi půdu a vodní fázi
je složitý proces, který závisí na řadě různých
faktorů: na chemické povaze látky (12, 36, 37,
38, 39, 40), na charakteristikách půdy (4, 12,
13, 14, 41, 42, 43, 44, 45, 46, 47, 48, 49) a na
klimatických faktorech, jako jsou srážky,
teplota, sluneční svit a vítr. Početné fenomény a
mechanismy účastnící se adsorpce chemické látky
v půdě tedy nelze v celém rozsahu definovat
zjednodušeným laboratorním modelem, na jakém je
založena tato metoda. Přestože nelze tímto
pokusem podchytit všechny možné případy
z životního prostředí, poskytuje cenné informace
o významnosti adsorpce chemické látky z hlediska
životního prostředí. Viz také obecný úvod.
XVIII.1.2 POUŽITÍ
Tato metoda je zaměřena na odhad
adsorpčního/desorpčního chování látky v půdách.
Cílem je získat sorpční charakteristiky, které
lze použít pro předpověď rozdělení za
nejrůznějších podmínek v životním prostředí;
k tomuto účelu se pro chemickou látku stanovují
rovnovážné adsorpční koeficienty v různých půdách
jako funkce půdních charakteristik (např. obsahu
organického uhlíku, obsahu jílu, půdní textury a
pH). Pro co nejširšího podchycení interakcí dané
látky s půdami vyskytujícími se v přírodě musí
být použity při zkoušce různé druhy půd.
V této metodě vyjadřuje adsorpce proces vázání
chemické látky na půdní povrch; nerozlišuje se
mezi různými adsorpčními procesy (fyzikální a
chemickou adsorpcí) a procesy, jako jsou
povrchově katalyzovaný rozklad, adsorpce velkých
množství nebo chemická reakce. Adsorpce na
koloidních částicích (průměr < 0,2 µm)
vznikajících v půdě se nebere v úvahu.
Půdními parametry, které jsou považovány za
nejdůležitější, jsou: obsah organického uhlíku
(3, 4, 12, 13, 14, 41, 43, 44, 45, 46, 47, 48),
obsah jílu a půdní textura (3, 4, 41, 42, 43, 44,
45, 46, 47, 48) a pro disociující sloučeniny také
pH (3, 4, 42). Dalšími půdními parametry, které
mohou mít vliv na adsorpci/desorpci určité látky
jsou efektivní kationtová výměnná kapacita
(ECEC), obsah amorfních oxidů železa a hliníku,
zejména u vulkanických a tropických půd (4) a
rovněž měrný povrch (49).
Zkouška je navržena pro posouzení adsorpce
chemické látky na různých druzích půd s různým
obsahem organického uhlíku, jílu, různou půdní
texturou a různým pH. Je trojstupňová:
Stupeň 1: Předběžná zkouška za účelem stanovení:
— poměru půda/roztok,
— rovnovážného adsorpčního času a
množství zkoušené látky
adsorbovaného v rovnováze,
— adsorpce zkoušené látky na stěnách
zkušební nádoby a stálosti zkoušené
látky v průběhu zkoušky.
Stupeň 2: Screeningová zkouška: studie adsorpční
kinetiky a stanovení distribučních
koeficientů Kd a K
ou
pro pět druhů půd
a jednu koncentraci. Stupeň 3: Stanovení Freundlichových isotherm za
účelem zjištění vlivu koncentrace na
velikost adsorpce na půdách.
Studie desorpce prostřednictvím desorpční
kinetiky/ Freundlichových desorpčních isotherm
(dodatek 1).
XVIII.1.3 DEFINICE A JEDNOTKY
Symbol Definice Jednotky Atiprocento adsorpce v čase ti% Aeqprocento adsorpce v adsorpční rovnováze % mpads(ti) množství zkoušené látky adsorbované na půdě v čase ti µg mpads(delta ti) množství zkoušené látky adsorbované na půdě za časový interval µg mpads(eq) množství zkoušené látky adsorbované na půdě v adsorpční rovnováze µg m0množství zkoušené látky ve zkušební nádobě na začátku adsorpční zkoušky µg mpads(ti) množství zkoušené látky naměřené v podílu () v okamžiku ti µg mvads(eq) množství zkoušené látky v roztoku v adsorpční rovnováze µg mpůdamnožství půdní fáze vyjádřené v suché hmotnosti půdy g czás.hmotnostní koncentrace zásobního roztoku látky µg*cm-3C0počáteční hmotnostní koncentrace zkušebního roztoku v kontaktu s půdou µg*cm-3Cvodads(ti) hmotnostní koncentrace látky ve vodné fázi v čase ti, kdy je prováděna µg*cm-3analýza Cpads(ti) množství látky adsorbované na půdě v adsorpční rovnováze µg*cm-3Cvodads(eq) hmotnostní koncentrace látky ve vodné fázi v adsorpční rovnováze µg*cm-3V0počáteční objem vodné fáze v kontaktu s půdou během adsorpční zkoušky cm3vaAobjem podílu, ve kterém je látka stanovována cm3Kddistribuční koeficient pro adsorpci cm3*g-1Kouadsorpční koeficient normalizovaný na organický uhlík cm3*g-1Komdistribuční koeficient normalizovaný na obsah organického materiálu cm3*g-1KFadsFreundlichův adsorpční koeficient µg1-1/n (cm3)1/n*g-1Freundlichův exponent Dtiprocento desorpce v čase ti% Ddeltatiprocento desorpce za časový interval % Kdeszdánlivý desorpční koeficient cm3*g-1KFdesFreundlichův desorpční koeficient µg1-1/n (cm3)1/n*g-1mvoddes(ti) množství zkoušené látky desorbované z půdy v čase ti µg mvoddes(deltati) množství zkoušené látky desorbované z půdy za časový interval µg mvoddes(eq) analyticky stanovené množství látky ve vodné fázi v desorpční rovnováze µg mpdes(deltati) celkové množství zkoušené látky desorbované v desorpční rovnováze µg mpdes(deltati) množství látky, která zůstává adsorbovaná na půdě po uplynutí časového µg intervalu delta t mvodAmnožství látky, které zbylo (aniž se adsorbovalo) po ustavení adsorpční µg rovnováhy, a to v důsledku nekvantitativní výměny objemu vodné fáze Cpdes(eq) množství zkoušené látky, které zůstalo adsorbované na půdě v desorpční µg*g-1rovnováze Cvoddes(eq) hmotnostní koncentrace látky ve vodné fázi v desorpční rovnováze µg*cm-3VTcelkový objem vodné fáze v kontaktu s půdou během experimentu pro cm3studium desorpční kinetiky provedeného sériovou metodou VRobjem supernatantu odebraného ze zkušební nádoby po dosažení adsorpční cm3rovnováhy a nahrazeného stejným objemem 0,01M roztoku CaCl2vaPobjem podílu odebraného k analýze od okamžiku ti během experimentu pro cm3studium desorpční kinetiky provedeného sériovou metodou Vriobjem roztoku odebraného ze zkušební nádoby (i) ke stanovení zkoušené cm3látky v experimentu pro studium desorpční kinetiky (paralelní metoda) Vrfobjem roztoku odebraného ze zkušební nádoby ke stanovení zkoušené látky cm3v desorpční rovnováze množstevní bilance % mEcelkové množství zkoušené látky extrahované z půdy a ze stěn zkušební µg nádoby ve dvou krocích Vrecobjem supernatantu získaný po dosažení adsorpční rovnováhy cm3Povrozdělovací koeficient oktanol/voda pKadisociační konstanta Svrozpustnost ve vodě g*l-1
XVIII.1.4 PODSTATA ZKUŠEBNÍ METODY
Známé objemy roztoků zkoušené látky o známé
koncentraci, značené nebo neznačené radionuklidy,
se v 0,01M CaCl
2
přidají k půdním vzorkům o známé
sušině, které byly předběžně uvedeny do rovnováhy
s 0,01M CaCl2
. Směs se přiměřenou dobu
protřepává. Půdní suspenze se poté oddělí
centrifugací a podle požadavků zfiltruje a vodná
fáze se analyzuje. Množství zkoušené látky
adsorbované na půdním vzorku se vypočte z rozdílu
mezi počátečním množstvím zkoušené látky
v roztoku a množstvím, které v něm zbylo na konci
experimentu (nepřímá metoda).
Alternativně lze adsorbované množství zkoušené
látky stanovit také přímo analýzou půdy (přímá
metoda). Tato metoda, která zahrnuje postupnou
extrakci vhodným rozpouštědlem se doporučuje
v případech, kdy nelze přesně stanovit rozdíl
koncentrací látky v roztocích. Jde například o
tyto případy: adsorpce zkoušené látky na stěnách
zkušebních nádob, nestálost zkoušené látky
v poměru k délce experimentu, nízká adsorpce
s malou změnou koncentrace v roztoku a vysoká
adsorpce, jejímž důsledkem je nízká koncentrace,
kterou nelze přesně stanovit. Použijeli se látka
značená radioizotopy, lze extrakci půdy obejít
analýzou půdní fáze spočívající v jejím spálení a
v měření kapalinovou scintilační spektrometrií.
Měření kapalinovou scintilační spektrometrií je
nespecifickou technikou, která nerozlišuje mezi
mateřskými a transformačními produkty; měla by
tedy být použita pouze tehdy, jeli zkoušené
chemická látka po celou dobu studie stálá.
XVIII.1.5 INFORMACE O ZKOUŠENÉ LÁTCE
Chemikálie musí být analytické čistoty.
Doporučuje se použití radioizotopově neznačených
zkoušených látek se známým složením a alespoň 95%
čistotou, nebo zkoušených látek značených
radioizotopy, které mají známé složení a jsou
radioizotopově čisté. U stopovačů s krátkým
poločasem rozpadu musí být provedena korekce na
rozpad.
Před prováděním zkoušek adsorpcedesorpce by měly
být o zkoušené látce známy tyto informace:
a) rozpustnost ve vodě (A.6);
b) tlak par (A.4) a/nebo Henryho konstanta;
c) abiotický rozklad: hydrolýza jako funkce pH
(C.7);
d) rozdělovací koeficient (A.8);
e) snadná rozložitelnost (C.4) nebo aerobní a
anaerobní transformace v půdě;
f) pKa disociovatelných látek;
g) přímá fotolýza ve vodě (tj. UVVis absorpční
spektrum ve vodě, kvantový výtěžek) a
fotodegradace v půdě.
XVIII.1.6 POUŽITELNOST ZKOUŠKY
Zkouška je použitelná u látek, pro něž existuje
analytická metoda s dostatečnou správností.
Důležitým parametrem, který může ovlivnit
spolehlivost výsledku, zejména při nepřímé
metodě, je stálost zkoušené látky po celou dobu
zkoušky. Je tedy nezbytné ověřit stabilitu
v předběžné studii; je-li v průběhu zkoušky
pozorována transformace látky, doporučuje se, aby
byla v hlavní studii provedena analýza jak půdní,
tak vodné fáze.
Obtíže mohou nastat při provádění této zkoušky u
látek s nízkou rozpustností ve vodě (Sv < 10-4
g*l
-1
) a rovněž u silně nabitých látek v důsledku
toho, že koncentraci ve vodné fázi nelze změřit
s dostatečnou správností. V těchto případech musí
být podniknuty další kroky. Doporučení pro řešení
těchto problémů je uvedeno v příslušných částech
této metody. Při zkoušení těkavých látek je třeba dbát na to,
aby nedošlo v průběhu studie ke ztrátám.
XVIII.1.7 POPIS METODY
XVIII.1.7.1 Přístroje, pomůcky a reakční činidla
Standardní laboratorní vybavení, zejména:
a) Zkumavky nebo nádoby pro provedení
experimentů. Je důležité, aby tyto zkumavky
nebo nádoby
— patřily k centrifuze, aby se minimalizovaly
nepřesnosti v důsledku manipulace a
přenášení,
— byly z inertního materiálu, který
minimalizuje adsorpci zkoušené látky na
jejich stěnách.
b) Mísicí zařízení: překlápěcí mísič nebo
rovnocenné zařízení; mísič musí v průběhu
mísení udržovat půdu v suspenzi.
c) Centrifuga: nejlépe vysokootáčková, např.
s odstředivým zrychlením > 3 000 g,
s nastavením teploty, schopná odstředit
z vodného roztoku částice o průměru větším
než 0,2 µm. Kyvety by měly být během třepání
a centrifugace opatřeny víčky, aby nedošlo ke
ztrátám těkavých látek a vody; aby se
minimalizovala adsorpce na víčkách, použijí
se víčka z neadsorbujících materiálů, např.
víčka se závitem potažená teflonem.
d) Volitelné: filtrační zařízení; filtry o
velikosti pórů 0,2 µm, sterilní, na jedno
použití. Zvláštní pozornost by měla být
věnována volbě filtračního materiálu, aby na
něm nedošlo k žádným ztrátám zkoušené látky;
u špatně rozpustných zkoušených látek se
organický filtrační materiál nedoporučuje.
e) Analytické přístroje vhodné pro měření
koncentrace zkoušené látky.
f) Laboratorní sušárna umožňující udržovat
teplotu od 103 st.C do 110 st.C.
XVIII.1.7.2 Charakterizace a výběr půd
Půdy by měly být charakterizovány třemi
parametry, které jsou považovány za
nejdůležitější pro adsorpční kapacitu: obsahem
organického uhlíku, obsahem jílu a půdní texturou
a hodnotou pH. Jak již bylo uvedeno, (viz oddíl
Použití), mohou mít vliv na další
adsorpci/desorpci určité látky fyzikálněchemické
charakteristiky půdy a měly by být v takových
případech zohledněny.
Metody použité pro charakterizaci půdy jsou velmi
důležité a mohou významně ovlivnit výsledky.
Doporučuje se tedy, aby bylo podle odpovídající
metody ISO (ISO103901) pH měřeno v 0,01M CaCl
2
(jde o roztok použitý při zkoušení
adsorpce/desorpce). Doporučuje se rovněž, aby
byly ostatní důležité půdní charakteristiky
stanoveny standardními metodami (např. ISO
„Handbook of Soil Analysis“); to umožní, aby byla
analýza sorpčních dat založena na mezinárodně
standardizovaných půdních parametrech. Některé
existující standardní metody analýzy a
charakterizace půdy jsou uvedeny v literatuře (50
– 52). Ke kalibraci metod zkoušení půd se
doporučují referenční půdy. Návod pro výběr půd pro adsorpční/desorpční
experimenty je uveden v tabulce 1. Sedm vybraných
druhů půd pokrývá půdní druhy vyskytující se
v mírném zeměpisném pásmu. V případě
disociovatelných zkoušených látek by měly vybrané
půdy pokrývat širokých rozsah pH, aby bylo možné
hodnotit adsorpci látky v její disociované a
nedisociované formě. Návod k volbě počtu různých
půd, které mají být použity v jednotlivých
stádiích zkoušky, je uveden v bodě 1.9. Provedení
zkoušky.
Upřednostňujíli se jiné druhy půd, měly by být
charakterizovány stejnými parametry a jejich
charakteristiky by se měly pohybovat ve stejném
rozpětí jako v tabulce 1, třebaže kritériím
neodpovídají přesně.
Tabulka 1: Návod pro výběr půdních vzorků pro
adsorpci/desorpci
------------------------------------------------------------------ ------------------------------------
Druh půdy Rozsah pH (v 0,01M Obsah organického uhlíku Obsah jílu Textura půdy1
CaCl2) (%) (%)
------------------------------------------------------------------ ------------------------------------
1 4,5 - 5,5 1,0 - 2,0 65 - 80 jíl
2 > 7,5 3,5 - 5,0 20 - 40 jílovitohlinitá
3 5,5 - 7,0 1,5 - 3,0 15 - 25 prachovitohlinitá
4 4,0 - 5,5 3,0 - 4,0 15 - 30 hlinitá
5 < 4,0 - 6,0 2 < 0,5 - 1,5 2, 3 < 10 - 15 2 hlinitopísčitá
6 > 7,0 < 0,5 - 1,0 2, 3 40 - 65 jílovitohlinitá/jíl
7 < 4,5 > 10 < 10 písek/hlinitopísčitá
------------------------------------------------------------------ ------------------------------------
1 Podle FAO a severoamerického systému (85).
2 Hodnoty jednotlivých parametrů by měly pokud
možno ležet v uvedeném rozsahu. Vyskytnouli
se obtíže při hledání vhodného půdního
materiálu, jsou přijatelné hodnoty ležící pod
uvedeným minimem.
3 U půd s obsahem organického uhlíku nižším než
0,3 % může být porušena korelace mezi obsahem
organického uhlíku a adsorpcí. Doporučují se
tedy půdy s minimálním obsahem organického
uhlíku 0,3 %.XVIII.1.7.3 Sběr a uchovávání půdních vzorků
XVIII.1.7.3.1 Sběr
Není doporučena žádná specifická technika odběru
vzorků; technika odběru závisí na účelu studie
(53, 54, 55, 56, 57, 58).
Je třeba zohlednit:
a) nezbytné jsou informace o historii lokality;
zahrnují informace o lokalitě, vegetaci,
použití pesticidů nebo hnojiv, o biologických
vnosech nebo náhodné kontaminaci. Pokud jde o
popis místa odběru, měla by být dodržena
doporučení normy ISO o vzorkování půd
(ISO 10381-6);
b) místo odběru musí být definováno souřadnicemi
UTM (Universal Transversal Mercator-
Projection/European Horizontal Datum) nebo
zeměpisnými souřadnicemi; to by mohlo umožnit
opakovaný odběr dané půdy v budoucnu nebo
usnadnit definování půdy podle různých
klasifikačních systémů používaných v různých
zemích. Kromě toho by měla být vzorkován
pouze horizont A do maximální hloubky 20 cm.
Zvláště jeli u půdního druhu č. 7 součástí
půdy horizont 0
h
, měl by být zahrnut do
vzorkování. Půdní vzorky by měly být přepravovány
v kontejnerech a za teploty, jež zaručí, že
nedojde k výrazné změně původních charakteristik
půdy.
XVIII.1.7.3.2 Uchovávání
Přednost se dává se použití čerstvě odebraných
půd. Pouze neníli to možné, mohou být půdy
uchovávány při teplotě okolí, případně vysušené
na vzduchu. Pro dobu uchovávání neexistuje žádný
doporučený limit, ale půdy uchovávané déle než
tři roky by měly být před použitím analyzovány na
obsah organického uhlíku, pH a CEC (kationtovou
výměnnou kapacitu).
XVIII.1.7.3.3 Zpracování půdních vzorků a jejich příprava
ke zkoušce
Půdy se vysuší na vzduchu při teplotě okolí
(nejlépe při 20 – 25 st.C). Rozrušení půd se
provede minimální silou, aby se původní textura
půdy změnila co nejméně. Půdy se prosejí na sítu
=< 2 mm; při prosévání by měla být dodržována
doporučení normy ISO (ISO 10381-6). Doporučuje se
opatrná homogenizace, neboť zlepšuje
reprodukovatelnost výsledků. Vlhkost každé půdy
se stanoví na třech dílčích vzorcích zahříváním
na 105 st.C, dokud se významně mění hmotnost
(přibližně 12 h). Ve všech výpočtech je hmotností
půdy hmotnost po sušení (sušina), tj. hmotnost
půdy korigovaná na obsah vlhkosti.
XVIII.1.7.4 Příprava zkoušené látky pro aplikaci na půdu
Zkoušená látka se rozpustí v 0,01M roztoku CaCl
2
v destilované nebo deionisované vodě; roztok
CaCl2
se použije jako vodná rozpouštědlová fáze
ke zlepšení centrifugace a minimalizaci
kationtové výměny. Koncentrace zásobního roztoku
by měla být nejlépe o tři řády vyšší než mez
stanovitelnosti použité analytické metody. Tento
práh zabezpečuje přesnost měření s ohledem na
metodiku, jež je základem tohoto postupu; kromě
toho by měla být koncentrace zásobního roztoku
pod rozpustností zkoušené látky ve vodě.
Zásobní roztok se připravuje nejlépe těsně před
aplikací na půdní vzorky a uchovává se uzavřený
v temnu při 4 st.C. Skladovatelnost závisí na
stálosti zkoušené látky a na její koncentraci
v roztoku.
Pouze u špatně rozpustných látek (Sv < 10-4
g*l
-1
) může být nezbytné použít solubilizační
činidlo, jeli obtížné zkoušenou látku rozpustit.
Solubilizační činidlo: a) by mělo být mísitelné
s vodou, např. methanol nebo acetonitril, b) jeho
koncentrace by neměla překročit 1 % celkového
objemu zásobního roztoku a ještě méně by ho mělo
být v roztoku přicházejícím do kontaktu s půdou
(nejlépe v koncentraci nižší než 0,1 %), a
c) nemělo by být surfaktantem nebo by nemělo
podléhat solvolytickým reakcím se zkoušenou
chemickou látkou. Použití solubilizačního činidla
by mělo být uvedeno a odůvodněno v přehledu dat.
Jinou možností u špatně rozpustných látek je
jejich přimíchání do systému (spiking): zkoušená
látka se rozpustí v organickém rozpouštědle a
alikvot se přidá do směsi půdy a 0,01M roztoku
CaCl2
v destilované nebo deionisované vodě. Obsah
organického rozpouštědla ve vodné fázi by měl být
co nejnižší a obvykle by neměl překročit 0,1 %.
Nedostatkem přimíchání v organickém rozpouštědle
je nereprodukovatelnost objemu. To může znamenat
zanesení další nepřesnosti, neboť koncentrace
zkoušené látky a spolurozpouštědla nebývají ve
všech zkouškách tytéž.XVIII.1.8 PŘEDPOKLADY PRO PROVEDENÍ ZKOUŠKY
ADSORPCE/DESORPCE
XVIII.1.8.1 Analytická metoda
Klíčovými parametry, které mohou mít vliv na
správnost měření sorpce, jsou správnost metody
analýzy jak roztoku, tak adsorbované fáze,
stálost a čistota zkoušené látky, dosažení
sorpční rovnováhy, velikost změny koncentrace
v roztoku, poměr půda/roztok a změny v půdní
struktuře během ustavování rovnováhy (35,
59 – 62). Některé příklady týkající se
problematiky správnosti jsou uvedeny v dodatku 2.
Spolehlivost použité analytické metody musí být
ověřována při koncentracích, které se mohou
vyskytnout v průběhu zkoušky. Je na
experimentátorovi, aby vyvinul vhodnou metodu
s náležitou správností, přesností,
reprodukovatelností, mezí stanovitelnosti a
výtěžkem. Návodem k provedení takové zkoušky je
níže uvedený experiment.
Vhodný objem 0,01M CaCl
2
, např. 100 cm3
, se
protřepává 4 h s např. 20 g půdy o vysoké
adsorpční schopnosti, tj. s vysokým obsahem
organického uhlíku a jílu; tato hmotnost a objem
se mohou měnit podle požadavků analýzy, avšak
poměr půda/roztok 1:5 je vhodnou výchozí
hodnotou. Směs se odstředí a vodnou fázi lze
zfiltrovat. K vodné fázi se přidá určitý objem
zásobního roztoku zkoušené látky, aby bylo
dosaženo nominální hodnoty v koncentračním
rozsahu, který se může vyskytnou v průběhu
zkoušky. Tento objem by neměl překročit 10 %
konečného objemu vodné fáze, aby byl charakter
roztoku před ustavením rovnováhy změněn co
nejméně. Roztok se analyzuje.Založí se jeden slepý pokus s půdou a roztokem
CaCl
2
(bez zkoušené látky) s cílem odhalit
náhodné chyby analytické metody a matricové jevy
způsobené půdou.Mezi analytické metody, které mohou být použity
v sorpčních měřeních, patří plynová
chromatografie s kapalnou stacionární fází,
(GLC), vysokoúčinná kapalinová chromatografie
(HPLC), spektrometrie (např. GC/hmotnostní
spektrometrie, HPLC/hmotnostní spektrometrie) a
kapalinová scintilační spektrometrie (pro látky
značené radioizotopy). Bez ohledu na použitou
analytickou metodu se za přiměřené považují
výtěžky od 90 % do 110 % nominální hodnoty. Máli
být možné provést stanovení a zhodnocení poté, co
dojde k rozdělení, musí být meze stanovitelnosti
analytické metody alespoň o dva řády nižší než
nominální koncentrace.
Charakteristiky a meze stanovitelnosti analytické
metody použitelné pro provedení studií adsorpce
hrají významnou roli při definování zkušebních
podmínek a při celém experimentálním provedení
zkoušky. Tato metoda sleduje obecný
experimentální postup a obsahuje doporučení a
pokyny pro alternativní řešení, jsouli
analytická metoda a laboratorní vybavení omezeny.
XVIII.1.8.2 Výběr optimálních poměrů půda/roztok
Výběr vhodných poměrů půda/roztok pro sorpční
studie závisí na distribučním koeficientu Kd a na
požadovaném relativním stupni adsorpce. Změna
koncentrace látky v roztoku je určující pro
statistickou správnost měření v důsledku formy
adsorpční rovnice a omezení analytické metodiky
při stanovování koncentrace chemické látky
v roztoku. V obecné praxi je tedy užitečné určit
několik pevných poměrů, pro něž je adsorbovaný
podíl vyšší než 20 %, nejlépe > 50 % (62), a
dbát na to, aby byla koncentrace zkoušené látky
ve vodné fázi dostatečně vysoká pro její správné
změření. To je zvláště důležité u vysokých
adsorbovaných podílů.
Vyhovující přístup k výběru vhodných poměrů
půda/voda je založen na odhadu hodnoty Kd buď
předběžnými studiemi, nebo zavedenými metodami
odhadu (dodatek 3). Vhodný poměr lze poté vybrat
na základě grafického provedení závislosti poměru
půda/roztok na Kd pro daný adsorbovaný podíl
(obrázek 1). V tomto grafickém vyjádření se
předpokládá, že je adsorpční rovnice lineární1.
Použitelný poměr se získá upravením rovnice pro
Kd (4) do tvaru rovnice (1):
V0m0------ = (----------- - 1) Kd(1) mpůdampads(eq) nebo do její logaritmické formy při předpokladu
(2)
Distribuční koeficient Kd(cm3*g-1) Obrázek 1. Vztah mezi poměry půda/roztok a hodnotou Kd při různých adsorbovaných podílech zkoušené látky
Na obrázku 1 jsou uvedeny požadované poměry
půda/roztok jako funkce Kd pro různé úrovně
adsorpce. Například při poměru půda/roztok 1:5 a
při Kd rovno 20 by došlo přibližně k 80%
adsorpci. Máli dojít při téže hodnotě Kd k 50%
adsorpci, musí být použit poměr 1:25. Tento
přístup k výběru vhodných poměrů půda/roztok
umožňuje výzkumníkovi pružně vyhovět
experimentálním potřebám.
Obtíže nastávají v oblastech, kdy se chemická
látka adsorbuje silně nebo velmi slabě. Jeli
adsorpce nízká, doporučuje se poměr půda/roztok
1:1, třebaže u některých vysloveně organických
druhů půdy může být k získání suspenze nezbytný
nižší poměr. Analytická metodika měření malých
změn koncentrace roztoku musí být pečlivá;
v opačném případě bude měření nepřesné. Na druhé
straně se může při velmi vysokých distribučních
koeficientech Kd dospět až k poměru půda/roztok
1:100, máli v roztoku zůstat významné množství
chemické látky. Je však třeba dbát na dobré
promíchání a musí být ponechána dostatečná doba
k tomu, aby systém dosáhl rovnováhy. Jiným
přístupem je v těchto extrémních případech, kdy
chybí vhodná metodika, odhadnutí hodnoty Kd
metodou založenou například na hodnotách Pov
(dodatek 3). Může být užitečný zvláště u slabě
adsorbovaných polárních chemických látek
s Pov < 20 a u lipofilních/silně adsorbovaných
chemických látek s Pov > 104.
XVIII.1.9 PROVEDENÍ ZKOUŠKY
XVIII.1.9.1 Zkušební podmínky
Všechny experimenty se provádějí při teplotě
okolí a pokud možno při konstantní teplotě od
20 st.C do 25 st.C.
Parametry odstřeďování by měly umožnit odstranit
z roztoku částice větší než 0,2 µm. Tuto velikost
mají nejmenší částice považované za pevné částice
a je hranicí mezi pevnými a koloidními částicemi.
Návod ke stanovení parametrů odstřeďování je
uveden v dodatku 4.
Nezaručujeli centrifuga, že budou částice větší
než 0,2 µm odstraněny, mohla by být použita
kombinace odstřeďování a filtrace přes 0,2µm
filtry. Tyto filtry musí být z vhodného inertního
materiálu, aby na nich nedošlo k žádným ztrátám
zkoušené látky. V každém případě by mělo být
ověřeno, že při filtraci nedochází k žádným
ztrátám zkoušené látky.
XVIII.1.9.2 Stupeň 1 – předběžná studie
Účel provedení předběžné studie byl již uveden
v oddíle Použití. Návodem pro založení takové
studie je níže navržený experiment.
XVIII.1.9.2.1 Výběr optimálních poměrů půda/roztok
Použijí se dva půdní druhy a tři poměry
půda/roztok (šest experimentů). Jeden půdní druh
s vysokým obsahem organického uhlíku a nízkým
obsahem jílu a druhý půdní druh s nízkým obsahem
organického uhlíku a vysokým obsahem jílu. Jsou
navrženy následující poměry půda/roztok:
— 50 g půdy a 50 cm
3
vodného roztoku zkoušené
látky (poměr 1/1), — 10 g půdy a 50 cm
3
vodného roztoku zkoušené
látky (poměr 1/5), — 2 g půdy a 50 cm
3
vodného roztoku zkoušené
látky (poměr 1/25). Minimální množství půdy, se kterým lze experiment
provést, závisí na laboratorním vybavení a na
účinnostních charakteristikách použitých
analytických metod. Doporučuje se však použít
alespoň 1 g, a nejlépe 2 g, aby zkouška poskytla
spolehlivé výsledky.
Jeden kontrolní vzorek obsahující pouze zkoušenou
látku v 0,01M CaCl
2
(bez půdy) se podrobí
naprosto stejným krokům jako zkušební systémy,
s cílem ověřit stálost zkoušené látky v roztoku
CaCl2
a její možnou adsorpci na stěnách zkušební
nádoby. Stejnému zkušebnímu postupu se podrobí slepý
vzorek s každou půdou a celkem 50 cm
3
0,01M
roztoku CaCl2
(bez zkoušené látky). Účelem je
kontrola pozaďových hodnot během analýzy s cílem
detekovat interferující látky nebo rozeznat
kontaminované půdy. Všechny experimenty včetně kontrolních a slepých
vzorků se provedou alespoň dvojmo. Celkový počet
vzorků, které by měly být pro studii připraveny,
lze odvodit z metodiky, podle které bude
postupováno.
Metody pro předběžnou studii a hlavní studii jsou
zpravidla stejné, výjimky jsou podle potřeby
uvedeny.
Vzorky vysušené na vzduchu se den před
experimentem uvedou přes noc (12 h) do rovnováhy
protřepáváním s 45 cm
3
0,01M CaCl2
. Poté se
určitým objemem zásobního roztoku zkoušené látky
upraví konečný objem na 50 cm3
. Tento objem
přidaného zásobního roztoku: a) by neměl být
vyšší než 10 % konečného objemu 50 cm3
vodné
fáze, aby byl charakter roztoku před ustavením
rovnováhy změněn co nejméně; a b) měl by
zajistit, že bude počáteční koncentrace zkoušené
látky v kontaktu s půdou (C0) alespoň o dva řády
vyšší než mez stanovitelnosti analytické metody;
tento práh zabezpečuje možnost provést přesné
měření i při vysoké adsorpci (> 90 %) a
později stanovit adsorpční izotermy. Doporučuje
se rovněž, aby počáteční koncentrace látky (C0)
pokud možno nepřekračovala polovinu hodnoty
rozpustnosti látky.Příklad výpočtu koncentrace zásobního roztoku
látky (Czás) je uveden níže. Předpokládá se mez
stanovitelnosti 0,01 µg*cm
-3
a 90% adsorpce;
počáteční koncentrace zkoušené látky v kontaktu
s půdou by tedy měla být nejlépe 1 µg*cm-3
(o dva
řády vyšší, než je mez stanovitelnosti). Za
předpokladu, že bude přidán maximální doporučený
objem zásobního roztoku, tj. 5 cm3
do 45 cm3
0,01M roztoku CaCl2
pro ustavení rovnováhy,
(= 10% přídavek zásobního roztoku v celkovém
objemu vodné fáze 50 cm3
), by měla být
koncentrace zásobního roztoku 10 µg*cm-3
; je o
tři řády vyšší než mez stanovitelnosti analytické
metody.Hodnota pH vodné fáze se měří před kontaktem
s půdou a po něm, neboť hraje významnou roli
v celém adsorpčním procesu, zvláště u
disociujících látek.
Směs se protřepává, dokud se neustaví adsorpční
rovnováha. Doba nezbytná k dosažení rovnováhy
v půdě silně kolísá v závislosti na chemické
látce a půdě; zpravidla stačí 24 h (77).
V předběžné studii lze vzorky odebírat postupně
v průběhu míchání po 48 h (například 4, 8, 24,
48 h). Čas analýzy by měl být volen pružně
s ohledem na pracovní plán laboratoře.
Existují dvě možnosti, jak provádět analýzu
zkoušené látky ve vodném roztoku: a) paralelní
metoda a b) sériová metoda. Je třeba zdůraznit,
že ačkoli je paralelní metoda experimentálně
náročnější, je její matematické zpracování
jednodušší (dodatek 5). Volba metodiky, podle
které bude postupováno, se však ponechává na
experimentátorovi, který bude muset zvážit
dostupné laboratorní vybavení a prostředky.
a) Paralelní metoda: pro každý poměr půda/roztok
se připraví tolik vzorků, kolik bude časů,
v nichž se má provést vyšetření adsorpční
kinetiky. Po centrifugaci a podle požadavku
po filtraci se z první zkušební nádoby
odebere pokud možno celá vodná fáze a měří se
např. po 4 h; vodná fáze druhé zkušební
nádoby se takto zpracuje a změří po 8 h,
vodná fáze třetí zkušební nádoby se takto
zpracuje a změří po 24 h atd.
b) Sériová metoda: pro každý poměr půda/roztok se
připraví pouze dva vzorky. V definovaných
časových intervalech se směs zcentrifuguje a
fáze se oddělí. Malý podíl vodné fáze se
ihned analyzuje na zkoušenou látku;
v experimentu se poté pokračuje s původní
směsí. Následujeli po centrifugaci filtrace,
měla by mít laboratoř zařízení pro filtraci
malých podílů vodné fáze. Doporučuje se, aby
celkový objem odebraného podílu nepřesahoval
1 % celkového objemu roztoku, aby se významně
nezměnil poměr půda/roztok a aby se nesnížilo
množství rozpuštěné látky dostupné během
zkoušky pro adsorpci.
Procento adsorpce se pro každý čas (ti) vypočte
z nominální počáteční koncentrace a naměřené
koncentrace v odběrovém čase (ti) po korekci na
hodnoty ze slepého pokusu. Sestrojí se křivky
závislosti na čase (obrázek 1 v dodatku 5) za
účelem odhadu míry dosažení rovnovážného plató2.
Rovněž se vypočte hodnota Kd v rovnováze. Na
základě této hodnoty Kd se z obrázku 1 vyberou
vhodné poměry půda/roztok tak, aby adsorpce
dosahovala více než 20 % a nejlépe více než 50 %
(61). Všechny příslušné rovnice a zásady pro
sestrojování křivek jsou uvedeny v oddíle Data a
zprávy a v dodatku 5.
XVIII.1.9.2.2 Stanovení rovnovážného adsorpčního času a
množství zkoušené látky adsorbovaného v rovnováze
Jak již bylo uvedeno, umožňuje křivka závislosti
nebo na čase odhadnout dobu nezbytnou pro
dosažení adsorpční rovnováhy a adsorbované
množství zkušební látky v rovnováze. Příklady
těchto křivek jsou na obrázcích 1 a 2
v dodatku 5. Rovnovážný čas je čas nezbytný
k tomu, aby bylo v systému dosaženo plató.
Nevyskytujeli se u určité půdy plató, ale
nepřetržitý nárůst, může to být způsobeno
komplikujícími faktory, jako jsou biologický
rozklad a pomalá difuse. Biologický rozklad lze
prokázat opakováním experimentu se sterilizovaným
vzorkem půdy. Neníli ani v tomto případě
dosaženo plató, měl by experimentátor pátrat po
jiném jevu, ke kterému by mohlo při jeho studiích
docházet; může tak učinit vhodnou změnou
experimentálních podmínek (teploty, doby
protřepávání, poměrů půda/roztok). Ponechává se
na rozhodnutí experimentátora, zda bude
pokračovat ve zkušebním postupu i přes případné
nedosažení rovnováhy.
XVIII.1.9.2.3 Adsorpce na stěnách zkušební nádoby a
stálost zkoušené látky
Některé informace o adsorpci zkoušené látky na
stěnách zkušební nádoby a rovněž o stálosti
zkoušené látky lze odvodit z analýzy kontrolních
vzorků. Pozorujeli se úbytek větší, než by
odpovídalo obvyklé chybě analytické metody, může
docházet k abiotickému rozkladu a/nebo adsorpci
na stěnách zkušební nádoby. Tyto dva jevy lze
rozlišit důkladným omytím stěn nádoby známým
objemem vhodného rozpouštědla a analýzou výplachu
na zkoušenou látku. Neníli zjištěna adsorpce na
stěnách zkušební nádoby, je úbytek důkazem
abiotické nestálosti zkoušené látky. Jeli
zjištěna adsorpce, je nezbytné změnit materiál
zkušebních nádob. Data o adsorpci na stěnách
zkušebních nádob získaná v tomto experimentu však
nelze přímo extrapolovat na experiment
půda/roztok. Přítomnost půdy bude mít na tuto
adsorpci vliv.
Další informace o stálosti zkoušené látky lze
odvodit z množstevní bilance výchozí látky
provedené po určitém čase. To znamená, že se na
zkušenou látku analyzují vodná fáze, extrakty
půdy a stěny zkušební nádoby. Rozdíl mezi
množstvím přidané zkoušené látky a součtem
množství zkoušené látky ve vodné fázi,
v extraktech půdy a na stěnách zkušební nádoby je
roven množství, které se rozložilo, vytěkalo
a/nebo se neextrahovalo. Má-li být provedena
množstevní bilance, mělo by být v době
experimentu dosaženo adsorpční rovnováhy.
Množstevní bilance se provede u obou druhů půd a
pro jeden poměr půda/roztok u každé půdy, u něhož
je úbytek v rovnováze větší než 20 % a nejlépe
větší něž 50 %. Jeli experiment pro nalezení
poměru dokončen analýzou posledního vzorku po
48 hodinách, fáze se oddělí centrifugací a podle
požadavků filtrací. Odebere se pokud možno
veškerá vodná fáze a k půdě se přidá vhodné
extrakční rozpouštědlo (extrakční koeficient
alespoň 95 %) za účelem extrakce zkoušené látky.
Doporučují se alespoň dvě extrakce za sebou.
Stanoví se množství zkoušené látky v půdě a
v extraktech ze zkušební nádoby a provede se
množstevní bilance (rovnice 10, Data a zprávy).
Jeli nižší než 90 %, považuje se zkoušená látka
za nestálou v poměru k délce zkoušky. Studie však
může pokračovat, přičemž se zohlední nestálost
zkoušené látky; v takovém případě se doporučuje,
aby byly v hlavní studii analyzovány obě fáze.
XVIII.1.9.3 Stupeň 2 – adsorpční kinetika při jedné
koncentraci zkoušené látky
Použije se pět druhů půd vybraných z tabulky 1.
Je výhodné zahrnout mezi těchto pět půd některé
nebo všechny půdy z předběžné studie. V tomto
případě nemusí být stupeň 2 opakován pro půdy
použité v předběžné studii.
Rovnovážný čas, poměr půda/roztok, hmotnost
půdního vzorku, objem vodné fáze v kontaktu
s půdou a koncentrace zkoušené látky v roztoku se
volí na základě výsledků předběžné studie.
Analýzy se provádějí nejlépe po 2, 4, 6, 8 (podle
možnosti také po 10) a 24 h kontaktu s půdou;
protřepávání může být prodlouženo až na maximálně
48 h u chemických látek, u nichž je pro dosažení
rovnováhy podle výsledků předběžných studií
nezbytný delší čas. Časy, kdy má být provedena
analýza, lze volit pružně.
Každý experiment (s jednou půdou a s jedním
roztokem) se provede alespoň dvojmo, aby bylo
možné odhadnout rozptyl výsledků. S každým
experimentem se provede slepý pokus. Provede se
s půdou a s 0,01M roztokem CaCl
2
bez zkoušené
látky a se stejnou hmotností a objemem jako
v experimentu. Stejnému zkušebnímu postupu se
podrobí kontrolní vzorek zkoušené látky v 0,01M
roztoku CaCl2
(bez půdy), který slouží jako
pojistka proti nečekaným výsledkům.Procento absorpce se vypočte pro každý čas () a
pro každý interval () (podle potřeby) a vynese se
proti času. Rovněž se vypočtou distribuční
koeficient Kd v rovnováze a adsorpční koeficient
normalizovaný na obsah organického uhlíku Kou
(pro nepolární organické chemické látky).
Výsledky zkoušky adsorpční kinetiky
Pro popis sorpčního chování v půdě je zpravidla
dostatečně přesný lineární model Kd (35, 78),
který je výrazem vlastní mobility chemických
látek v půdě. Například chemické látky s Kd
1 cm
3
*g-1
jsou v zásadě považovány za zcela
mobilní. Podobně byla MacCallem et al (16)
vyvinuto klasifikační schéma mobility založené na
hodnotách Kou. Kromě toho existuje klasifikační
schéma vymývatelnosti založené na vztahu mezi Kou
a DT-50 (1, 32, 79).
Podle studií statistických chyb (61) nelze
z poklesu koncentrace ve vodné fázi přesně
odhadnout hodnoty Kd nižší než 0,3 cm
3
*g-1
, a to
ani při nejpříznivějším (z hlediska správnosti)
poměru půda/roztok, tj. při poměru 1:1. V takovém
případě se doporučuje analýza obou fází – půdy i
roztoku.S ohledem na výše uvedené poznámky se doporučuje
pokračovat ve studii adsorpčního chování chemické
látky v půdě a její případné mobility stanovením
Freundlichových adsorpčních isotherm pro ty
systémy, u nichž je přesné stanovení Kd možné
postupem, popsaným v této zkušební metodě. Přesné
stanovení je možné, jeli součin hodnoty Kd a
poměru půda/roztok > 0,3 při měření založeném
na poklesu koncentrace ve vodné fázi (nepřímá
metoda), nebo je-li > 0,1 při analýze obou
fází (přímá metoda) (61).
XVIII.1.9.4 Stupeň 3 – adsorpční isothermy a desorpční
kinetika/desorpční isothermy
XVIII.1.9.4.1 Adsorpční isothermy
Použije se pět koncentrací zkoušené látky,
nejlépe v rozsahu dvou řádů; při volbě
koncentrací se zohlední rozpustnost ve vodě a
výsledná rovnovážná koncentrace ve vodné fázi.
V průběhu zkoušky se u každé půdy použije tentýž
poměr půda/roztok. Adsorpční zkouška se provede
výše uvedenou metodou pouze s tím rozdílem, že se
vodná fáze analyzuje pouze jednou po uplynutí
doby, která je nezbytná pro dosažení rovnováhy a
která byla stanovena dříve ve stupni 2. Stanoví
se rovnovážné koncentrace v roztoku a adsorbované
množství se vypočte z úbytku zkoušené látky
v roztoku nebo přímou metodou. Adsorbované
množství na jednotku množství půdy se vynese jako
funkce rovnovážné koncentrace zkoušené látky (viz
oddíl Data a zprávy).
Výsledky z experimentu pro stanovení adsorpčních
isotherm
Z dosud navržených matematických modelů
adsorpčních isotherm se k popisu adsorpčních
procesů používá Freundlichova isotherma
nejčastěji. Podrobnější informace o interpretaci
a významu adsorpčních modelů jsou uvedeny
v literatuře (41, 45, 80, 81, 82).
Poznámka: Je třeba poznamenat, že hodnoty KF
(Freundlichových adsorpčních koeficientů) pro
různé látky lze porovnávat pouze tehdy, jsouli
hodnoty KF vyjádřeny ve stejných jednotkách (83).
XVIII.1.9.4.2 Desorpční kinetika
Účelem tohoto experimentu je vyšetřit, zda je
chemická látka adsorbována na půdě vratně nebo
nevratně. Tato informace je důležitá, neboť
desorpční proces hraje také důležitou roli
v chování chemické látky v půdě. Desorpční data
jsou kromě toho užitečným vstupem pro počítačové
modelování vyluhování a pro simulaci vyplavování
rozpuštěných látek. Jeli studie desorpce
požadována, doporučuje se, aby byla níže popsaná
studie provedena na každém systému, na kterém
bylo v předchozím experimentu pro studii
adsorpční kinetiky možné provést přesné stanovení
Kd.
Podobně jako u studie adsorpční kinetiky existují
dvě možnosti, jak postupovat při experimentu pro
studium desorpční kinetiky: a) paralelní metoda a
b) sériová metoda. Volba metodiky, podle které
bude postupováno, se ponechává na
experimentátorovi, který bude muset zvážit
dostupné laboratorní vybavení a prostředky.
a) Paralelní metoda: pro každou půdu zvolenou pro
pokročení do studie desorpce se připraví
tolik vzorků se stejným poměrem půda/roztok,
kolik bude časů, v nichž se má studovat
desorpční kinetika. Zvolí se nejlépe stejné
časové intervaly, jako u experimentu pro
studium adsorpční kinetiky; celkový čas se
však prodlouží podle potřeby, aby v systému
bylo dosaženo rovnováhy. S každým
experimentem (s jednou půdou a s jedním
roztokem) se provede slepý pokus. Provede se
s půdou a s 0,01M roztokem CaCl
2
bez zkoušené
látky se stejnou hmotností a objemem jako
v experimentu. Stejnému zkušebnímu postupu se
podrobí kontrolní vzorek zkoušené látky
v 0,01M roztoku CaCl2
(bez půdy). Všechny
směsi půdy s roztokem se protřepávají do
ustavení adsorpční rovnováhy (která se
zjišťuje postupem uvedeným dříve ve
stupni 2). Poté se fáze oddělí centrifugací a
vodná fáze se pokud možno kvantitativně
odebere. Objem odebraného roztoku se nahradí
stejným objemem 0,01M CaCl2
bez zkoušené
látky a nová směs se opět protřepává.
Kupříkladu po 2 h se pokud možno
kvantitativně odebere a změří vodná fáze
první zkušební nádoby, totéž se provede
s vodnou fází druhé zkušební nádoby po 4 h,
s vodnou fází třetí zkušební nádoby po 6 h
atd., až do dosažení desorpční rovnováhy.b) Sériová metoda: po experimentu pro stanovení
adsorpční kinetiky se směs zcentrifuguje a
vodná fáze se pokud možno kvantitativně
odebere. Objem odebraného roztoku se nahradí
stejným objemem 0,01M CaCl
2
bez zkoušené
látky. Nová směs se protřepává až do ustavení
desorpční rovnováhy. Během této doby se ve
stanovených časových intervalech směs
centrifuguje za účelem oddělení fází. Malý
podíl vodné fáze se ihned analyzuje na
zkoušenou látku; v experimentu se poté
pokračuje s původní směsí. Objem každého
jednotlivého podílu by měl být menší než 1 %
celkového objemu. Ke směsi se přidá stejný
objem čerstvého 0,01M roztoku CaCl2
, aby se
zachoval poměr půda/roztok, a v protřepávání
se pokračuje po další časový interval.Procento desorpce se vypočte pro každý čas () a
pro každý interval () (podle potřeb studie) a
vynese se proti času. Rovněž se vypočte hodnota
desorpčního koeficientu Kdes v rovnováze. Všechny
příslušné rovnice jsou uvedeny v oddíle Data a
zprávy a v dodatku 5.
Výsledky z experimentu pro studium desorpční
kinetiky
Společný graf křivek závislostí procenta desorpce
a adsorpce na čase umožní posoudit vratnost
adsorpčního procesu. Jeli desorpční rovnováhy
dosaženo do dvojnásobku času potřebného pro
adsorpční rovnováhu a jeli celková desorpce
vyšší než 75 % adsorbovaného množství, považuje
se adsorpce za vratnou.
XVIII.1.9.4.3 Desorpční isothermy
Freundlichovy desorpční isothermy se vyšetřují na
půdách použitých ke stanovení adsorpčních
isotherm. Zkouška desorpce se provede způsobem
popsaným v oddíle Desorpční kinetika, pouze s tím
rozdílem, že se vodná fáze analyzuje pouze
jednou, a to v desorpční rovnováze. Vypočte se
desorbované množství zkoušené látky. Množství
zkoušené látky, které zůstalo adsorbované na půdě
po dosažení desorpční rovnováhy se vynese jako
funkce rovnovážné koncentrace zkoušené látky
v roztoku (viz oddíl Data a zprávy a dodatek 5).
XVIII.2 DATA A ZPRÁVY
Data z analýzy se předloží ve formě tabulky (viz
dodatek 6). Uvedou se jednotlivá měření a
vypočtené průměrné hodnoty. Předloží se grafy
adsorpčních isotherm. Výpočty se provedou níže
uvedeným způsobem.
Pro účely zkoušky se předpokládá, že hmotnost
1 cm
3
vodného roztoku je 1 g. Poměr půda/roztok
může být vyjádřen stejným číslem pro rozměr
hmot./hmot. i pro rozměr hmot./obj.XVIII.2.1 ADSORPCE

XVIII.2.1.1 Adsorpční isothermy
Rovnice Freundlichových adsorpčních isotherm
vyjadřují vztah mezi adsorbovaným množstvím
zkoušené látky a koncentrací zkoušené látky
v roztoku v rovnováze (rovnice 8).
Data se zpracovávají jako v oddíle o adsorpci a
pro každou zkušební nádobu se vypočte množství
zkoušené látky adsorbované na půdě po adsorpční
zkoušce (), jinde označeno jako x/m). Předpokládá
se, že rovnováhy bylo dosaženo a že představuje
rovnovážnou hodnotu:
(7) (8) (9) kde: = Freundlichův adsorpční koeficient; má rozměr cm3*g-1pouze tehdy, jeli 1/n = 1; v ostatních případech se směrnice 1/n projeví v rozměru n = regresní konstanta; 1/n se zpravidla pohybuje od 0,7 do 1,0, což znamená, že jsou sorpční data často nelineární. Rovnice (8) a (9) se vyjádří graficky a hodnoty a 1/n se zjistí regresní analýzou s ohledem na rovnici 9. Vypočte se rovněž korelační koeficient r2proložení logaritmické rovnice. Příklad takové křivky je uveden na obrázku 2.
Obrázek 2 Freundlichovy adsorpční křivky, normální a linearizovaná forma
XVIII.2.1.2 Hmotnostní bilance
Hmotnostní bilance (MB) je definována jako
procentuální podíl látky z nominálního množství
látky na začátku zkoušky, který lze znovu
analyticky vyzískat po adsorpční zkoušce.
Zpracování dat se bude lišit podle toho, zda je
rozpouštědlo neomezeně mísitelné s vodou.
V případě rozpouštědel mísitelných s vodou mohou
být data zpracována pro stanovení množství látky
znovu získané extrakcí rozpouštědlem stejným
způsobem, jako v oddíle o desorpci. Jeli
rozpouštědlo mísitelné s vodou omezeně, musí být
provedeno stanovení množství znovu získané látky.
Hmotnostní bilance pro adsorpci se vypočte níže
uvedeným způsobem; jako mE se označí součet
množství zkušební látky extrahovaných organickým
rozpouštědlem z půdy a ze stěn zkušební nádoby:
(V
rec
. Cvod
ads
(eq) + mE
) . 100
MB = ---------------------------------------- % (10)
V0
. C0
kde:
MB = hmotnostní bilance (%)
mE
= celkové množství zkoušené látky
extrahované z půdy a ze stěn
zkušební nádoby ve dvou krocích
(µg)
C0
= počáteční hmotnostní koncentrace
zkušebního roztoku v kontaktu
s půdou (µg*cm-3
)
Vrec
= objem supernatantu vyzískaný po
dosažení adsorpční rovnováhy (cm-3
)XVIII.2.2 DESORPCE
Desorpce (D) je definována jako podíl zkušební
látky z dříve adsorbovaného množství, který se za
zkušebních podmínek desorboval:
(11)
Podrobné informace o způsobu výpočtu procenta
desorpce Dt pro paralelní a sériovou metodu jsou
uvedeny v dodatku 5.
Zdánlivý desorpční koeficient (K
des
) je za
zkušebních podmínek poměr mezi množstvím zkoušené
látky, která zůstala v půdě a hmotnostní
koncentrací desorbované látky ve vodném roztoku
po dosažení desorpční rovnováhy:
(12)
Návod pro výpočet hodnoty je uveden v dodatku 5
v oddíle o desorpci.
Poznámka:
Provede-li se předcházející adsorpční zkouška
paralelní metodou, je objem VT v rovnici 12 roven
V0.
XVIII.2.2.1 Desorpční isothermy
Rovnice Freundlichových desorpčních isotherm
vyjadřují vztah mezi množstvím zkoušené látky,
které zůstalo adsorbované na půdě a koncentrací
zkoušené látky v roztoku v desorpční rovnováze
(rovnice 16).
Pro každou zkušební nádobu se množství zkoušené
látky, které zůstalo v desorpční rovnováze
adsorbované na půdě, vypočte takto:

(13)
(14)
(15)
(16)
(17)
Rovnice 16 a 17 se vyjádří graficky a hodnoty K
F
des
a
1/n se zjistí regresní analýzou s ohledem na
rovnici 17. Poznámka:
Jeli Freundlichův adsorpční nebo desorpční
exponent 1/n roven 1, bude Freundlichova
adsorpční nebo desorpční konstanta (KF ads a KF
des) rovna adsorpční resp. desorpční rovnovážné
konstantě (Kd resp. Kdes) a křivky závislosti Cs
na Caq budou lineární. Nejsouli exponenty
rovny 1, křivky závislosti Cp na Cvod budou
nelineární a adsorpční a desorpční konstanty se
budou podél isotherem lišit.
XVIII.2.2.2 Zpráva o zkoušce
Protokol o zkoušce by měl obsahovat následující
informace:
— úplná identifikace použitých půdních vzorků
včetně:
— zeměpisné informace o lokalitě (zeměpisná
šířka, zeměpisná délka),
— datum odběru vzorku,
— využití půdy (např. zemědělská půda, lesní
půda atd.),
— hloubka odběru vzorků,
— obsah písku/prachových částic/jílu,
— pH (v 0,01M CaCl
2
) — obsah organického uhlíku,
— obsah organického materiálu,
— obsah dusíku,
— poměr C/N,
— kationtová výměnná kapacita (mmol/kg),
— všechny informace týkající se sběru a
uchovávání vzorků,
— podle potřeby všechny informace pro
interpretaci adsorpce/desorpce zkoušené
látky,
— odkaz na metody reference použité pro stanovení
jednotlivých parametrů,
— podle potřeby informace o zkoušené látce,
— teplota při experimentu,
— parametry centrifugace,
— analytický postup použitý při analýze zkoušené
látky,
— odůvodnění jakéhokoli použití solubilizačního
činidla při přípravě zásobního roztoku
zkoušené látky,
— vysvětlení korekcí provedených ve výpočtech,
jeli to důležité,
— data podle formuláře (dodatek 6) a grafická
znázornění,
— všechny informace a pozorování užitečné pro
interpretaci výsledků zkoušky.
XVIII.3 LITERATURA
(1) Kukowski H. and Brümmer G., (1987).
Investigations on the Adsorption and
Desorption of Selected Chemicals in Soils.
UBA Report 106 02 045, Part II.
(2) Fränzle O., Kuhnt G., Vetter L., (1987).
Selection of Representative Soils in the EC-
Territory. UBA Report 106 02 045, Part I.
(3) Kuhnt G., Muntau H. (Eds.) EURO-Soils:
Identification, Collection, Treatment,
Characterisation. Special Publication No
1.94.60, Joint Research Centre. European
Commission, ISPRA, December 1994.
(4) OECD Test Guidelines Programme, Final Report
of the OECD Workshop on Selection of
Soils/Sediments, Belgirate, Italy, 18-20
January 1995 (June 1995).
(5) US Environment Protection Agency: Pesticide
Assessment Guidelines, Subdivision N,
Chemistry: Environmental Fate, Series 163-1,
Leaching and Adsorption/Desorption Studies,
Addendum 6 on Data Reporting, 540/09-88-096,
Date: 1/1988.
(6) US Environment Protection Agency: Prevention,
Pesticides and Toxic Substances, OPPTS
Harmonized Test Guidelines, Series 835-Fate,
Transport and Transformation Test Guidelines,
0PPTS No: 835.1220 Sediment and Soil
Adsorption/Desorption Isotherm. EPA No: 712-C-
96-048, April 1996.
(7) ASTM Standards, E 1195-85, Standard Test
Method for Determining a Sorption Constant
(Kou) for an Organic Chemical in Soil and
Sediments.
(8) Agriculture Canada: Environmental Chemistry
and Fate. Guidelines for registration of
pesticides in Canada, 15 July 1987.
(9) Netherlands Commission Registration
Pesticides (1995): Application for
registration of a pesticide. Section G.
Behaviour of the product and its metabolites
in soil, water and air.
(10) Danish National Agency of Environmental
Protection (October 1988): Criteria for
registration of pesticides as especially
dangerous to health or especially harmful to
the environment.
(11) BBA (1990), Guidelines for the Official
Testing of Plant Protection Products,
Biological Research Centre for Agriculture
and Forestry, Braunschweig, Germany.
(12) Calvet R., (1989), „Evaluation of adsorption
coefficients and the prediction of the
mobilities of pesticides in soils“, in
Methodological Aspects of the Study of
Pesticide Behaviour in Soil (ed. P. Jamet),
INRA, Paris, (Review).
(13) Calvet R., (1980), „Adsorption-Desorption
Phenomena“ in Interactions between herbicides
and the soil. (R. J. Hance ed.), Academic
Press, London, str. 83 – 122.
(14) Hasset J. J., Banwart W.L., (1989), „The
sorption of nonpolar organics by soils and
sediments“ in Reactions and Movement of
Organic Chemicals in Soils. Soil Science
Society of America (S.S.S.A), Special
Publication no. 22, str. 31 – 44.
(15) van Genuchten M. Th., Davidson J. M.,
Wierenga P. J., (1974), „An evaluation of
kinetic and equilibrium equations for the
prediction of pesticide movement through
porous media“. Soil Sci. Soc. Am. Proc., Vol.
38(1), str. 29 – 35.
(16) McCall P. J., Laskowski D. A., Swann R. L.,
Dishburger H. J., (1981), „Measurement of
sorption coefficients of organic chemicals
and their use, in environmental fate
analysis“, in Test Protocols for
Environmental Fate and Movement of Toxicants.
Proceedings of AOAC Symposium, AOAC,
Washington DC.
(17) Lambert S. M., Porter P. E., Schieferrstein
R. H., (1965), „Movement and sorption of
chemicals applied to the soil“. Weeds, 13,
str. 185 – 190.
(18) Rhodes R. C., Belasco I. J., Pease H. L.,
(1970) „Determination of mobility and
adsorption of agrochemicals in soils“.
J. Agric. Food Chem., 18, str. 524 – 528.
(19) Russell M. H., (1995), „Recommended
approaches to assess pesticide mobility in
soil“ in Environmental Behavior of
Agrochemicals (ed. T. R. Roberts, P. C.
Kearney). John Wiley & Sons Ltd. (20) Esser
H. O., Hemingway R. J., Klein W., Sharp D.
B., Vonk J. W., Holland P. T., (1988),
„Recommended approach to the evaluation of
the environmental behavior of pesticides“,
IUPAC Reports on Pesticides (24). Pure Appl.
Chem., 60, str. 901 – 932.
(21) Guth J. A., Burkhard N., D. O. Eberle,
(1976), „Experimental models for studying the
persistence of pesticides in soils“. Proc.
BCPC Symposium: Persistence of Insecticides
and Herbicides, str. 137 – 157, BCPC, Surrey,
UK.
(22) Furminge C. G. L., Osgerby J. M., (1967),
„Persistence of herbicides in soil“. J. Sci.
Fd. Agric., 18, str. 269 – 273.
(23) Burkhard N., Guth J. A., (1981), „Chemical
hydrolysis of 2-Chloro-4,6-bis(alkylamino)-
1,3,5-triazine herbicides and their breakdown
in soil under the influence of adsorption“.
Pestic. Sci. 12, str. 45 – 52.
(24) Guth J. A., Gerber H. R., Schlaepfer T.,
(1977), „Effect of adsorption, movement and
persistence on the biological availability of
soil-applied pesticides“. Proc. Br. Crop
Prot. Conf., 3, str. 961 – 971.
(25) Osgerby J. M., (1973), „Process affecting
herbicide action in soil“. Pestic. Sci., 4,
str. 247 – 258.
(26) Guth J. A., (1972), „Adsorptions- und
Einwascheverhalten von Pflanzenschutzmitteln
in Böden“. Schr. Reihe Ver. Wass. -Boden-
Lufthyg. Berlin-Dahlem, Heft 37,
str. 143 – 154.
(27) Hamaker J. W., (1975), „The interpretation
of soil leaching experiments“, in
Environmental Dynamics of Pesticides (eds R.
Haque, V. H. Freed), str. 135 – 172, Plenum
Press, NY.
(28) Helling C. S., (1971), „Pesticide mobility
in soils“. Soil Sci. Soc. Amer. Proc., 35,
str. 732 – 210.
(29) Hamaker J. W., (1972), „Diffusion and
volatilization“ in Organic chemicals in the
soil environment (C.A.I. Goring and J. W.
Hamaker eds), Vol. I, str. 49 – 143.
(30) Burkhard N., Guth J. A., (1981), „Rate of
volatilisation of pesticides from soil
surfaces; Comparison of calculated results
with those determined in a laboratory model
system“. Pestic. Sci. 12, str. 37 – 44.
(31) Cohen S. Z., Creeger S. M., Carsel R.F.,
Enfield C.G., (1984), „Potential pesticide
contamination of groundwater from
agricultural uses“, in Treatment and Disposal
of Pesticide Wastes, str. 297 – 325, Acs
Symp. Ser. 259, American Chemical Society,
Washington, DC.
(32) Gustafson D. I., (1989), „Groundwater
ubiquity score: a simple method for assessing
pesticide leachability“. J. Environ. Toxic.
Chem., 8(4), str. 339 – 357.
(33) Leistra M., Dekkers W. A., (1976). „Computed
effects of adsorption kinetics on pesticide
movement in soils“. J. Soil Sci., 28,
str. 340 – 350.
(34) Bromilov R. H., Leistra M., (1980),
„Measured and simulated behavior of aldicarb
and its oxydation products in fallow soils“.
Pest. Sci., 11, str. 389 – 395.
(35) Green R. E., Karickoff S. W., (1990),
„Sorption estimates for modeling“, in
Pesticides in the Soil Environment: Process,
Impacts and Modeling (ed. H.H. Cheng). Soil
Sci. Soc. Am., Book Series no. 2,
str. 80 – 101,
(36) Lambert S. M., (1967), „Functional
relationship between sorption in soil and
chemical structure“. J. Agri. Food Chem., 15,
str. 572 – 576.
(37) Hance R. J., (1969), „An empirical
relationship between chemical structure and
the sorption of some herbicides by soils“. J.
Agri. Food Chem., 17, str. 667 – 668.
(38) Briggs G. G. (1969), „Molecular structure of
herbicides and their sorption by soils“.
Nature, 223, 1288. (39) Briggs G. G. (1981).
„Theoretical and experimental relationships
between soil adsorption, octanol-water
partition coefficients, water solubilities,
bioconcentration factors, and the parachor“.
J. Agric. Food Chem., 29, str. 1050 – 1059.
(40) Sabljic A., (1984), „Predictions of the
nature and strength of soil sorption of
organic polutance by molecular topology“.
J. Agric. Food Chem., 32, str. 243 – 246.
(41) Bailey G. W., White J. L., (1970), „Factors
influencing the adsorption, desorption, and
movement of pesticides in soil“. Residue
Rev., 32, str. 29 – 92.
(42) Bailey G. W., J. L. White, Y. Rothberg.,
(1968), „Adsorption of organic herbicides by
montomorillonite: Role of pH and chemical
character of adsorbate“. Soil Sci. Soc. Amer.
Proc. 32: str. 222 – 234.
(43) Karickhoff S. W., (1981), „Semi-empirical
estimation of sorption of hydrophobic
pollutants on natural sediments and soils“.
Chemosphere 10, str. 833 – 846.
(44) Paya-Perez A., Riaz M., Larsen B., (1989),
„Soil Sorption of 6 Chlorobenzenes and 20 PCB
Congeners“. Environ. Toxicol. Safety 21,
str. 1 – 17.
(45) Hamaker J. W., Thompson J. M., (1972),
„Adsorption in organic chemicals“ in Organic
Chemicals in the Soil Environment (Goring
C. A. I., Hamaker J. W., eds), Vol I and II,
Marcel Dekker, Inc., New York, NY, 1972,
str. 49 – 143.
(46) Deli J., Warren G. F., 1971, „Adsorption,
desorption and leaching of diphenamid in
soils“. Weed Sci. 19: str. 67 – 69.
(47) Chu-Huang Wu, Buehring N., Davinson J. M.,
Santelmann, (1975), „Napropamide Adsorption,
desorption and Movement in soils“. Weed Sci.,
Vol. 23, str. 454 – 457.
(48) Haues M. H. B., Stacey M., Thompson J. M.,
(1968), „Adsorption of s-triazine herbicides
by soil organic preparations“ in Isotopes and
Radiation in Soil Organic Studies, p.75,
International. Atomic Energy Agency, Vienna.
(49) Pionke H. B., Deangelis R. J., (1980),
„Methods for distributing pesticide loss in
field run-off between the solution and
adsorbed phase“, CREAMS, in A Field Scale
Model for Chemicals, Run-off and Erosion from
Agricultural Management Systems, Chapter 19,
Vol. III: Supporting Documentation, USDA
Conservation Research report.
(50) ISO Standard Compendium Environment: Soil
Quality – General aspects; chemical and
physical methods of analysis; biological
methods of analysis. First Edition (1994).
(51) Scheffer F., Schachtschabel, Lehrbuch der
Bodenkunde, F. Enke Verlag, Stuttgart (1982),
11th edition.
(52) Black, Evans D. D., White J. L., Ensminger
L. E., Clark F. E., eds. „Methods of Soil
Analysis“, Vol 1 a 2, American Society of
Agronomy, Madison, WI, 1982.
(53) ISO/DIS 10381-1 Soil Quality — Sampling —
Part 1: Guidance on the design of sampling
programmes.
(54) ISO/DIS 10381-2 Soil Quality — Sampling —
Part 2: Guidance on sampling techniques.
(55) ISO/DIS 10381-3 Soil Quality — Sampling —
Part 3: Guidance on safety of sampling.
(56) ISO/DIS 10381-4 Soil Quality — Sampling —
Part 4: Guidance on the investigation of
natural and cultivated soils.
(57) ISO/DIS 10381-5 Soil Quality — Sampling —
Part 5: Guidance on the investigation of soil
contamination of urban and industrial sites.
(58) ISO 10381-6, 1993: Soil Quality — Sampling —
Part 6: Guidance on the collection, handling
and storage of soil for the assessment of
aerobic microbial processes in the
laboratory.
(59) Green R. E., Yamane V. K., (1970),
„Precision in pesticide adsorption
measurements“. Soil Sci. Am. Proc., 34,
str. 353 – 354.
(60) Grover R., Hance R. J. (1970), „Effect of
ratio of soil to water on adsorption of
linuron and atrazine“. Soil Sci.,
str. 109 – 138.
(61) Boesten, J. J. T. I, „Influence of
soil/liquid ratio on the experimental error
of sorption coefficients in pesticide/soil
system“. Pest. Sci. 1990, 30, str. 31 – 41.
(62) Boesten, J. J. T. I. „Influence of
soil/liquid ratio on the experimental error
of sorption coefficients in relation to OECD
guideline 106„. Proceedings of 5th
international workshop on environmental
behaviour of pesticides and regulatory
aspects, Brussels, 26 – 29 April 1994.
(63) Bastide J., Cantier J. M., et Coste C.,
(1980), „Comportement de substances
herbicides dans le sol en fonction de leur
structure chimique“. Weed Res. 21,
str. 227 – 231.
(64) Brown D. S., Flagg E. W., (1981), „Empirical
prediction of organic pollutants sorption in
natural sediments“. J. Environ.Qual., 10(3),
str. 382 – 386.
(65) Chiou C. T., Porter P. E., Schmedding D. W.,
(1983), „Partition equilibria of non-ionic
organic compounds between soil organic matter
and water“. Environ. Sci. Technol., 17(4),
str. 227 – 231.
(66) Gerstl Z., Mingelgrin U., (1984), „Sorption
of organic substances by soils and
sediments“. J. Environ. Sci. Health, B19 (3),
str. 297 – 312.
(67) Vowles P. D., Mantoura R. F. C., (1987),
„Sediment-water partition coefficient and
HPLC retention factors of aromatic
hydrocarbons“. Chemosphere, 16(1),
str. 109 – 116.
(68) Lyman W. J., Reehl W. F.and Rosenblatt D. H.
(1990). Handbook of Chemical Property
Estimation Methods. Environmental Behaviour
of Organic Compounds. American Chemical
Society, Washington DC.
(69) Keniga E. E., Goring, C. A. I. (1980).
„Relationship between water solubility, soil
sorption, octanol-water partitioning and
concentration of chemicals in the biota“ in
Aquatic Toxicology (eds J.G. Eaton, et al.),
str.78 – 115, ASTM STP 707, Philadelphia.
(70) Chiou C. T., Peters L. J., Freed V. H.,
(1979), „A physical concept of soil-water
equilibria for non-ionic organic compounds“.
Science, Vol. 206, str. 831 – 832.
(71) Hassett J. J., Banwart W. I., Wood S. G.,
Means J. C., (1981), „Sorption of /-Naphtol:
implications concerning the limits of
hydrophobic sorption“. Soil Sci. Soc. Am. J.
45, str. 38 – 42.
(72) Karickhoff S. W., (1981), „Semi-empirical
estimation of sorption of hydrophobic
pollutants on natural sediments and soils“.
Chemosphere, Vol. 10(8), str. 833 – 846.
(73) Moreale A., van Bladel R., (1981),
„Adsorption de 13 herbicides et insecticides
par le sol. Relation solubilitE-reactivitE“.
Revue de l'Agric., 34 (4), str. 319 – 322.
(74) Müller M., Kördel W. (1996), „Comparison of
screening methods for the
determination/estimation of adsorption
coefficients on soil“. Chemosphere, 32(12),
str. 2493 – 2504.
(75) Kördel W., Kotthoff G., Müller M. (1995),
„HPLC — screening method for the
determination of the adsorption coefficient
on soil — results of a ring test“.
Chemosphere 30 (7), str. 1373 – 1384.
(76) Kördel W., Stutte J., Kotthoff G. (1993),
„HPLC — screening method for the
determination of the adsorption coefficient
on soil — comparison of different stationary
phases“. Chemosphere 27 (12),
str. 2341 – 2352.
(77) Hance, R. J., (1967), „The Speed of
Attainment of Sorption Equilibria in Some
Systems Involving Herbicides“. Weed Res.,
Vol. 7, str. 29 – 36.
(78) Koskinen W. C., Harper S. S., (1990), „The
retention processes: mechanisms“ in
Pesticides in the Soil Environment:
Processes, Impacts and Modelling (ed. H.H.
Cheng). Soil Sci. Soc. Am. Book Series, No.
2, Madison, Wisconsin.
(79) Cohen S. Z., Creeger S. M., Carsel R. F.,
Enfield C. G. (1984), „Potential pesticide
contamination of groundwater from
agricultural use“, in Treatment and Disposal
of Pesticide Wastes, str.297 – 325, ACS Symp.
Ser. 259, American Chemical Society,
Washington, DC. (80) Giles C. H., (1970),
„Interpretation and use of sorption isotherm“
in Sorption and Transport Processes in Soils.
S.C.I. Monograph No. 37, str. 14 – 32.
(81) Giles, C. H.; McEwan J. H.; Nakhwa, S.N.,
Smith, D, (1960), „Studies in adsorption: XI.
A system of classification of solution
adsorption isotherms and its use in the
diagnosis of adsorption mechanisms and in
measurements of pesticides surface areas of
soil“. J. Chem. Soc., str. 3973 – 93.
(82) Calvet R., TercE M., Arvien J. C., (1980),
„Adsorption des pesticides par les sols et
leurs constituants: 3. CaractEristiques
gEnErales de l'adsorptio“. Ann. Agron. 31:
str. 239 – 251.
(83) Bedbur E., (1996), „Anomalies in the
Freundlich equatio“, Proc. COST 66 Workshop,
Pesticides in soil and the environment,
13 – 15 May 1996, Stratford-upon-Avon, UK.
(84) Guth, J. A., (1985), „Adsorption/desorptio“,
in Joint International Symposium,
Physicochemical Properties and their Role in
Environmental Hazard Assessment, July 1 – 3,
Canterbury, UK. (85) Soil Texture
Classification (US and FAO systems): Weed
Science, 33, Suppl. 1 (1985) and Soil Sci.
Soc. Amer. Proc. 26:305 (1962).
DODATEK 1
SCHÉMA ZKOUŠKY
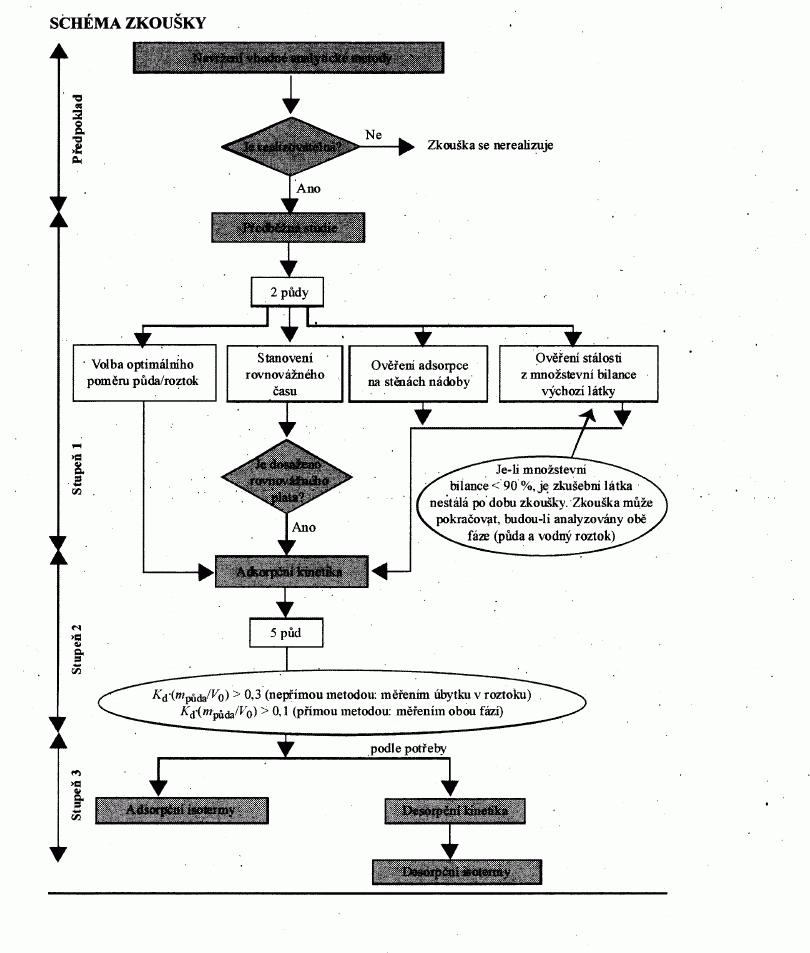
DODATEK 2
VLIV SPRÁVNOSTI ANALYTICKÉ METODY A ZMĚNY KONCENTRACE NA
SPRÁVNOST VÝSLEDKŮ ADSORPČNÍ STUDIE
Z následující tabulky (84) je zřejmé, že jeli rozdíl
mezi počáteční hmotností zkoušené látky (m0 = 110 µg) a
její rovnovážnou hmotností v roztoku (mads
aq (eq) = 100 µg), je důsledkem 5% chyby měření
rovnovážné koncentrace 50% chyba ve výpočtu hmotnosti
zkoušené látky adsorbované na půdě (madss(eq)) a 52,4%
chyba ve výpočtu Kd.
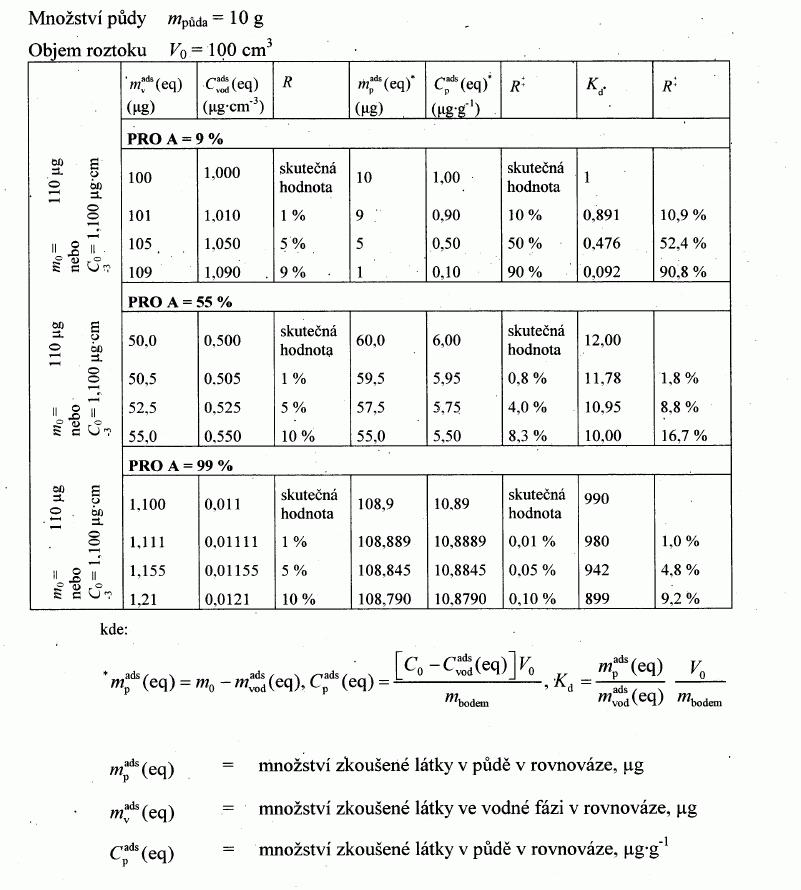
DODATEK 3
METODY ODHADU Kd
1. Metody odhadu umožňují předpovědět Kd na základě
korelací například s hodnotami Pov (12, 39, 63 –
68), s daty o rozpustnosti (12, 19, 21, 39, 68 –
73) nebo s daty o polaritě získanými při použití
HPLC s obrácenou fází (74 – 76). Jak je patrné
z tabulky 1 a 2, vypočtou se z takových rovnic
hodnoty K
ou
nebo Kom a poté nepřímo hodnoty Kd z
rovnic:
100 Kd 100
Kou = Kd .---- (cm3 . g-1) Kom = ----- . --- (cm3 . g-1)
%ou 1,724 %ou
2. Tyto korelace jsou založeny na dvou předpokladech: 1)
adsorpci látky nejvíce ovlivňuje organický materiál
v půdě a 2) mechanismus interakce je převážně
nepolární. V důsledku toho tyto korelace 1) nejsou
použitelné na polární látky (nebo jsou použitelné
jen do určité míry) a 2) nejsou použitelné
v případech, kdy je obsah organického materiálu
v půdě velmi malý (12). Kromě toho, ačkoli byla
zjištěna uspokojivá korelace mezi Pov a adsorpcí
(19), nelze totéž říci o korelaci mezi rozpustností
ve vodě a mírou adsorpce (19, 21); v tomto ohledu
jsou tyto studie protichůdné.
3. Některé příklady korelace mezi adsorpčním koeficientem
a rozdělovacím poměrem oktanol/voda nebo
rozpustností ve vodě jsou uvedeny v tabulkách 1 a
2.
Tabulka 1. Příklady korelací mezi adsorpčním
distribučním koeficientem a rozdělovacím
koeficientem oktanol/voda; další příklady
jsou uvedeny v literatuře (12, 68)
------------------------------------------------------- ---------------------------------
Látky Korelace Autoři
------------------------------------------------------- ---------------------------------
Substituovaná močovina log Kom = 0,69 + 0,52 log Pov Briggs (1981) (39)
Chlorované aromatické log Kou = -0,779 + 0,904 log Pov Chiou et al. (1983) (65)
sloučeniny
Různé pesticidy log Kom = 4,4 + 0,72 log Pov Gerstl a Mingelgrin (1984) (66)
Aromatické uhlovodíky log Kou = -2,53 + 1,15 log Pov Vowles a Mantoura (1987) (67)
------------------------------------------------------- ---------------------------------
Tabulka 2. Příklady korelací mezi adsorpčním
distribučním koeficientem a rozpustností
ve vodě; další příklady jsou uvedeny
v literatuře (68, 69)
------------------------------------------------------- ---------------------------------
Sloučeniny Korelace Autoři
------------------------------------------------------- ---------------------------------
Různé pesticidy log Kom = 3,8 – 0,561 log Sv Gerstl a Mingelgrin (1984) (66)
Chlorované alifatické a log Kom = (4,040 +/- 0,038) – Chiou et al. (1979) (70)
aromatické látky (0,557 +/- 0,012) log Sv
alfa-Naftol log Kou = 4,273 – 0,686 log Sv Hasset et al. (1981) (71)
Cyklické, alifatické a log Kou = -1,405 – 0,921 log Sv Karickhoff (1981) (72)
aromatické látky - 0,00953 (mp-25)
Různé látky log Kom = 2,75 – 0,45 log Sv Moreale van Blade (1982) (73)
------------------------------------------------------- ---------------------------------
DODATEK 4
VÝPOČTY PRO STANOVENÍ PARAMETRŮ CENTRIFUGACE
1. Centrifugační doba se za předpokladu, že jsou částice
kulové, vypočte podle následující rovnice:
(1)
Pro zjednodušení nejsou parametry uvedeny
v základních jednotkách SI (ale v jednotkách
soustavy CGS).
kde: omega = úhlová rychlost (= 2 pí*(rpm)/60), rad*s-1rpm = počet otáček za minutu ný = viskozita roztoku, g*s-1*cm-1rp= poloměr částic, cm róp= hustota půdy, g*cm-3róvod= hustota roztoku, g*cm-3Rt= vzdálenost od středu rotoru centrifugy k hladině roztoku v centrifugační kyvetě, cm Rb= vzdálenost od středu rotoru centrifugy ke dnu centrifugační kyvety, cm Rb– Rt= výška sloupce směsi půda/roztok v centrifugační kyvetě, cm.
V praxi se k zajištění úplného oddělení volí
dvojnásobek vypočteného času.
2. Rovnici (1) lze dále zjednodušit, jestliže se položí
viskozita (ný) a hustota (ný
vod
) roztoku rovny
viskozitě a hustotě vody při 25 st.C; tedy
ný = 8,95 × 10-3 g*s-1
*cm-1
a ńvod = 1,0 g*cm-3
.
Centrifugační doba je poté dána rovnicí (2):
3,7 Rb
t = --------------------------- 1n ----
(rpm)2 . rp2 (róp - 1) Rt
(2)
3. Z rovnice 2 vyplývá, že pro účely oddělení částic o
určité velikosti (v našem případě o poloměru
0,1 µm) jsou pro stanovení parametrů centrifugace,
tj. doby (t) a počtu otáček za minutu (rpm),
důležité dvě charakteristiky: 1) hustota půdy a
2) výška sloupce směsi v centrifugační kyvetě (Rb –
Rt), tj. vzdálenost, kterou půdní částice urazí
mezi hladinou v kyvetě a jejím dnem; výška sloupce
směsi v kyvetě bude při pevně stanoveném objemu
samozřejmě záviset na druhé mocnině poloměru
kyvety.
4. Na obrázku 1 jsou znázorněny změny centrifugační doby
(t) v závislosti na centrifugační rychlosti (rpm)
pro různé hustoty půdy (ńp) (obrázek 1a) a pro
různé výšky sloupce směsi v centrifugačních
kyvetách (obrázek 1b). Z obrázku 1a je zřejmý vliv
hustoty půdy; např. při obvyklých 3 000 ot./min je
centrifugační doba přibližně 240 min pro hustotu
půdy 1,2 g*cm
-3
, ale pouze 50 min pro 2,0 g*cm-3
.
Podobně je podle obrázku 1b při obvyklých
3 000 ot./min centrifugační doba přibližně 50 min
pro výšku sloupce směsi 10 cm a pouze 7 min pro
výšku sloupce 1 cm. Je však důležité nalézt
optimální poměr mezi centrifugací, která vyžaduje
co nejmenší výšku sloupce, a snadností, s jakou
může experimentátor oddělovat fáze po centrifugaci.5. Kromě toho je při stanovování experimentálních
podmínek při oddělování fází půda/roztok důležité
počítat s možnou přítomností třetí „pseudofáze“,
koloidu. Koloidní částice s velikostí menší než
0,2 µm mohou mít značný vliv na celý mechanismus
adsorpce látky v půdní suspenzi. Při centrifugaci,
jak je popsána výše, zůstanou koloidní částice ve
vodné fázi a analyzují se společně s vodnou fází.
Informace o jejich vlivu se tedy ztratí.
Máli laboratoř, která studii provádí, zařízení pro
ultracentrifugaci nebo ultrafiltraci, mohla by být
adsorpce/desorpce studována hlouběji včetně
informací o adsorpci látky na koloidních částicích.
V takovém případě se k oddělení tří fází – půdy,
koloidních částic a roztoku, použije
ultracentrifugace při 60 000 ot./min nebo
ultrafiltrace na filtru zachycujícím částice o
velikosti 100 000 daltonů. Protokol o zkoušce by
měl být také odpovídajícím způsobem pozměněn, mají-
li být analyzovány všechny tři fáze.
Obrázek 1a Změny centrifugační doby (t) v závislosti na centrifugační rychlosti (ot./min) pro různé hustoty půdy (róp). Rt = 10 cm, Rb – Rt = 10 cm, ný = 8,95 × 10-3 g*s-1cm-1a róvod= 1,0 g*cm-3při 25 st.C.
Obrázek 1b Změna centrifugační doby (t) v závislosti na centrifugační rychlosti (ot./min) pro různé výšky sloupce směsi v centrifugační kyvetě (Rb– Rt) = L; Rt = 10 cm, ný = 8,95 × 10-3g*s-1*cm-1, róvod= 1,0 g*cm-3při 25 st.C a róp= 2,0 g*cm-3.
DODATEK 5
VÝPOČET ADSORPCE A (%) A DESORPCE D (%)
Časové schéma průběhu experimentu je následující:
U všech výpočtů se předpokládá, že zkoušená látka je
stálá a že se významně neadsorbuje na stěnách nádoby.
ADSORPCE (A%)
a) Paralelní metoda
Procento adsorpce se vypočte pro každou zkušební
nádobu (i) pro každý čas (ti) podle následující
rovnice:
mpads (ti) . 100
Ati = --------------------- (%)
m0
(1)3
Veličiny v této rovnici lze vyčíslit takto: m0= C0. V0(mg) (2) mpads(ti) = m0- Cvodads(ti ) . V0(mg) (3) kde: At= procento adsorpce (%) v čase ti = množství zkoušené látky na půdě v čase ti, kdy je prováděna analýza (µg) m0= množství zkoušené látky v nádobě na začátku zkoušky (µg) C0= počáteční hmotnostní koncentrace zkušebního roztoku v kontaktu s půdou (µg*cm-3) = hmotnostní koncentrace látky ve vodné fázi v čase ti, kdy je prováděna analýza, (µg*cm-3); Tato koncentrace se stanoví analyticky a koriguje se na hodnoty ze slepých pokusů V0= počáteční objem zkušebního roztoku v kontaktu s půdou (cm3). Hodnoty adsorpčního procenta nebo se vynesou proti času a zjistí se doba, po níž se ustavila sorpční rovnováha. Příklady takových křivek jsou uvedeny na obrázcích 1 a 2. Obrázek 1 Křivka ustavování adsorpční rovnováhy Obrázek 2. Závislost hmotnostní koncentrace látky ve vodné fázi (Cvod) na čase
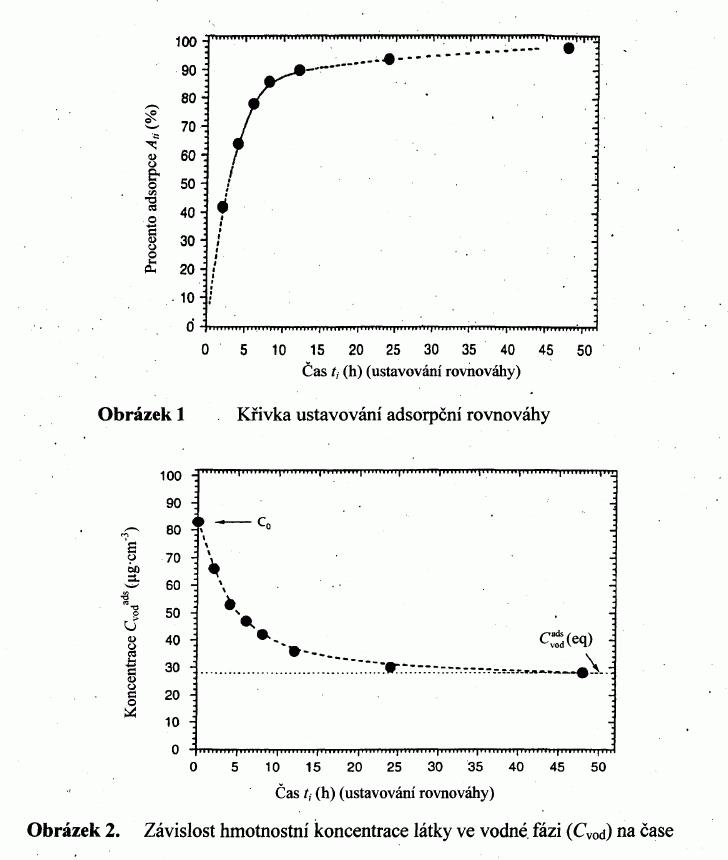
b) Sériová metoda


V následujících rovnicích je zohledněno, že se při
studii adsorpce provádějí měření zkoušené látky
v malých podílech vodné fáze v určitých časových
intervalech.
— Pro každý časový interval se množství látky
adsorbované na půdě vypočte takto:

Hodnoty procenta adsorpce nebo (podle potřeb
studie) se vynesou proti času a stanoví se
doba, po níž se ustavila sorpční rovnováha.
— V čase ustavení rovnováhy teq:

DESORPCE (%)
Časem t
0
, v němž se zahájí experiment pro studium
desorpční kinetiky, je okamžik, kdy je co největší objem
roztoku zkoušené látky (po dosažení adsorpční rovnováhy)
nahrazen stejným objemem 0,01M roztoku CaCl2
.
a) Paralelní metoda

V čase t
i
se změří množství zkoušené látky ve vodné
fázi odebrané ze zkušební nádoby i (Vt
i
) a desorbované
množství se vypočte z rovnice:
b) Sériová metoda


V následujících rovnicích je zohledněno, že byla
při předcházející studii adsorpce prováděna měření
zkoušené látky v malých podílech vodné fáze
(sériová metoda v bodě 1.9 Provedení zkoušky)
Předpokládá se, že a) objem supernatantu odebraného
ze zkušební nádoby po experimentu pro studium
adsorpční kinetiky byl nahrazen stejným objemem
0,01M roztoku CaCl
2
(VR) a b) celkový objem vodné
fáze v kontaktu s půdou (VT) během experimentu pro
studium desorpční kinetiky zůstává konstantní a je
dán rovnicí:

DODATEK 6
ADSORPCE – DESORPCE V PŮDÁCH: FORMULÁŘE PRO PŘEDLOŽENÍ
DAT
================================================================= Zkoušená látka: Zkušební půda: Podíl sušiny v půdě (105 st.C, 12 h):……………………………………………% Teplota:…………………………………………………………………………st.C Použitelnost analytické metody Navážka půdy g Půda: suchá hmotnost g Objem roztoku CaCl2cm3Nominální koncentrace µg*cm-3připraveného roztoku Analytická koncentrace µg*cm-3připraveného roztoku Podstata použité analytické metody: Kalibrace analytické metody: ================================================================= ============================================================================ Zkoušená látka: Zkušební půda: Podíl sušiny v půdě (105 st.C, 12 h):……………………………………………% Teplota:…………………………………………………………………………st.C Použitá metodika Nepřímá - Paralelní - Sériová - analýzy: Přímá - Adsorpční zkouška: zkušební vzorky ---------------------------------------------------------------------------- Symbol Jednotky Čas Čas Čas Čas (v průběhu (v průběhu (v průběhu (v průběhu ustavování ustavování ustavování ustavování rovnováhy) rovnováhy) rovnováhy) rovnováhy) ---------------------------------------------------------------------------- Zkušební nádoba č. Navážka — g půdy Půda: suchá mpůda g hmotnost Objem vody Vvp cm3v navážce půdy (vypočtený) Objem 0,01M cm3roztoku CaCl2použitého k uvedení do rovnováhy s půdou Objem cm3zásobního roztoku Celkový V0 cm3objem vodné fáze v kontaktu s půdou Počáteční C0 µg*cm-3koncentrace zkoušeného roztoku Množství m0 µg zkoušené látky na začátku zkoušky ---------------------------------------------------------------------------- Po protřepávání a centrifugaci ---------------------------------------------------------------------------- Nepřímá metoda ---------------------------------------------------------------------------- Paralelní metoda ---------------------------------------------------------------------------- Koncentrace µg*cm-3zkoušené látky ve vodné fázi, po korekci na slepý pokus ---------------------------------------------------------------------------- Sériová metoda ---------------------------------------------------------------------------- Naměřené µg množství zkoušené látky v podílu ---------------------------------------------------------------------------- Přímá metoda ---------------------------------------------------------------------------- Množství µg zkoušené látky adsorbované na půdě ---------------------------------------------------------------------------- Výpočet adsorpce ---------------------------------------------------------------------------- Adsorpce % % Střední hodnota Adsorpční Kd cm3*g-1koeficient Střední hodnota Adsorpční Koucm3*g-1koeficient Střední hodnota ============================================================================ ============================================================================ Zkoušená látka: Zkušební půda: Podíl sušiny v půdě (105 st.C, 12 h):……………………………………………% Teplota:…………………………………………………………………………st.C Adsorpční zkouška: slepý pokus a kontrolní vzorky ----------------------------------------------------------------- Symbol Jednotky Slepý Slepý Kontrolní pokus pokus vzorek ----------------------------------------------------------------- Zkušební nádoba č. Navážka půdy g 0 0 Množství vody cm3— — v navážce půdy (vypočtené) Přidaný objem cm30,01M roztoku CaCl2Přidaný objem cm30 0 zásobního roztoku zkušební látky Celkový objem cm3— — vodné fáze (vypočtený) Počáteční µg*cm-3hodnota zkušební látky ve vodné fázi ----------------------------------------------------------------- Po protřepávání a centrifugaci ----------------------------------------------------------------- Koncentrace ve µg*cm-3vodné fázi Poznámka: Podle potřeby lze přidat sloupce. ================================================================ ========================================================== Zkoušená látka: Zkušební půda: Podíl sušiny v půdě (105 st.C, 12 h):……………………………………………% Teplota:……………………………………………………………………………st.C Množstevní bilance ---------------------------------------------------------- Symbol Jednotky Zkušební nádoba č. Navážka půdy — g Půda: suchá hmotnost mpůda g) Objem vody v navážce půdy (vypočtený) Vvp ml Objem 0,01M roztoku CaCl2použitého ml k uvedení do rovnováhy s půdou Objem zásobního roztoku cm3Celkový objem vodné fáze v kontaktu V0 cm3s půdou Počáteční koncentrace zkoušeného C0 µg*cm-3roztoku Čas (v průběhu ustavování rovnováhy) — h ---------------------------------------------------------- Po protřepávání a centrifugaci ---------------------------------------------------------- Koncentrace zkoušené látky ve vodné µg*cm-3fázi v adsorpční rovnováze, po korekci na slepý pokus Rovnovážný čas teq h ---------------------------------------------------------- První přidání rozpouštědla ---------------------------------------------------------- Odebraný objem vodné fáze Vrec cm3Přidaný objem rozpouštědla V cm3---------------------------------------------------------- První extrakce rozpouštědlem ---------------------------------------------------------- Velikost signálu měřidla při analýze SE1 různé rozpouštědla Koncentrace zkoušené látky CE1 µg*cm-3v rozpouštědle Množství látky extrahované z půdy a mE1 µg stěn nádoby ---------------------------------------------------------- Druhá extrakce rozpouštědlem ---------------------------------------------------------- Odebraný objem rozpouštědla Vrozp cm3Přidaný objem rozpouštědla V' cm3---------------------------------------------------------- Druhá extrakce rozpouštědlem ---------------------------------------------------------- Velikost signálu měřidla při analýze SE2 různé rozpouštědlové fáze Koncentrace zkoušené látky CE2 µg*cm-3v rozpouštědle Množství látky extrahované z půdy a mE2 µg stěn nádoby Celkové množství zkoušené látky mE µg extrahované ve dvou krocích Hmotnostní bilance MB % ========================================================== ========================================================== Zkoušená látka: Zkušební půda: Podíl sušiny v půdě (105 st.C, 12 h):……………………………………………% Teplota:…………………………………………………………………………st.C ---------------------------------------------------------- Adsorpční isothermy Symbol Jednotky ---------------------------------------------------------- Zkušební nádoba č. Navážka půdy — g Půda: suchá hmotnost E g Objem vody v navážce Vvp cm3půdy (vypočtený) Objem 0,01M roztoku cm3CaCl2použitého k uvedení do rovnováhy s půdou Přidaný objem cm3zásobního roztoku Celkový objem vodné V0 cm3fáze v kontaktu s půdou (vypočtený) Koncentrace roztoku C0 µg*cm-3Čas (v průběhu — h ustavování rovnováhy) ---------------------------------------------------------- Po protřepávání a centrifugaci ---------------------------------------------------------- Koncentrace látky ve µg*c vodné fázi, po m-3korekci na slepý pokus Teplota st.C Adsorbované množství µg*g-1na jednotku množství půdy Regresní analýza: hodnota : hodnota l/n: regresní koeficient r2: ========================================================= ========================================================== Zkoušená látka: Zkušební půda: Podíl sušiny v půdě (105 st.C, 12 h):……………………………………………% Teplota:…………………………………………………………………………st.C Použitá metodika analýzy: Nepřímá - Paralelní - Sériová - -------------------------------------------------------------------- Desorpční zkouška Symbol Jednotky Časový Časový Časový Časový interval interval interval interval -------------------------------------------------------------------- Číslo zkušební nádoby z adsorpčního experimentu Množství látky µg adsorbované na půdě v adsorpční rovnováze Odebraný objem VR cm3vodné fáze nahrazený 0,01M CaCl2Celkový PM V0 cm3objem vodné SM VT cm3fáze v kontaktu s půdou Množství látky, µg které zbylo (aniž se adsorbovalo) po ustavení adsorpční rovnováhy, a to v důsledku nekvantitativní výměny objemu vodné fáze ---------------------------------------------------------- Desorpční kinetika ---------------------------------------------------------- Naměřené množství µg látky desorbované z půdy v čase ti Objem roztoku PM cm3odebraný ze zkušební nádoby (i) pro měření zkoušené látky SM cm3Množství látky µg desorbované z půdy v čase ti (vypočtené) Množství látky µg desorbované z půdy během časového intervalu (vypočtené) ---------------------------------------------------------- Procento desorpce ---------------------------------------------------------- Desorpce v čase ti % Desorpce za časový % interval Zdánlivý desorpční Kdeskoeficient PM: paralelní metoda SM: sériová metoda ===========================================================
XIX. METODA PRO STANOVENÍ ODHADU ADSORPČNÍHO KOEFICIENTU
(KOU) PRO PŮDY A ČISTÍRENSKÉ KALY VYSOKOÚČINNOU
KAPALINOVOU CHROMATOGRAFIÍ (HPLC) – metoda C.19 podle
přílohy směrnice 2001/59/ES
XIX.1 METODA
Tato metoda je replikou metody OECD TG121 (2000).
XIX.1.1 ÚVOD
Sorpční chování látek v půdách a v čistírenských
kalech může být popsáno parametry experimentálně
stanovenými zkušební metodou C.18. Důležitým
parametrem je adsorpční koeficient, který je
definován jako poměr koncentrace látky v půdě
nebo kalu a koncentrace látky ve vodné fázi
v rovnováze. Adsorpční koeficient normalizovaný
na obsah organického uhlíku v půdě K
ou
je
užitečným ukazatelem schopnosti chemické látky
vázat se na organické látky v půdě a
v čistírenském kalu a umožňuje porovnat různé
chemické látky. Tento parametr lze odhadnout
z korelace s rozpustností ve vodě a
s rozdělovacím koeficientem oktanol/voda (1, 2,
3, 4, 5, 6, 7).
Experimentální metoda popsaná v této zkoušce
používá k odhadu adsorpčního koeficientu Kou
v půdě a v čistírenských kalech vysokoúčinnou
kapalinovou chromatografii (8). Tyto odhady jsou
spolehlivější než odhady z výpočtů pomocí
metodiky QSAR (Quantitative Structure Activity
Relationship) (9). Jako metoda založená na odhadu
nemůže plně nahradit násadové experimenty
stanovení adsorpční/desorpční rovnováhy podle
metody C.18. Odhady K
ou
však mohou být užitečné
pro volbu vhodných parametrů pro
adsorpční/desorpční studie podle zkušební metody
C.18, a to vypočtením Kd (distribučního
koeficientu) nebo KF (Freundlichova adsorpčního
koeficientu) z rovnice 3 (viz bod 1.2).XIX.1.2 DEFINICE
Kd: Distribuční koeficient je definován jako
poměr rovnovážných koncentrací C rozpuštěné látky
ve dvoufázovém systému skládajícím se ze sorbentu
(půda nebo čistírenský kal) a vodné fáze; je
bezrozměrný, jsouli koncentrace v obou fázích
vyjádřeny jako hmotnostní podíly. Jeli
koncentrace ve vodné fázi vyjádřena v jednotce
hmotnosti na jednotku objemu, je jednotkou ml*g
-1
.
Kd se může měnit s vlastnostmi sorbentu a může
záviset na koncentraci.
Cpůda Ckal
KD = ------- nebo ------- (1)
Cvoda Cvod
kde:
Cpůda = koncentrace zkoušené látky v půdě
v rovnováze (µg*g-1)
Ckal = koncentrace zkoušené látky v kalu
v rovnováze (µg*g-1)
Cvod = koncentrace zkoušené látky ve vodné fázi
v rovnováze (µg*g-1, µg*ml-1).
KF: Freundlichův adsorpční koeficient je
definován jako koncentrace zkoušené látky v půdě
nebo v čistírenském kalu (x/m), jeli rovnovážná
koncentrace Cvod ve vodné fázi rovna jedné;
vyjadřuje se v µg na gram sorbentu. Hodnota se
může měnit s vlastnostmi sorbentu.
x 1
log --- = log KF + --- . log Cvod
m n
(2)
kde:
x/m = množství zkoušené látky x (µg)
adsorbované v rovnováze na určitém
množství sorbentu m (g)
1/n = směrnice Freundlichovy adsorpční
isothermy
Cvod = koncentrace zkoušené látky ve vodné
fázi v rovnováze (µg*ml-1)
Při Cvod = 1:
Kou: Distribuční koeficient (Kd) nebo
Freundlichův adsorpční koeficient (KF)
normalizovaný na obsah organického uhlíku (fou)
v sorbentu; zejména u nedisociujících chemických
látek je přibližným ukazatelem míry adsorpce
látky na sorbentu a umožňuje provést porovnání
různých chemických látek. V závislosti na rozměru
Kd a KF může být Kou bezrozměrný nebo může být
jeho jednotkou ml . g-1 nebo µg . g-1 organického
materiálu.
Kd KF
Kou = --- (bezrozměrný nebo v ml*g-1) nebo ----- (µg*g-1) (3)
fou fou
Vztah mezi Kou a Kd není vždy lineární, hodnoty
Kou se mohou pro jednotlivé půdy měnit, avšak
jejich kolísání je ve srovnání s hodnotami Kd
nebo KF silně omezeno.
Adsorpční koeficient (Kou) lze odečíst pomocí
kapacitního faktoru (k') z kalibrační křivky
log k' versus log Kou pro vybrané referenční
sloučeniny.
tR - t0
k' = ---------
t0
(4)
kde:
tR: retenční časy zkoušené a referenční látky
pro HPLC (min)
t0: mrtvá doba HPLC (min) (viz bod 1.8.2).
Pov: Rozdělovací koeficient oktanol/voda je
definován jako poměr koncentrací rozpuštěné látky
v n-oktanolu a ve vodě; je bezrozměrný.
Coktanol
Pov = --------- (= Kov) (5)
Cvoda
XIX.1.3 REFERENČNÍ LÁTKY
Pře použitím metody by měly být známy strukturní
vzorec, čistota a disociační konstanta (podle
potřeby). Užitečné jsou informace o rozpustnosti
ve vodě a v organických rozpouštědlech, o
rozdělovacím koeficientu oktanolvoda a o chování
při hydrolýze.
Majíli být uvedena do korelace naměřená retenční
data z HPLC pro zkoušenou látku a její adsorpční
koeficient, musí být vytvořen kalibrační graf
log K
ou
versus log k'. Použije se minimálně šest
referenční bodů, alespoň po jednom nad a pod
očekávanou hodnotou pro zkoušenou látku.
Správnost metody se významně zlepší, budouli
použity referenční látky strukturně příbuzné se
zkoušenou látkou. Nejsouli taková data známa,
ponechává se na experimentátorovi, aby vybral
vhodné kalibrační látky. V takovém případě by
měla být vybrána obecnější sada strukturně
heterogenních látek. Látky a hodnoty Kou, které
mohou být použity, jsou uvedeny v dodatku, a to
v tabulce 1 pro čistírenský kal a v tabulce 3 pro
půdu. Volba jiných kalibračních látek by měla být
zdůvodněna.XIX.1.4 PODSTATA ZKUŠEBNÍ METODY
HPLC se provádí na analytických kolonách plněných
komerčně dostupným kyanopropylem jako pevnou
fází, obsahujícím lipofilní a polární složky.
Použije se mírně polární stacionární fáze na
silikagelové matrici:
– O – Si – CH2 – CH2 – CH2 – CN
silikagel nepolární spacer polární složka
Podstata zkušební metody je obdobná jako ve
zkušební metodě A.8 (rozdělovací koeficient,
metoda HPLC). Při průchodu kolonou v mobilní fázi
zkoušená látka interaguje se stacionární fází.
V důsledku rozdělování mezi mobilní a stacionární
fází se postup zkoušené látky zpomaluje. Dvojí
složení stacionární fáze s polárními a
nepolárními skupinami umožňuje, aby polární a
nepolární skupiny molekuly interagovaly podobným
způsobem, jako je tomu u organického materiálu
v půdě nebo čistírenském kalu. To umožňuje
stanovit vztah mezi retenčním časem na koloně a
adsorpčním koeficientem na organickém materiálu.
Na sorpční chování zejména u polárních látek má
významný vliv pH. V případě zemědělských půd nebo
nádrží s čistírenskými kaly se pH normálně
pohybuje od pH 5,5 do 7,5. U disociujících látek
se ve vhodném pufračním roztoku provedenou dvě
zkoušky, a to jak s disociovanou formou, tak
s nedisociovanou formou, avšak pouze v případě,
že v rozmezí pH 5,5 až 7,5 disociuje alespoň 10 %
zkoušené sloučeniny.
Vzhledem k tomu, že se k hodnocení použije pouze
vztah mezi retencí na koloně HPLC a adsorpčním
koeficientem, není nutná žádná kvantitativní
metoda, nýbrž pouze stanovení retenčního času.
Jeli k dispozici vhodná sada referenčních látek
a lzeli realizovat standardní experimentální
podmínky, je metoda rychlým a účinným způsobem
odhadu adsorpčního koeficientu Kou.
XIX.1.5 POUŽITELNOST ZKOUŠKY
Metoda HPLC je použitelná pro chemické látky
(radioizotopově značené i neznačené), pro něž je
k dispozici vhodný detekční systém
(např. spektrofotometr, detektor radioaktivního
záření) a jež jsou po dobu experimentu dostatečně
stabilní. Může být zvláště užitečná pro chemické
látky, jejichž studium je v jiných
experimentálních systémech obtížné (tj. pro
těkavé látky, které nejsou rozpustné ve vodě
v koncentraci, kterou lze analyticky měřit, pro
látky s vysokou afinitou k povrchu inkubačních
systémů). Metoda může být použita pro směsi,
které dávají nerozlišitelný eluční pás. V takovém
případě se stanoví horní a dolní meze hodnot
log K
ou
pro sloučeniny přítomné ve směsi.
Při interpretaci výsledků HPLC mohou někdy
působit problémy nečistoty. Jejich vliv je však
malý, neboť zkoušené látky lze jasně analyticky
identifikovat a od nečistot oddělit.
Metoda je validována pro látky uvedené
v tabulce 1 v dodatku a byla rovněž použita u
řady jiných chemických látek z následujících
chemických tříd:
— aromatické aminy (např. trifluralin
(1(dipropylamino)2,6dinitro4(trifluormet
hyl)benzen), 4chloranilin,
3,5dinitroanilin, 4methylanilin,
Nmethylanilin, 1nafylamin),
— estery aromatických karoxylových kyselin (např.
methylbenzoát, ethyl3,5dinitrobenzoát),
— aromatické uhlovodíky (např. toluen, xylen,
ethylbenzen, nitrobenzen),
— estery aryloxyfenoxypropanové kyseliny (např.
diklofopmethyl, fenoxapropethyl,
fenoxapropPethyl),
— benzimidazolové a imidazolové fungicidy (např.
karbendazim, fuberidazol, triazoxid),
— amidy karboxylových kyselin
(např. 2chlorbenzamid, N,Ndimethylbenzamid,
3,5dinitrobenzamid, Nmethylbenzamid,
2nitrobenzamid, 3nitrobenzamid),
— chlorované uhlovodíky (např. endosulfan, DDT,
hexachlorbenzen, kvintozen,
1,2,3trichlorbenzen),
— organofosforové insekticidy (např.
azinfosmethyl, disulfoton, fenamifos,
isofenfos, pyrazofos, sulprofos, triazofos),
— fenoly (např. fenol, 2nitrofenol,
4nitrofenol, pentachlorfenol,
2,4,6trichlorfenol, 1naftol),
— deriváty fenylmočoviny (např. isoproturon,
monolinuron, pencykuron),
— pigmentová barviva (např. Acid Yellow 219,
Basic Blue 41, Direct Red 81),
— polyaromatické uhlovodíky (např. acenaften,
naftalen),
— 1,3,5triazinové herbicidy (např. prometryn,
propazin, simazin, terbutryn),
— triazolové deriváty (např. tebukonazol,
triadimefon, tradimenol, triapenthenol).
Metoda není použitelná u látek, které reagují
s eluentem nebo stacionární fází. Není rovněž
použitelná u látek, které interagují specifickým
způsobem s anorganickými složkami (např. tvoří
klastrové komplexy s minerály jílu). Metoda
nemusí být použitelná u povrchově aktivních
látek, anorganických látek a mírných nebo silných
organických kyselina a zásad. Lze stanovit Kou
s hodnotami log K
ou
od 1,5 do 5,0. Disociující
látky musí být měřeny s pufrovanou mobilní fázi,
avšak je třeba dbát na to aby nedošlo ke srážení
složek pufru nebo zkoušené látky.XIX.1.6 KRITÉRIA JAKOSTI
XIX.1.6.1 Správnost
Obvykle lze adsorpční koeficient zkoušené látky
stanovit v rozmezí +/-0,5 řádu hodnoty stanovené
násadovou rovnovážnou metodou (viz tabulka 1
v dodatku). Vyšší míry správnosti lze dosáhnout,
jsouli použité referenční látky strukturně
příbuzné se zkoušenou látkou.
XIX.1.6.2 Opakovatelnost
Stanovení se provedou alespoň dvojmo. Hodnoty
log K
ou
získané z jednotlivých měření by měly
ležet v rozmezí +/-0,1.XIX.1.6.3 Reprodukovatelnost
Dosud získané zkušenosti s použitím metody svědčí
o její validitě. Ověřování metody HPLC za použití
48 látek (převážně pesticidů), u nichž byla
k dispozici spolehlivá data o K
ou
v půdě, vedlo
ke korelačnímu koeficientu R = 0,95 (10, 11).
Pro zlepšení a validaci metody bylo proveden
mezilaboratorní test za účasti 11 laboratoří
(12). Výsledky jsou uvedeny v tabulce 2
v dodatku.
XIX.1.7 POPIS ZKUŠEBNÍ METODY
XIX.1.7.1 Předběžný odhad adsorpčního koeficientu
Rozdělovací poměr oktanolvoda Pov (= Kow) a do
určité míry i rozpustnost ve vodě mohou být
použity jako indikátory rozsahu adsorpce zejména
u nedisociujících látek a mohou tedy být použity
pro jeho předběžné nalezení. Pro různé skupiny
chemických látek byla publikována řada užitečných
korelací (1, 2, 3, 4, 5, 6, 7).
XIX.1.7.2 Přístroje a pomůcky
Nezbytným vybavením je kapalinový chromatograf
vybavený bezpulsním čerpadlem a vhodným detekčním
zařízením. Doporučuje se používat nástřikový
ventil se vstřikovací smyčkou. Použije se
komerční kyanopropylové chemicky vázané
pryskyřice na silikagelu (např. Hypersil a Zorbax
CN). Mezi nástřikem a analytickou kolonou může
být umístěna ochranná předkolona ze stejného
materiálu. Kolony od různých dodavatelů se mohou
podstatně lišit, pokud jde o účinnost. Pro
orientaci by měly být dosaženy následující
kapacitní faktory: log k' > 0,0 pro
log K
ou
= 3,0 a log k' > 0,4 pro log Kou
= 2,0
při použití směsi methanol/voda 55/45 % jako
mobilní fáze.XIX.1.7.3 Mobilní fáze
Bylo testováno několik mobilních fází a
doporučují se následující dvě mobilní fáze:
— methanol/voda (55/45 % obj.),
— methanol/0,01M citrátový pufr pH 6,0 (55/45 %
obj.).
XIX.1.7.4 Rozpouštěné látky
Zkušební a referenční látky se rozpustí v mobilní
fázi.
XIX.1.8 PROVEDENÍ ZKOUŠKY
XIX.1.8.1 Zkušební podmínky
Během měření se zaznamenává teplota. Pro
zajištění konstantních podmínek během kalibrace a
předběžných měření a během měření zkoušené látky
se velmi doporučuje použití kolony s regulací
teploty.
XIX.1.8.2 Stanovení mrtvé doby t0
Pro stanovení mrtvé doby lze použít dvě různé
metody (viz také bod 1.2).
XIX.1.8.2.1 Stanovení mrtvé doby t0 pomocí homologické
řady
Je ověřeno, že tato metoda poskytuje spolehlivé a
standardisované hodnoty t0. Podrobnosti viz
zkušební metoda A.8: Rozdělovací koeficient
(noktanol/voda ) metodou za použití HPLC.
XIX.1.8.2.2 Stanovení mrtvé doby t0 pomocí inertních
látek, které nejsou kolonou zadržovány
Tato technika je založena na nástřiku roztoků
formamidu, močoviny nebo dusičnanu sodného.
Měření se provedou alespoň dvojmo.
XIX.1.8.3 Stanovení retenčních časů tR
Referenční látky se vyberou tak, jak je uvedeno
v bodě 1.3. Pro stanovení jejich retenčních časů
mohou být nastříknuty jako směsný standard za
předpokladu, že je ověřeno, že retenční čas
žádného referenčního standardu není ovlivňován
přítomností jiných referenčních standardů.
Kalibrace by měla být prováděna pravidelně,
alespoň dvakrát denně, aby se zachytily nečekané
změny účinnosti kolony. Nástřiky pro kalibraci by
měly být prováděny nejlépe před nástřikem
zkoušené látky a po něm, aby se ověřilo, že
nedošlo ke změně retenčních časů. Zkoušené látky
se nastříknou odděleně v co nejmenších množstvích
(aby se kolona nezahltila) a stanoví se jejich
retenční časy.
S cílem zvýšit důvěryhodnost měření musí být
provedena alespoň opakovaná stanovení. Hodnoty
log K
ou
získané z jednotlivých měření by měly
ležet v rozmezí +/-0,25.XIX.1.8.4 Hodnocení
Kapacitní faktory k' se vypočtou z mrtvé doby t0
a retenčních časů tR vybraných referenčních látek
podle rovnice 4 (viz bod 1.2). Hodnoty log k'
referenčních látek se poté vynesou proti jejich
hodnotám log K
ou
z násadových rovnovážných
experimentů uvedených v tabulkách 1 a 3
v dodatku. Z této křivky se poté pomocí hodnoty
log k' zkoušené látky odečte její hodnota
log Kou. Jeli z aktuálních výsledků zřejmé, že
hodnota log Kou
leží mimo obor kalibrační křivky,
zkouška se opakuje s vhodnějšími referenčními
látkami.XIX.2 DATA A ZPRÁVY
Zpráva musí obsahovat následující informace:
— identita zkoušené látky a referenčních látek,
jejich čistota a podle potřeby hodnoty pKa,
— popis zařízení a pracovních podmínek, např. typ
a velikost analytické (a ochranné) kolony,
detekční zařízení, mobilní fáze (poměr složek
a pH), rozpětí teploty během měření,
— mrtvá doba a použité metody jejího stanovení,
— množství zkoušené látky a referenčních látek
zavedených do kolony,
— retenční časy referenčních sloučenin použitých
ke kalibraci,
— charakteristiky proložené regresní křivky
(log k' versus log Kou) a graf regresní
křivky,
— průměrná retenční data a odhad hodnoty log Kou
zkoušené sloučeniny.
— chromatogramy.
XIX.3 LITERATURA
(1) W. J. Lyman, W. F. Reehl, D. H. Rosenblatt
(ed.). (1990). Handbook of chemical property
estimation methods, kap. 4, McGraw-Hill, New
York.
(2) J. Hodson, N. A. Williams (1988). The
estimation of the adsorption coefficient
(Kou) for soils by HPLC. Chemosphere, 17, 1
67.
(3) G. G. Briggs (1981). Theoretical and
experimental relationships between soil
adsorption, octanol-water partition
coefficients, water solubilities,
bioconcentration factors, and the parachor.
J. Agric. Food Chem., 29, str. 1050 – 1059.
(4) C. T. Chiou, P. E. Porter, D.W. Schmedding
(1983). Partition equilibria of nonionic
organic compounds between soil organic matter
and water. Environ. Sci. Technol., 17,
str. 227 – 231.
(5) Z. Gerstl, U. Mingelgrin (1984). Sorption of
organic substances by soils and sediment.
J. Environm. Sci. Health, B19,
str. 297 – 312.
(6) C. T. Chiou, L. J. Peters, V. H. Freed
(1979). A physical concept of soil water
equilibria for nonionic organic compounds,
Science, 106, str. 831 – 832.
(7) S. W. Karickhoff (1981). Semi-empirical
estimation of sorption of hydrophobic
pollutants on natural sediments and soils.
Chemosphere, 10, str. 833 – 846.
(8) W. Kördel, D. Hennecke, M. Herrmann (1997).
Application of the HPLC-screening method for
the determination of the adsorption
coefficient on sewage sludges. Chemosphere,
35(1/2), str. 121 – 128.
(9) M. Mueller, W. Kördel (1996). Comparison of
screening methods for the estimation of
adsorption coefficients on soil. Chemosphere,
32(12), str. 2493 – 2504.
(10) W. Kördel, J. Stutte, G. Kotthoff (1993).
HPLC-screening method for the determination
of the adsorption coefficient in soil-
comparison of different stationary phases,
Chemosphere, 27(12), str. 2341 – 2352.
(11) B. von Oepen, W. Kördel, W. Klein (1991).
Sorption of nonpolar and polar compounds to
soils: Processes, measurements and experience
with the applicability of the modified OECD
Guideline 106, Chemosphere, 22,
str. 285 – 304.
(12) W. Kördel, G. Kotthoff, J. Müller (1995).
HPLC-screening method for the determination
of the adsorption coefficient on soil-results
of a ring test. Chemosphere, 30(7),
str. 1373 – 1384.
DODATEK
TABULKA 1 Porovnání hodnot Koupro půdy a čistírenské kaly a hodnot vypočtených skreeningovou metodou s HPLC 1, 2 ------------------------------------------------------------ ----------------------------------------- Látka Číslo CAS Log Koupro Log KouLog Koupro Log Koučistírenské pomocí půdy pomocí delta kaly HPLC HPLC ------------------------------------------------------------ ----------------------------------------- Atrazin 1912-24-9 1,66 2,14 0,48 1,81 2,20 0,39 Linuron 330-55-2 2,43 2,96 0,53 2,59 2,89 0,30 Fenthion 55-38-9 3,75 3,58 0,17 3,31 3,40 0,09 Monuron 150-68-5 1,46 2,21 0,75 1,99 2,26 0,27 Fenanthren 85-01-8 4,35 3,72 0,63 4,09 3,52 0,57 Fenylbenzoát 93-99-2 3,26 3,03 0,23 2,87 2,94 0,07 Benzamid 55-21-0 1,60 1,00 0,60 1,26 1,25 0,01 4-Nitrobenzamid 619-80-7 1,52 1,49 0,03 1,93 1,66 0,27 Acetanilid 103-84-4 1,52 1,53 0,01 1,26 1,69 0,08 Anilin 62-53-3 1,74 1,47 0,27 2,07 1,64 0,43 2,5-Dichloranilin 95-82-9 2,45 2,59 0,14 2,55 2,58 0,03 ------------------------------------------------------------ ----------------------------------------- 1 W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), str. 121-128. 2 W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), str. 107- 119. TABULKA 2 Výsledky mezilaboratorního porovnávacího testu provedeného za účelem zlepšení a validace metody s HPLC (11 zúčastněných laboratoří)1 ---------------------------------------------------------- Látka Číslo CAS Log KouKouLog Kou(OECD 106) ------------------------ Metoda založená na HPLC ---------------------------------------------------------- Atrazin 1912-24-9 1,81 78 +/- 16 1,89 Monuron 150-68-5 1,99 100 +/- 8 2,00 Triapenthenol 77608-88-3 2,37 292 +/- 58 2,47 Linuron 330-55-2 2,59 465 +/- 62 2,67 Fenthion 55-38-9 3,31 2062 +/- 648 3,31 ---------------------------------------------------------- 1 W. Kördel, G. Kotthoff, J. Müller (1995). HPLC- screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), str. 1373-1384. TABULKA 3 Referenční látky doporučené pro skreeningovou metodu s HPLC na základě adsorpčních dat pro půdu ----------------------------------------------------------------- ---------------------------------------------- Referenční látka Číslo CAS Logaritmy Počet hodnot Logaritmus Zdroj středních Kousměrodatné hodnot odchylky z násadové rovnovážné metody ----------------------------------------------------------------- ---------------------------------------------- Acetanilid 103-84-4 1,25 4 0,48 a) Fenol 108-95-2 1,32 4 0,70 a) 2-Nitrobenzamid 610-15-1 1,45 3 0,90 b) N,N-Dimethylbenzamid 611-74-5 1,52 2 0,45 a) 4-Methylbenzamid 619-55-6 1,78 3 1,76 a) Methylbenzoát 93-58-3 1,80 4 1,08 a) Atrazin 1912-24-9 1,81 3 1,08 c) Isoproturon 34123-59-6 1,86 5 1,53 c) 3-Nitrobenzamid 645-09-0 1,95 3 1,31 b) Anilin 62-53-3 2,07 4 1,73 a) 3,5-Dinitrobenzamid 121-81-3 2,31 3 1,27 b) Karbendazim 10605-21-7 2,35 3 1,37 c) Triadimenol 55219-65-3 2,40 3 1,85 c) Triazoxide 72459-58-6 2,44 3 1,66 c) Triazofos 24017-47-8 2,55 3 1,78 c) Linuron 330-55-2 2,59 3 1,97 c) Naftalen 91-20-3 2,75 4 2,20 a) Endosulfan-diol 2157-19-9 3,02 5 2,29 c) Methiokarb 2032-65-7 3,10 4 2,39 c) Acid Yellow 219 63405-85-6 3,16 4 2,83 a) 1,2,3-Trichlorbenzen 87-61-6 3,16 4 1,40 a) ă-HCH (lindan) 58-89-9 3,23 5 2,94 a) Fenthion 55-38-9 3,31 3 2,49 c) Direct Red 81 2610-11-9 3,43 4 2,68 a) Pyrazofos 13457-18-6 3,65 3 2,70 c) a-Endosulfan 959-98-8 4,09 5 3,74 c) Diklofop-methyl 51338-27-3 4,20 3 3,77 c) Fenanthren 85-01-8 4,09 4 3,83 a) Basic Blue 41 (směs) 26850-47-5 4,89 4 4,46 a) 12270-13-2 DDT 50-29-3 5,63 1 — b) ----------------------------------------------------------------- ---------------------------------------------- a) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No 106 01 044 (1994). b) B.V. Oepen, W. Kördel, W. Klein (1991). Chemosphere, 22, str. 285-304. c) Data poskytnutá průmyslem.
XX. METODA PRO STANOVENÍ TOXICITY PRO REPRODUKCI U
DAPHNIA MAGNA – metoda C.20 podle přílohy směrnice
2001/59/ES
XX.1 METODA
Tato zkouška toxicity pro reprodukci je replikou
metody OECD TG 211 (1998).
XX.1.1 ÚVOD
Hlavním cílem zkoušky je posoudit účinky
chemických látek na reprodukční schopnost druhu
Daphnia magna.
XX.1.2 DEFINICE A JEDNOTKY
Matečné organismy: dafnie samičího pohlaví, které
jsou přítomné na začátku zkoušky a jejich
reprodukční schopnost je předmětem studie.
Potomstvo: mladé dafnie pocházející z matečných
organismů v průběhu zkoušky.
Nejnižší koncentrace s pozorovanými účinky
(lowest observed effect concentration, LOEC): je
nejnižší zkoušená koncentrace, při níž je pro
danou expoziční dobu pozorován statisticky
významný účinek látky na reprodukci a na
mortalitu matečných organismů (na úrovni
pravděpodobnosti falešně pozitivního hodnocení
p < 0,05) ve srovnání s kontrolní skupinou,
v průběhu stanovené expoziční doby. Všechny
zkoušené koncentrace vyšší než LOEC musí mít
stejné nebo vážnější škodlivé účinky, než účinky
pozorované při koncentraci LOEC. Nelzeli tyto
dvě podmínky splnit, musí podrobně vysvětleno jak
byla LOEC (a tedy i NOEC) zvolena.
Koncentrace bez pozorovaných účinků (no observed
effect concentration, NOEC): je zkušební
koncentrace bezprostředně nižší než LOEC, která
při srovnání s kontrolní skupinou nemá pro danou
expoziční dobu statisticky významný účinek
(p < 0,05).
ECx: je koncentrace zkoušené látky rozpuštěné ve
vodě, která pro danou expoziční dobu vede k x%
snížení reprodukce dafnií Daphnia magna.
Imanentní růst populace: je míra růstu populace,
v níž je zahrnuta reprodukční schopnost a
mortalita specifická z hlediska stáří (20, 21,
22). V ustáleném stavu bude nulový. Pro rostoucí
populaci bude kladný a pro snižující se populaci
bude záporný. Je zřejmé, že při záporném růstu
nelze druh zachovat a nakonec dojde k jeho
vyhynutí.
Mez detekovatelnosti: je nejnižší koncentrace,
v níž lze látku detekovat, nikoli však stanovit.
Mez stanovitelnosti: je nejnižší koncentrace,
v níž lze látku kvantitativně naměřit.
Mortalita: organismus se zaznamená jako mrtvý,
jeli nepohyblivý, tj. neníli schopen plavat
nebo neníli u končetin (přívěsků) nebo u
postabdomen pozorován pohyb do 15 s po lehkém
zatřepání zkušební nádobou. (Použijeli se jiná
definice, musí být uvedena společně s literární
odkazem.)
XX.1.3 PODSTATA ZKUŠEBNÍ METODY
Mladé samičí dafnie (matečné organismy) na
začátku zkoušky mladší než 24 h se exponují
zkoušené látce přidané do vody v určitém rozsahu
koncentrací. Zkouška trvá 21 dní. Na konci
zkoušky se odhadne celkový počet vylíhnutých
živých potomků pocházejících z jednoho matečného
organismu, který přežil do konce zkoušky. To
znamená, že nedospělé dafnie pocházející
z dospělých dafnií, které v průběhu zkoušky
uhynuly, se z odhadů vyloučí. Reprodukční
schopnost matečných organismů lze vyjádřit jiným
způsobem (např. jako počet živých potomků
pocházejících z jednoho matečného organismu za
den, a to od prvního dne, kdy bylo potomstvo
pozorováno), který se však uvede doplňkově vedle
celkového počtu nedospělých dafnií pocházejících
z jedné matečné dafnie živé na konci zkoušky.
Reprodukční schopnost organismů exponovaných
zkoušené látce se porovná s reprodukční
schopností kontrolní skupiny (kontrolních skupin)
s cílem stanovit nejnižší koncentraci
s pozorovanými účinky (LOEC) a tím i koncentraci
bez pozorovaných účinků (NOEC). Kromě toho se
data pokud možno analyzují pomocí regresního
modelu s cílem odhadnout koncentraci, která
vyvolává x% snížení reprodukční schopnosti, (tj.
EC
50
, EC20 nebo EC10).
Musí být rovněž uvedeno přežití matečných
organismů a okamžik narození vylíhnutí prvních
potomků. Zkoumány mohou být také jiné účinky
vyvolané látkou, které mají vliv na
charakteristiky, jako jsou růst (např. vliv na
délku) a případně imanentní růst populace.XX.1.4 INFORMACE O ZKOUŠENÉ LÁTCE
Měly by být k dispozici výsledky zkoušky akutní
toxicity (viz metoda C.2, část I) provedené u
Daphnia magna. Výsledky mohou být užitečné pro
volbu vhodného rozsahu zkušebních koncentrací ve
zkouškách toxicity pro reprodukci. Měly by být
známy rozpustnost zkoušené látky ve vodě a tlak
jejích par a měla by být k dispozici spolehlivá
analytická metoda kvantitativního stanovení látky
ve zkušebních roztocích, a to s doloženým
výtěžkem a mezí stanovitelnosti.
Užitečnými informacemi o zkoušené látce pro účely
stanovení zkušebních podmínek mohou být
strukturní vzorec, čistota látky, stálost na
světle, pKa, Pov a výsledky zkoušky snadné
biologické rozložitelnosti (viz metoda C.4).
XX.1.5 VALIDITA ZKOUŠKY
Má-li být zkouška platná, musí být u kontrolní
skupiny (kontrolních skupin) splněna následující
kriteria reprodukční schopnosti:
— mortalita matečných organismů (dafnií samičího
pohlaví) nesmí na konci zkoušky překročit
20 %,
— střední hodnota počtu živých potomků
pocházejících z jednoho matečného organismu
živého na konci zkoušky je ? 60.
XX.1.6 POPIS ZKUŠEBNÍ METODY
XX.1.6.1 Přístroje a pomůcky
Zkušební nádoby nebo jiné přístroje a pomůcky,
které přijdou do styku se zkušebními roztoky, by
měly být skleněné nebo z jiného chemicky
inertního materiálu. Zkušebními nádobami jsou
obvykle skleněné kádinky.
Kromě toho bude nezbytné některé nebo veškeré
následující zařízení:
— přístroj pro měření koncentrace kyslíku (s
mikroelektrodou, nebo jiný vhodný přístroj na
měření koncentrace rozpuštěného kyslíku ve
vzorcích malého objemu),
— vhodný přístroj pro regulaci teploty,
— pHmetr,
— vybavení pro stanovení tvrdosti vody,
— zařízení pro stanovení celkového organického
uhlíku (TOC) ve vodě nebo zařízení pro
stanovení chemické spotřeby kyslíku (CHSK),
— vhodné zařízení pro ovládání režimu osvětlení a
pro měření intenzity světla.
XX.1.6.2 Testovací organismy
Ke zkoušce se použije druh Daphnia magna Straus.
Jiné druhy dafnií mohou být použity, pokud
splňují případná kritéria validity (kriterium
validity týkající se reprodukční schopnosti
kontrolních skupin by mělo být relevantní pro
daný druh dafnií). Použijíli se jiné druhy
dafnií, musí být jasně identifikovány a jejich
použití musí být zdůvodněno.
Klon by měl být identifikován nejlépe uvedením
genotypu. Výzkum ukázal (1), že reprodukční
schopnost klonu A (který pochází z institutu
IRCHA ve Francii) (3) stabilně splňuje kriterium
validity, jímž je - 60 potomků na přeživší
matečný organismus při kultivaci za podmínek
popsaných v této metodě. Splňujeli kultura
dafnií prokazatelně kriteria validity pro tuto
zkoušku jsou přijatelné i jiné klony.
Na začátku zkoušky musí být dafnie 24 h staré a
nesmí být první generací. Musí pocházet ze zdravé
kultury (tj. nesmí vykazovat známky stresu
projevující se vysokou mortalitou, přítomnost
jedinců samčího pohlaví a epifií, zpoždění
produkce prvních potomků, přítomnost jinak
zbarvených jedinců atd.). Organismy ze zásobní
kultury musí být chovány v podmínkách podobných
těm, které mají být použity při zkoušce
(osvětlení, teplota, médium, krmení a počet
dafnií na jednotku objemu). Lišíli se kultivační
médium pro dafnie, které má být použito při
zkoušce, od média používaného k rutinní kultivaci
dafnií, doporučuje se zařadit před zkouškou
obvykle třítýdenní aklimatizační období (tj.
v délce odpovídající jedné generaci), aby nedošlo
u matečných organismů ke stresu.
XX.1.6.3 Zkušební médium
Doporučuje se, aby bylo v této zkoušce použito
přesně definované médium. Tím se lze vyhnout
použití přísad, které je obtížné charakterizovat
(např. mořských řas, půdy, extraktu atd.) a
zvýšit vyhlídky mezilaboratorní standardizace.
Jako vyhovující pro tento účel byla shledána
Elendtova média M4 (4) a M7. Přijatelná jsou však
i jiná média (např. (5, 6)), splňujeli při
jejich použití reprodukční schopnost kultury
dafnií prokazatelně kriteria validity pro tuto
zkoušku.
Použijeli se médium, které obsahuje nedostatečně
charakterizovatelné přísady, měly by být tyto
přísady jasně specifikovány a v protokolu o
zkoušce se uvedou informace o jejich složení, to
zejména o obsahu organického uhlíku, neboť může
přispívat k dodávané stravě. Doporučuje se, aby
byl stanoven celkový organický uhlík (TOC) a/nebo
chemická spotřeba kyslíku (CHSK) výchozí formy
organické přísady a aby byl odhadnut výsledný
příspěvek k TOC nebo CHSK ve zkušebním médiu.
Doporučuje se, aby byly úrovně TOC v médiu
(tj. před přidáním řas) nižší než 2 mg*l
-1
(7).
Při zkoušení látek obsahujících kovy je důležité
si uvědomit, že vlastnosti zkušebního média
(např. tvrdost, chelatační schopnosti) mohou mít
vliv na toxicitu látky. Z tohoto důvodu je
žádoucí, aby bylo médium přesně definováno.
V současnosti jsou však jedinými přesně
definovanými médii, o nichž je známo, že jsou
vhodná pro dlouhodobou kultivaci kultury druhu
Daphnia magna, Elendtova média M4 a M7. Obě média
obsahují chelatační činidlo EDTA. Práce (2)
ukázala, že provádíli se zkouška v médiích M4 a
M7, je „zdánlivá toxicita“ kadmia zpravidla nižší
než v médiu, které neobsahuje EDTA. Média M4 a M7
se tedy nedoporučují pro zkoušení látek
obsahujících kovy a neměla by se používat ani
jiná média obsahující činidla známá svojí
chelatační schopností. V případě látek
obsahujících kovy se doporučuje používat jiné
médium, například rekonstituovanou tvrdou sladkou
vodu podle ASTM (7), která neobsahuje EDTA a do
níž je přidán extrakt z řas (8). Tato kombinace
rekonstituované tvrdé sladké vody podle ASTM a
extraktu z řas je také vhodná pro dlouhodobou
kultivaci druhu Daphnia magna (2) a pro zkoušení
na tomto druhu, přestože vykazuje slabé
chelatační účinky způsobené organickými složkami
přidaného extraktu z řas.Na začátku zkoušky a v jejím průběhu by měla být
koncentrace rozpuštěného kyslíku vyšší než 3 mg*l-
1. pH by mělo být v rozmezí 6 až 9 a zpravidla by
se nemělo v žádné zkoušce měnit o více než 1,5.
Doporučuje se tvrdost nad 140 mg*l
-1
(jako CaCO3). Ve zkouškách při této a vyšší
tvrdosti reprodukční schopnost prokazatelně
vyhovovala kritériím validity (9, 10).XX.1.6.4 Zkušební roztoky
Zkušební roztoky o zvolených koncentracích se
obvykle připraví ředěním zásobního roztoku.
Zásobní roztoky se připraví nejlépe rozpuštěním
látky ve zkušebním médiu.
Pro přípravu vhodně koncentrovaného zásobního
roztoku může být někdy nezbytné použití
organických rozpouštědel nebo dispergátorů, měla
by však být vynaložena maximální snaha takové
látky nepoužívat. Ke vhodným rozpouštědlům patří
aceton, ethanol, methanol, dimethylformamid a
triethylenglykol. Ke vhodným dispergátorům patří
Cremophor RH40, 0,01% methylcellulosa a HCO-40.
V žádném případě by však neměl být obsah zkušební
látky ve zkušebních roztocích vyšší než je její
rozpustnost ve zkušebním médiu.
K přípravě zásobního roztoku, který lze přesně
dávkovat do vody, se použijí rozpouštědla. Při
doporučené koncentraci rozpouštědla v konečném
zkušebním médiu (tj. =< 0,1 ml*l
-1
) nejsou
výše uvedená rozpouštědla toxická a nezvyšují
rozpustnost látky ve vodě.Dispersanty mohou usnadnit přesné dávkování a
dispergaci. Při doporučené koncentraci v konečném
zkušebním médiu (tj. =< 0,1 ml*l
-1
) nejsou
výše uvedené dispergátory toxické a nezvyšují
rozpustnost látky ve vodě.XX.1.7 USPOŘÁDÁNÍ ZKOUŠKY
Expozice se rozvrhne pro jednotlivé zkušební
nádoby a veškeré další obsluhování zkušebních
nádob se provádí náhodně. Nedodržení této zásady
může vést k jednostrannému vychýlení, které může
být považováno za účinek koncentrace. Jsouli
například experimentální jednotky obsluhovány
v pořadí zahájení expozice nebo v pořadí
koncentrací, mohl by nějaký časově podmíněný
efekt, např. únava obsluhy nebo jiné pochybení,
vést k vyšším účinkům při vyšších koncentracích.
Mohouli být dále výsledky ovlivněny počátečními
podmínkami zkoušky nebo okolními podmínkami, jako
je např. umístění v laboratoři, mělo by být
zváženo blokové uspořádání zkoušky.
XX.1.8 POSTUP
XX.1.8.1 Podmínky expozice
XX.1.8.1.1 Délka expozice
Zkouška trvá 21 dní.
XX.1.8.1.2 Nasazování
Matečné organismy se umístí po jednom do
zkušebních nádob s 50 až 100 ml média.
Aby bylo možné splnit požadavky analytické metody
použité pro stanovení koncentrace zkoušené látky,
může být v některých případech nezbytné použít
větší objemy, přípustné je rovněž sdružování
paralelních vzorků k chemické analýze. Jsouli
použity objemy větší než 100 ml, může být
nezbytné zvýšit krmné dávky podávané dafniím, aby
se zajistila odpovídající dostupnost stravy a
splnila kritéria validity. U průtokových zkoušek
mohou být z technických důvodů zvážena jiná
uspořádání (např. čtyři skupiny po 10 organismech
ve větším zkušebním objemu), avšak jakékoli změny
uspořádání zkoušky musí být ale uvedeny
v závěrečné zprávě.
XX.1.8.1.3 Počet organismů
U semistatických zkoušek se nasadí jednotlivě
alespoň 10 organismů pro každou zkušební
koncentraci a alespoň 10 organismů jednotlivě do
zkušebních skupin.
U průtokových zkoušek se ukázalo vhodným rozdělit
pro každou koncentraci 40 organismů do čtyř
skupin po 10 organismech (1). Může být použit
menší počet zkušebních organismů, přičemž se
doporučuje na jednu koncentraci rozdělit
minimálně 20 organismů do dvou nebo více
paralelních skupin o stejném počtu organismů
(např. čtyři paralelní skupiny po pěti dafniích).
Je třeba poznamenat, že u zkoušek, při níž se
organismy nasazují jako skupiny, nebude možné
vyjádřit reprodukční schopnost jako počet živých
potomků pocházejících z jednoho matečného
organismu, který přežil do konce zkoušky
v případě, že matečný organismus uhyne. V takovém
případě se reprodukční schopnost vyjádří jako
„celkový počet živých potomků pocházejících
z jednoho matečného organismu přítomného na
začátku zkoušky“.
XX.1.8.1.4 Krmení
U semistatických zkoušek se dafnie krmí nejlépe
denně, alespoň však třikrát týdně (tj. s výměnou
média). Odchylky od této praxe (např. u
průtokových zkoušek) se uvedou ve zprávě.
Strava matečných organismů během zkoušky by měla
sestávat nejlépe z živých buněk řas jednoho nebo
více následujících druhů: Chlorella sp.,
Selenastrum capricornutum (nyní
Pseudokirchneriella subcapitata (11)) a
Scenedesmus subspicatus. Množství dodávané stravy
by mělo vycházet z množství organického uhlíku
(C) dodávaného na jeden matečný organismus.
Výzkum (12) ukázal, že u druhu Daphnia magna je
postačující pro dosažení dostatečného potomstva
nezbytného pro splnění kritérií validity množství
stravy od 0,1 do 0,2 mg C na dafnii za den.
Strava může být dodávána buď ve stejných dávkách
po celou dobu zkoušky, nebo podle požadavku
v nižších dávkách na začátku zkoušky a poté ve
zvyšujících se dávkách s ohledem na růst
matečných organismů. V takovém případě by mělo
množství stravy po celou dobu zůstat v
doporučeném rozmezí 0,1 až 0,2 mg C na dafnii za
den.
Použijeli se k určení potřebného množství stravy
zástupný ukazatel, jako je počet buněk řas nebo
absorbance ve viditelném světle, musí každá
laboratoř vytvořit vlastní nomogram vztahu
zástupného ukazatele a obsahu uhlíku v kultuře
řas (viz dodatek 2 s návodem na vytvoření
nomogramu). Nomogramy by měly být ověřovány
jednou ročně a častěji v případě, že se změní
podmínky kultivace řas. Absorbance ve viditelném
světle byla shledána lepším zástupným ukazatelem
celkového obsahu uhlíku, než počet buněk (13).
Dafniím by měla být dodávána koncentrovaná
suspenze řas, aby se minimalizoval objem
kultivačního média řas uváděný do zkušební
nádoby. Zkoncentrování řas lze dosáhnout
centrifugací a následnou resuspenzí v destilované
vodě, v deionisované vodě nebo v kultivačním
médiu dafnií.
XX.1.8.1.5 Osvětlení
16 hodin světla při intenzitě nepřekračující 15
až 20 µE m-2*s
-1
.XX.1.8.1.6 Teplota
Teplota zkušebního média by se měla pohybovat
v rozmezí 18 až 22 st.C. V žádné zkoušce by však
teplota neměla v těchto mezích kolísat o více než
2 st.C (např. 18 až 20, 19 až 21 nebo 20 až 22 st.C).
Pro účely sledování teploty může být vhodné
použít další zkušební nádobu.
XX.1.8.1.7 Provzdušňování
Zkušební nádoby nesmí být v průběhu zkoušky
provzdušňovány.
XX.1.8.2 Zkušební koncentrace
Zpravidla se použije alespoň pět zkušebních
koncentrací tvořících geometrickou řadu
s faktorem nepřekračujícím 3,2 a přiměřený počet
paralelních zkušebních skupin v rámci každé
zkušební koncentrace (viz bod 1.8.1.3). Použití
méně než pěti koncentrací by mělo být zdůvodněno.
Látky by neměly být zkoušeny pro koncentrace
vyšší, než je jejich rozpustnost ve zkušebním
médiu.
Při volbě rozsahu koncentrací by měly být
zohledněny následující zásady:
i) jeli cílem získat LOEC/NOEC, musí být
nejnižší zkušební koncentrace dostatečně
nízká, aby nebyla plodnost při této
koncentraci významně nižší, než plodnost
v kontrolní skupině. V opačném případě bude
muset být zkouška opakována se sníženou
nejnižší koncentrací;
ii) jeli cílem získat LOEC/NOEC, musí být
nejvyšší zkušební koncentrace dostatečně
vysoká, aby byla plodnost při této
koncentraci významně nižší, než plodnost
v kontrolní skupině. V opačném případě bude
muset být zkouška opakována se zvýšenou
nejvyšší koncentrací;
iii) máli být pro účinky na reprodukci odhadnuta
ECx, doporučuje se, aby byl použit dostatečný
počet koncentrací s cílem zjistit ECx
s přijatelným intervalem spolehlivosti. Jeli
znám odhad EC
50
pro účinky na reprodukci,
doporučuje se, aby byla nejvyšší zkušební
koncentrace vyšší než tato EC50
. Jinak sice
bude stále možné odhadnout EC50
, interval
spolehlivosti však bude velmi široký a nemusí
být možné uspokojivé posouzení přiměřenosti
navrženého modelu; iv) do rozsahu zkušebních koncentrací by nejlépe
neměly spadat koncentrace, které mají
statisticky významný účinek na přežití
dospělců, neboť by mohl být změněn charakter
zkoušky z pouhé zkoušky toxicity pro
reprodukci na kombinovanou zkoušku toxicity
pro reprodukci a mortality, která vyžaduje
daleko složitější statistickou analýzu.
Předcházející znalost toxicity zkoušené látky
(např. ze zkoušek akutní toxicity nebo
z orientačních studií) by měla pomoci při volbě
vhodných zkušebních koncentrací.
Použijeli se k usnadnění přípravy zásobního
roztoku rozpouštědlo nebo dispergátor (viz
bod 1.6.4), neměla by být jeho konečná
koncentrace ve zkušební nádobě vyšší než 0,1 ml*l-
1 a měla by být ve všech zkušebních nádobách
stejná.
XX.1.8.3 Kontrolní skupiny
Kromě zkušební série se nasadí jedna série
kontrolních skupin pro kontrolu zkušebního média
a podle potřeby jedna série kontrolních skupin
obsahujících rozpouštědlo nebo dispergátor.
Použijeli se rozpouštědlo nebo dispergátor, měla
by být jejich koncentrace stejná jako koncentrace
v nádobách se zkoušenou látkou. Použije se vhodný
počet paralelních skupin (viz oddíl 1.8.1.3).
V dobře vedených zkouškách by měl být variační
koeficient středního počtu živých potomků
narozených každému matečnému organismu
v kontrolní skupině (kontrolních skupinách)
zpravidla =< 25 %, a to by mělo být uvedeno v
plánu zkoušek s oddělenými jedinci.
XX.1.8.4 Obnovování zkušebního média
Častost obnovování média bude záviset na stálosti
zkoušené látky, médium se však obnovuje alespoň
třikrát týdně. Neníli podle předběžných zkoušek
stálosti (viz bod 1.4) koncentrace zkoušené látky
po maximální dobu mezi obnoveními média (tj. po
tři dny) stálá (tj. nepohybuje se v intervalu
80 – 120 % nominální koncentrace nebo klesá pod
80 % naměřené počáteční koncentrace), měl by být
zváženo častější obnovování média nebo průtoková
zkouška.
Při obnovování média v semistatických zkouškách
se připraví druhá série zkušebních nádob a
matečné organismy se do nich přenesou např.
skleněnou pipetou o vhodném průměru. Objem média
přeneseného s dafniemi by měl být co nejmenší.
XX.1.8.5 Pozorování
Výsledky pozorování prováděných během zkoušky se
zaznamenávají do přehledu dat (viz příklady
v dodatcích 3 a 4). Jsouli požadována další
měření (viz body 1.3 a 1.8.8), může být nezbytné
provádět další pozorování.
XX.1.8.6 Potomstvo
Potomstvo pocházející z každého matečného
organismu se od jeho prvního výskytu nejlépe
denně vybírá a počítá, aby nespotřebovávalo
potravu určenou pro dospělého jedince. Pro účely
této metody je třeba započítat pouze živé
potomstvo, avšak zaznamenává se i přítomnost
potracených vajíček nebo mrtvého potomstva.
XX.1.8.7 Mortalita
Mortalita matečných organismů se zaznamenává
nejlépe denně, alespoň současně s počítáním
potomstva.
XX.1.8.8 Další parametry
Třebaže je tato metoda navržena hlavně
k posouzení účinků na reprodukci, je možné, aby
byly v míře dostatečné pro statistickou analýzu
kvantifikovány i jiné účinky. Užitečné je zvláště
měření růstu, neboť poskytuje informaci o možných
subletálních účincích. Tato pozorování mohou být
užitečnější než samotné měření reprodukce.
Doporučuje se změřit na konci zkoušky délku
matečných organismů (tj. délku těla bez
zadečkového hrotu). K parametrům, které lze
měřit nebo vypočítávat patří dále doba do
narození prvních plůdků (a následně dalších
potomků), počet a velikost potomků na jeden
organismus, počet potracených plůdků, přítomnost
jedinců samčího pohlaví nebo efipií a imanentní
růst populace.
XX.1.8.9 Častost analytických stanovení a měření
Alespoň jednou týdně se měří koncentrace kyslíku,
teplota, tvrdost a pH v čerstvém a ve starém
médiu, v kontrolních nádobách a u nejvyšší
zkušební koncentrace.
Během zkoušky se v pravidelných intervalech
stanoví koncentrace zkoušené látky stanovují
U semistatických zkoušek (s obnovením média), u
nichž se má zkušební koncentrace pohybovat
v rozmezí +/-20 % nominálních hodnot (tj. od 80
do 120 % – viz body 1.4 a 1.4.8), se doporučuje
analyzovat alespoň nejvyšší a nejnižší zkušební
koncentrace na začátku studie ihned po jejich
přípravě a při obnovování, a to jednou během
prvního týdne zkoušky (tj. analýzy se provedou na
vzorku z téhož roztoku – při jeho přípravě a při
obnovování). Tato stanovení se poté opakují
alespoň v týdenních intervalech.
U zkoušek, u nichž se nepředpokládá, že se bude
koncentrace zkoušené látky pohybovat v rozmezí +/-
20 % nominální hodnoty, je nezbytné analyzovat
všechny zkušební koncentrace, a to ihned po
jejich přípravě a při obnovování. U zkoušek, u
nichž není naměřená počáteční koncentrace
zkoušené látky v rozsahu +/-20 % nominální
koncentrace, avšak u nichž lze dostatečně
prokázat, že počáteční koncentrace jsou
reprodukovatelné a stálé, (tj. od 80 do 120 %
počátečních koncentrací), by mohla být stanovení
ve 2. a 3. týdnu zkoušky omezena na nejvyšší a
nejnižší zkušební koncentrace. Ve všech případech
je stanovení koncentrací zkoušené látky před
obnovením třeba provést pro každou koncentraci
pouze u jedné paralelní nádoby.
U průtokových zkoušek je vhodný podobný
vzorkovací režim, jako je popsán u semistatických
zkoušek (v tomto případě se však neprovádí měření
„starých“ roztoků). Doporučuje se však zvýšit
počet odběrů v prvním týdnu (např. tři sady
měření) pro ujištění, že jsou zkušební
koncentrace stálé. V těchto typech zkoušky se
průtok ředicí vody a zkoušené látky kontroluje
denně.
Lze-li však prokázat, že po celou dobu zkoušky
byla koncentrace zkoušené látky uspokojivě
udržována v rozmezí +/-20 % nominální hodnoty,
mohou být výsledky založeny na nominálních nebo
naměřených počátečních hodnotách. Jeli odchylka
od nominální nebo naměřené počáteční koncentrace
větší než +/-20 %, vyjádří se výsledky jako
časově vážené průměry (viz dodatek 5).
XX.2 DATA A ZPRÁVY
XX.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Účelem této zkoušky je stanovit účinek zkoušené
látky na celkový počet živých potomků
pocházejících z jednoho matečného organismu,
který přežil do konce zkoušky. Celkový počet
potomků na matečný organismus se vypočte pro
každou zkušební nádobu (tj. pro každou paralelní
nádobu). Jestliže v kterékoli paralelní nádobě
matečný organismus během zkoušky uhyne nebo se
zjistí, že jde o samečka, vyloučí se nádoba
z experimentu. Analýza se poté provede se
zmenšeným počtem paralelních nádob.
Pro odhad LOEC a tedy i NOEC vztahujících se
k účinkům chemické látky na reprodukční
schopnosti je nezbytné vypočíst střední hodnotu
reprodukční schopnosti přes všechny paralelní
nádoby pro každou koncentraci a spojený
residuální rozptyl, a to lze provést analýzou
rozptylu (ANOVA). Střední hodnota pro každou
koncentraci musí být poté porovnána se střední
hodnotou pro kontrolní skupinu, a to vhodnou
metodou mnohonásobného porovnání. Užitečnými
mohou být Dunnettův nebo Williamsův test (14, 15,
16, 17). Je nezbytné ověřit, že je splněn
předpoklad homogenity rozptylu nezbytný pro
ANOVA. Doporučuje se provést ověření raději
graficky než formálním testem významnosti (18);
vhodnou alternativou je Bartlettův test. Neníli
tento předpoklad splněn, měla by být před
provedením ANOVA zvážena transformace dat za
účelem homogenizace rozptylu, nebo by měla být
provedena vážená ANOVA. Vypočte a uvede se
velikost účinku zjistitelná pomocí ANOVA
(tj. nejmenší významný rozdíl).
Pro odhad koncentrace, která způsobuje 50%
snížení reprodukční schopnosti (tj. EC
50
), se
daty proloží vhodná křivka (vhodné křivky), jako
např. logaritmická křivka, a to statistickou
metodou, např. metodou nejmenších čtverců nebo
nelineární metodou nejmenších čtverců. Křivka by
měla být tak parametrizována, aby bylo možné
přímo odhadnout EC50
a její směrodatnou odchylku.
To značně usnadní výpočet intervalů spolehlivosti
pro hodnotu EC50
. Pokud nejsou dobré důvody pro
upřednostnění jiných intervalů spolehlivosti,
uvede se oboustranný 95% interval spolehlivosti.
Metoda proložení by měla pokud možno umožnit
posouzení závažnosti nedostatků proložení. To lze
provést graficky nebo rozdělením residuálního
součtu čtverců na složku „chyby v proložení“ a
„náhodné chyby“ a provedením testu významnosti
chyby v proložení. Vzhledem k tomu, že u expozic,
jejichž důsledkem je vyšší reprodukční schopnost,
je větší rozptyl počtu vylíhnutých potomků než u
expozic vedoucích k nejnižší reprodukční
schopnosti, je třeba promyslet vážení
pozorovaných hodnot s cílem zohlednit různé
rozptyly u různě exponovaných skupin (viz výchozí
informace (18)). Při analýze dat z rozhodujícího okružního testu
(2) byl použit následující model prokládající
logaritmickou křivku; lze však použít i jiné
modely:
c
Y = --------
xb
1 + ---
x0
kde:
Y: celkový počet živých potomků na matečný
organismus, který přežil do konce zkoušky
(vypočteno pro každou nádobu)
x: koncentrace látky
c: očekávaný počet potomků při x = 0
x0: EC50 v populaci
b: směrnice.
Tento model bude pravděpodobně vhodný pro velký
počet situací, budou však existovat zkoušky, pro
něž bude nevhodný. Jak je uvedeno výše, je třeba
ověřit validitu modelu. V některých případech
může být vhodnější model předpokládající rozmezí,
u něhož vedou nižší koncentrace k pozitivním
účinkům (19).
Lze rovněž odhadnout další koncentrace s určitým
účinkem, např. EC
10
nebo EC20
, může být však
dobré použít jinou parametrizaci modelu, než je
použita pro odhad EC50
.XX.2.2 PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat následující
informace:
XX.2.2.1 Zkoušená látka:
— fyzikální povaha a relevantní
fyzikálněchemické vlastnosti,
— údaje o chemické identitě včetně údaje o
čistotě.
XX.2.2.2 Testovací druhy:
— klon (bylli geneticky popsán), dodavatel nebo
zdroj (jeli znám) a použité kultivační
podmínky. Bylli použit jiný druh než Daphnia
magna, musí to být uvedeno a zdůvodněno.
XX.2.2.3 Zkušební podmínky:
— použitý zkušební postup (např. semistatická
nebo průtoková metoda, objem, velikost
obsádky v počtu dafnií na litr),
— fotoperioda a intenzita světla,
— uspořádání zkoušky (např. počet paralelních
nádob, počet matečných organismů na jednu
paralelní nádobu),
— podrobnosti o použitém kultivačním médiu,
— bylyli použity, přídavky organických látek
včetně jejich složení, zdroje, metody
přípravy, TOC/CHSK výchozích preparátů, odhad
výsledného TOC/CHSK ve zkušebním médiu,
— podrobné informace o krmení, včetně množství
(v mg C na dafnii za den) a plánu (např. typ
krmiva, včetně specifického názvu (druhu) u
řas a kmene, jeli znám, kultivační
podmínky),
— metoda přípravy zásobních roztoků a častost
obnovení (jsouli použity, uvedou se
rozpouštědlo nebo dispergátor a jejich
koncentrace),
XX.2.2.4 Výsledky:
— výsledky případných předběžných studií stálosti
zkoušené látky,
— nominální zkušební koncentrace a výsledky všech
analýz pro stanovení koncentrace zkoušené
látky ve zkušebních nádobách (viz příklad
formuláře pro přehled dat v dodatku 4); uvede
se také výtěžek metody a mez stanovitelnosti,
— kvalita vody ve zkušebních nádobách (tj. pH,
teplota, koncentrace rozpuštěného kyslíku a
TOC a/nebo CHSK a dále podle potřeby tvrdost)
(viz příklad formuláře pro přehled dat
v dodatku 3),
— celkový počet živých potomků na každý matečný
organismus (viz příklad formuláře pro přehled
dat v dodatku 3),
— počet uhynulých matečných organismů a den, kdy
k úhynu došlo (viz příklad formuláře pro
přehled dat v dodatku 3),
— variační koeficient kontrolní reprodukční
schopnosti (založený na celkovém počtu živých
potomků na matečný organismus, který přežil
do konce zkoušky),
— křivka závislosti celkovém počtu živých potomků
na matečný organismus, který přežil do konce
zkoušky (pro každou paralelní nádobu), na
koncentraci zkoušené látky
— nejnižší koncentrace s pozorovanými účinky
(LOEC) na reprodukci včetně popisu použitých
statistických metod a údaje o velikosti
účinku, který by mohl být detekován, a
koncentrace bez pozorovaných účinků (NOEC) na
reprodukci; jeli k dispozici, uvede se
LOEC/NOEC pro mortalitu matečných organismů,
— jeli k dispozici, ECx pro reprodukci a
interval spolehlivosti, dále graf křivky
modelu použitého pro její výpočet, směrnice
křivky závislosti dávka-reakce a její
směrodatná odchylka,
— jiné pozorované biologické účinky a jiná
měření: uvedou se jakékoli jiné biologické
účinky, které byly pozorovány nebo změřeny
(např. růst matečných organismů) včetně
přiměřeného zdůvodnění,
— vysvětlení jakékoli odchylky od této zkušební
metody.
XX.3 LITERATURA
(1) OECD Test Guideline Programme, Report of the
Workshop on the Daphnia magna Pilot Ring
Test, Sheffield University, UK,
20. – 21. březen 1993.
(2) OECD Environmental Health and Safety
Publications. Series on Testing and
Assessment No. 6. Report of the Final Ring
Test of the Daphnia magna Reproduction Test
Paříž 1997.
(3) Baird D. J., Barber J., Bradley M. C., Soares
A. M. V. M., Calow P. (1991). A comparative
study of genotype sensitivity to acute toxic
stress using clones of Daphnia magna Strauss.
Ecotoxicol. Environ. Safety, 21,
str. 257 – 265.
(4) Elendt B. P., (1990). Selenium deficiency in
Crustacea; An ultrastructural approach to
antennal damage in Daphnia magna Straus.
Protoplasma, 154, str. 25 – 33.
(5) EPA (1993). Methods for Measuring the Acute
Toxicity of Effluents and Receiving Waters to
Freshwater and Marine Organisms. (Fourth
ed.). EPA/600/4-90/027F. C. I. Weber (ed),
USEPA, Cincinnati, Ohio.
(6) Vigano L., (1991) Suitability of commercially
available spring waters as standard medium
for culturing Daphnia magna.
Bull. Environ. Contam. Toxicol., 47,
str. 775 – 782.
(7) ASTM (1988). Standard Guide for Conducting
Acute Toxicity Tests with Fishes,
Macroinvertebrates and Amphibians. E729-88a.
American Society for Testing and Materials,
Philadelphia P.A. 20 str.
(8) Baird D. J., Soares A. M. V. M., Girling A.,
Barber J., Bradley M. C., Calow P. (1989).
The long term maintenance of Daphnia magna
Straus for use in ecotoxicological tests;
problems and prospects. In: Proceedings of
the 1st European Conference on Ecotoxicology.
Copenhagen 1988 (H.Lokke, H. Tyle & F. Bro-
Rasmussen. Eds.), str. 144 – 148.
(9) Parkhurst B. R., Forte J. L., Wright G. P.
(1981). Reproducibility of a life-cycle
toxicity test with Daphnia magna.
Bull. Environ. Contam. Toxicol., 26,
str. 1 – 8.
(10) Cowgill U. M., Milazzo D. P. (1990) The
sensitivity of two cladocerans to water
quality variables: salinity and hardness.
Arch. Hydrobiol., 120(2), str. 185 – 196.
(11) Korshikov (1990). Pseudokirchneriella
subcapitata Hindak, F-1990. Biologice Prace,
36, 209.
(12) Sims I. R., Watson S., Holmes D. (1993).
Toward a standard Daphnia juvenile production
test. Environ. Toxicol. Chem., 12,
str. 2053 – 2058.
(13) Sims I. (1993). Measuring the growth of
phytoplankton: the relationship between total
organic carbon with three commonly used
parameters of algal growth. Arch. Hydrobiol.,
128, str. 459 – 466.
(14) Dunnett C. W., (1955). A multiple
comparisons procedure for comparing several
treatments with a control.
J. Amer. Statist. Assoc., 50,
str. 1096 – 1121.
(15) Dunnett C. W., (1964). New tables for
multiple comparisons with a control.
Biometrics, 20, str. 482 – 491.
(16) Williams D. A. (1971). A test for
differences between treatment means when
several dose levels are compared with a zero
dose control. Biometrics 27, str. 103 – 117.
(17) Williams D. A. (1972). The comparison of
several dose levels with a zero dose control.
Biometrics, 28, str. 510 – 531.
(18) Draper N. R., Smith H. (1981). Applied
Regression Analysis, second edition, Wiley,
N.Y.
(19) Brain P., Cousens R. (1989). An equation to
describe dose responses where there is
stimulation of growth at low doses. Weed
Research, 29, str. 93 – 96.
(20) Wilson E. O., Bossert, W. H. (1971). A
Primer of Population Biology. Sinauer
Associates Inc. Publishers.
(21) Poole R. W. (1974). An Introduction to
quantitative Ecology. McGraw-Hill Series in
Population Biology, New York, str. 532.
(22) Meyer J. S., Ingersoll C. G., McDonald
L. L., Boyce M. S. (1986). Estimating
uncertainty in population growth rates:
Jackknife vs bootstrap techniques. Ecology,
67, str. 1156 – 1166.
DODATEK 1
PŘÍPRAVA PŘESNĚ DEFINOVANÝCH ELENDTOVÝCH MÉDIÍ M7 A M4
Aklimatizace na Elendtova média M7 M4
Některé laboratoře narazily na obtíže při přímém přenosu
dafnií do médií M4 (1) a M7. Určitého úspěchu však bylo
dosaženo postupnou aklimatizací, tj. přenesením
z vlastního média do 30% Elendtova média, poté do 60%
Elendtova média a nakonec do 100% Elendtova média. Délky
doby aklimatizace mohou být až jeden měsíc.
PŘÍPRAVA
Stopové prvky
Ve vodě vhodné čistoty, např. v deionisované nebo
destilované vodě nebo ve vodě přečištěné reverzní
osmosou, se nejprve připraví samostatné zásobní
roztoky (I) jednotlivých stopových prvků (I). Z těchto
oddělených zásobních roztoků (I) se připraví jeden
zásobní roztok (II) obsahující všechny stopové prvky
(směsný roztok), tj.:
-----------------------------------------------------------
Zásobní Množství Koncentrace Kombinovaný zásobní
roztoky I přidané roztok II se
(jednotlivá do vody (vzhledem připraví přidáním
látka) (mg*l-1) k médiu následujícího
M4) množství zásobního
(násobek) roztoku I do vody
(ml*l-1)
M 4 M 7
-----------------------------------------------------------
H3BO3 57 190 20 000 1,0 0,25
MnCl2*4H2O 7 210 20 000 1,0 0,25
LiCl 6 120 20 000 1,0 0,25
RbCl 1 420 20 000 1,0 0,25
SrCl2*6H2O 3 040 20 000 1,0 0,25
NaBr 320 20 000 1,0 0,25
Na2MoO4*2H2O 1 260 20 000 1,0 0,25
CuCl2*2H2O 335 20 000 1,0 0,25
ZnCl2 260 20 000 1,0 1,0
CoCl2*6H2O 200 20 000 1,0 1,0
KI 65 20 000 1,0 1,0
Na2SeO3 43,8 20 000 1,0 1,0
NH4VO3 11,5 20 000 1,0 1,0
Na2EDTA*2H2O 5 000 2 000 — —
FeSO4*7H2O 1 991 2 000 n — —
-----------------------------------------------------------
Jak roztok Na2EDTA, tak roztok FeSO4 se připraví
samostatně, spojí se a ihned se autoklávují. Získají se:
2 litry roztoku 1 000 20,0 5,0
Fe-EDTA
-----------------------------------------------------------
Média M4 a M7
Média M4 a M7 se připraví ze zásobního roztoku II,
makroživin a vitaminů následujícím způsobem:
-----------------------------------------------------------
Množství Koncentrace Množství zásobního
přidané roztoku přidané za
do vody (vzhledem účelem přípravy
(mg*l-1) k médiu média
M4) (ml*l-1)
(násobek)
M 4 M 7
-----------------------------------------------------------
Zásobní 20 50 50
roztok II
obsahující
kombinaci
stopových prvků
-----------------------------------------------------------
Zásobní roztok makroživin (jednotlivá látka)
-----------------------------------------------------------
CaCl2*2H2O 293 800 1 000 1,0 1,0
MgSO4*7H2O 246 600 2 000 0,5 0,5
KCl 58 000 10 000 0,1 0,1
NaHCO3 64 800 1 000 1,0 1,0
Na2SiO3*9H2O 50 000 5 000 0,2 0,2
NaNO3 2 740 10 000 0,1 0,1
KH2PO4 1 430 10 000 0,1 0,1
K2HPO4 1 840 10 000 0,1 0,1
-----------------------------------------------------------
Kombinovaný — 10 000 0,1 0,1
vitaminový
zásobní roztok
-----------------------------------------------------------
Kombinovaný vitaminový zásobní roztok se připraví
přidáním 3 vitaminů do 1 litru vody takto:
Thiaminhydro 750 10 000 — —
chlorid
Kyanokobalamin 10 10 000 — —
(B12)
Biotin 7,5 10 000 — —
-----------------------------------------------------------
Kombinovaný vitaminový zásobní roztok se uchovává
v malých hluboce zmrazených podílech. Vitaminy se přidají
do média krátce před použitím.
Poznámky: Aby nedošlo při přípravě kompletního média
k vysrážení solí, přidají se podíly zásobních
roztoků do asi 500 – 800 ml deionisované vody a
objem se poté doplní na 1 litr.
Poprvé byly informace o médiu M4 uvedeny v práci
Elendt, B. P. (1990). Selenium deficiency in
crustacea; an ultrastructural approach to
antennal damage in Daphnia magna Straus.
Protoplasma, 154, str. 25-33.
DODATEK 2
ANALÝZA CELKOVÉHO ORGANICKÉHO UHLÍKU (TOC) A VYTVOŘENÍ
NOMOGRAMU PRO OBSAH TOC V KRMIVU NA BÁZI ŘAS
Je pochopitelné, že obsah uhlíku v krmivu na bázi řas se
nebude normálně měřit přímo, ale stanoví se z korelací
(tj. z nomogramů) se zástupnými ukazateli, jako jsou
počet buněk řas nebo absorbance ve viditelném světle.
TOC by měl být stanoven spíše vysokoteplotní oxidací než
pomocí UV nebo persíranovou metodou. (Viz: The
Instrumental Determination of Total Organic Carbon, Total
Oxygen Demand and Related Determinands 1979, HMSO 1980;
49 High Holborn, London WC1V 6HB).
Pro účely vytvoření nomogramu se řasy oddělí od růstového
média centrifugací a poté se resuspendují v destilované
vodě. Zástupný ukazatel a koncentrace TOC se měří
v každém vzorku trojmo.
Provede se analýza slepého pokusu s destilovanou vodou a
jeho koncentrace TOC se odečte od koncentrace TOC ve
vzorku s řasami.
Nomogram by měl být lineární v požadovaném rozsahu
koncentrací uhlíku. Příklady jsou uvedeny níže.
Upozornění: Tyto příklady nelze pro účely přepočtu
použít; je důležité, aby si laboratoře připravily vlastní
nomogramy.
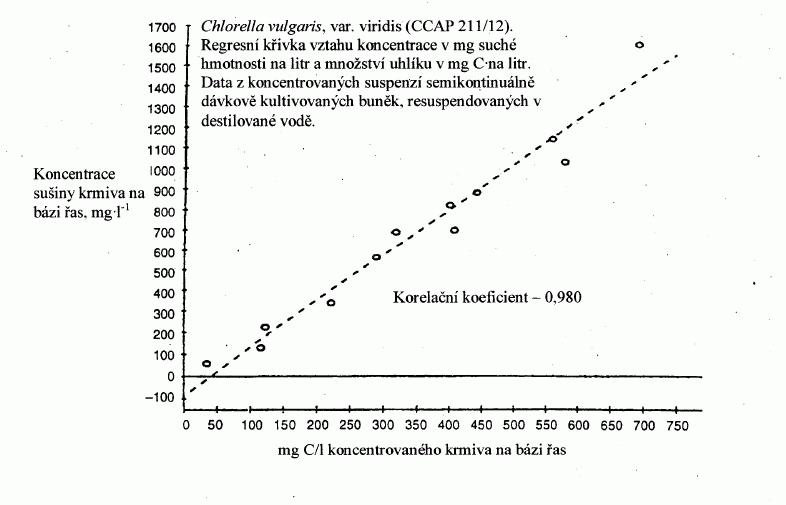
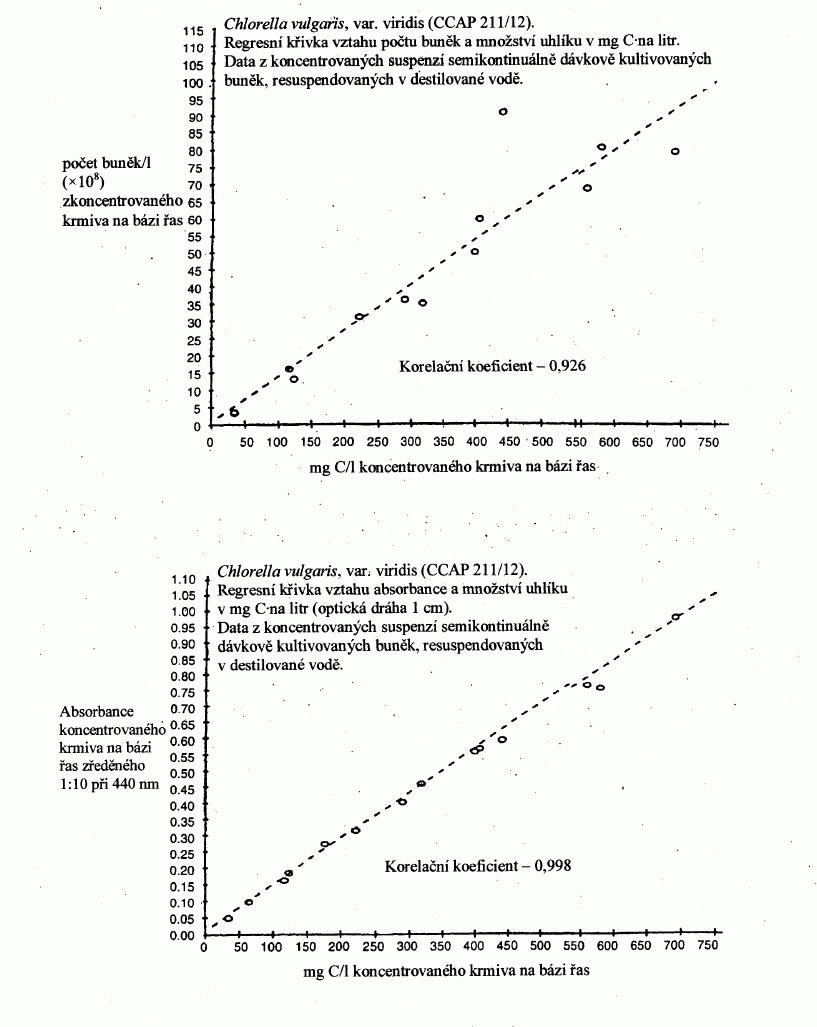
DODATEK 3
PŘÍKLAD FORMULÁŘE PŘEHLEDU DAT PRO ZAZNAMENÁNÍ OBNOVY MÉDIA, SLEDOVANÝCH
FYZIKÁLNĚCHEMICKÝCH DAT, KRMENÍ, REPRODUKČNÍ SCHOPNOSTI DAFNIÍ A MORTALITY
DOSPĚLCŮ
Experiment č.: Datum zahájení: Klon: Médium: Typ krmiva:
Zkoušená látka: Nominální koncentrace:
------------------------------------------------------------------------------- -------------------
Den 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
Obnovení média
(zaškrtněte)
pH1 nové
staré
O2 mg*l-1 (1) nové
staré
Teplota (st.C)1 nové
staré
Podání krmiva
(zaškrtněte)
Počet živých Celkem
potomků2
Nádoba 1
2
3
4
5
6
7
8
9
10
------------------------------------------------------------------------------- ------------------- Celkem
Kumulativní
mortalita dospělců3
------------------------------------------------------------------------------- -------------------
1 Uvede se, ve které nádobě bylo měření provedeno.
2 Do příslušné buňky se zaznamenají potracené plůdky jako „AB“ (aborted
broods).
3 Do příslušné buňky se zaznamená mortalita dospělců jako „M“.
DODATEK 4
PŘÍKLAD FORMULÁŘE PŘEHLEDU DAT PRO ZAZNAMENÁNÍ VÝSLEDKŮ
CHEMICKÉ ANALÝZY
a) Naměřené koncentrace
------------------------------------------------------------
Nominální Vzorek Vzorek Vzorek
koncentrace z týdne 1 z týdne 2 z týdne 3
------------------------------------------------------------
Čerstvé Staré Čerstvé Staré Čerstvé Staré
médium médium médium médium médium médium
------------------------------------------------------------
------------------------------------------------------------
b) Naměřené koncentrace vyjádřené v procentech nominální
koncentrace
------------------------------------------------------------
Nominální Vzorek Vzorek Vzorek
koncentrace z týdne 1 z týdne 2 z týdne 3
------------------------------------------------------------
Čerstvé Staré Čerstvé Staré Čerstvé Staré
médium médium médium médium médium médium
------------------------------------------------------------
------------------------------------------------------------
DODATEK 5
VÝPOČET ČASOVĚ VÁŽENÉ STŘEDNÍ HODNOTY
Časově vážená střední hodnota
Vzhledem k tomu, že mezi výměnami média může koncentrace
zkoušené látky klesat, je nezbytné zvážit, jaká koncentrace
bude považována za reprezentativní pro rozsah koncentrací, jimž
byly dospělé dafnie vystaveny. Výběr by měl být založen na
biologických i statistických úvahách. Vycházíli se například
z toho, že reprodukce je ovlivňována hlavně maximální
koncentrací, jíž byl organismus vystaven, měla by být tedy
použita maximální koncentrace. Považujeli se však za
významnější akumulované nebo dlouhodobé působení toxické látky,
má větší opodstatnění průměrná koncentrace. V takovém případě
je vhodným průměrem časově vážená střední koncentrace, neboť
zohledňuje časové změny okamžité koncentrace.
Obrázek 1: Příklad časově vážené střední hodnoty
Na obrázku 1 je znázorněn příklad (zjednodušené) zkoušky
trvající sedm dní s obnovou média v den 0, 2 a 4.
— Tenká klikatá čára znázorňuje koncentraci v kterémkoli
okamžiku. Má se za to, že pokles koncentrace sleduje
proces exponenciálního rozkladu buněk.
— Šest vyznačených bodů představuje koncentrace naměřené na
začátku a na konci období mezi obnoveními média.
— Silná plná čára vyznačuje hodnotu časově vážené střední
hodnoty.
Časově vážená střední hodnota je vypočtena tak, aby se plocha
pod čarou pro časově váženou střední hodnotu rovnala ploše pod
čarou průběhu koncentrace. Výpočet pro výše uvedený příklad je
ilustrován v tabulce 1.
Tabulka 1: Výpočet časově vážené střední hodnoty --------------------------------------------------------------- Obnovení Dny Konc0Konc1ln(Konc0) ln(Konc1) Plocha média č. --------------------------------------------------------------- 1 2 10 000 4,493 2,303 1,503 13,767 2 2 11 000 6,037 2,398 1,798 16,544 3 3 10 000 4,066 2,303 1,403 19,781 --------------------------------------------------------------- Celkový počet dnů: 7 Celková 50,091 plocha ČV 7,156 střední hodnota --------------------------------------------------------------- „Dny“ se rozumí počet dnů mezi obnoveními média. „Konc0“ je naměřená koncentrace na začátku období mezi obnoveními média. „Konc1“ je naměřená koncentrace na konci období mezi obnoveními média. „ln (Konc0)“ je přirozený logaritmus Konc0. „ln (Konc1)“ je přirozený logaritmus Konc1. „Plocha“ je plocha pod exponenciální křivkou pro každé období mezi obnoveními média. Vypočte se z rovnice: Konc0- Konc1Plocha = ---------------------- x Dny ln(Konc0) - ln (Konc1)
Časově vážená střední hodnota („ČV střední hodnota“) se vypočte
jako podíl „celkové plochy“ a „celkového počtu dnů“.
Pro zkoušku toxicity pro reprodukci na dafniích se tabulka
pochopitelně rozšíří tak, aby pokrývala 21 dnů.
Je zřejmé, že provádíli se měření pouze na začátku a na konci
období mezi obnoveními média, není možné potvrdit, že proces
rozkladu je skutečně exponenciální. Jiná křivka by vedla
k jinému způsobu výpočtu „Plochy“. Exponenciální rozklad však
není nepřijatelný a jemu odpovídající křivka je pravděpodobně
nejideálnější, chybíli jiné informace.
Je však nezbytné postupovat opatrně, neníli v médiu na konci
období mezi jeho obnoveními zjištěno žádné množství zkušební
látky. Neníli možné odhadnout, jak rychle látka z roztoku
zmizela, není možné získat realistickou plochu pod křivkou a
není tedy možné získat rozumnou časově váženou střední hodnotu.
XXI. METODA PRO STANOVENÍ AKTIVITY PŮDNÍCH
MIKROORGANISMŮ PŘI TRANSFORMACI DUSÍKU
(metoda C.21 podle přílohy směrnice 2004/73/ES ze dne 29.
dubna 2004, kterou se po dvacáté deváté přizpůsobuje
technickému pokroku směrnice Rady 67/548/EHS o sbližování
právních a správních předpisů týkajících se klasifikace,
balení a označování nebezpečných látek)
XXI.1. METODA
Tato zkušební metoda odpovídá metodě OECD TG 216
(2000).
XXI.1.1 ÚVOD
Tato zkušební metoda popisuje laboratorní postup
pro vyšetřování dlouhodobých účinků chemických
látek po jednorázové expozici na aktivitu půdních
mikroorganismů při transformaci dusíku. Je
založena na pokladech a doporučeních národních i
mezinárodních organizací (viz literatura 1 až 7).
Při posuzování a hodnocení toxických vlastností
zkoušených látek může být nezbytné stanovit
účinky na aktivitu půdních mikroorganismů, např.
jsou-li požadovány údaje o vedlejších účincích
přípravků na ochranu rostlin na půdní mikroflóru
nebo očekává-li se expozice půdních
mikroorganismů chemickým látkám jiným než
přípravkům na ochranu rostlin. Cílem zkoušky na
transformaci dusíku je zjistit účinky takových
chemických látek na půdní mikroflóru. Pokud se
zkoušejí agrochemikálie (např. přípravky na
ochranu rostlin, hnojiva, chemické přípravky pro
lesnictví), provádí se jak zkouška na
transformaci dusíku, tak zkouška na transformaci
uhlíku. Pokud se zkoušejí jiné chemické látky než
agrochemikálie, postačuje zkouška na transformaci
dusíku. Nacházejí-li se však u těchto chemických
látek hodnoty EC
50
pro transformaci dusíku
v rozpětí hodnot nacházených pro komerčně
dostupné inhibitory nitrifikace
(např. nitrapyrin), lze pro získání dalších
informací provést zkoušku na transformaci uhlíku.
Půdy se skládají z živých a neživých složek,
které se vyskytují ve formě složitých a
heterogenních směsí. Mikroorganismy hrají
důležitou roli v rozkladu a transformaci
organických látek v úrodných půdách, přičemž
různé druhy přispívají k různým aspektům
úrodnosti půdy. Jakékoli dlouhodobé porušení
těchto biochemických procesů by mohlo porušit
koloběh živin a to by mohlo mít vliv na úrodnost
půdy. K transformaci uhlíku a dusíku dochází u
všech úrodných půd. Ačkoliv se populace
mikroorganismů odpovědných za tyto procesy u
jednotlivých půd liší, jedná se v podstatě o
totéž schéma transformace.
Popsaná zkušební metoda slouží ke zjištění
dlouhodobých nepříznivých účinků látky na proces
transformace dusíku v aerobních povrchových
půdách. Tato metoda rovněž umožňuje odhadnout
účinky látek na transformaci uhlíku půdní
mikroflórou. K tvorbě dusičnanů dochází po
rozpadu vazeb uhlík-dusík. Pokud je tedy u
zkušebních a kontrolních půd zjištěna stejná
rychlost tvorby dusičnanů, je vysoce
pravděpodobné, že hlavní schéma odbourávání
uhlíku je neporušené a funkční. Substrát zvolený
pro zkoušku (prášková vojtěšková moučka) má
příznivý poměr uhlíku a dusíku (obvykle od 12/1
do 16/1). Je tedy snížen nedostatek uhlíku
v průběhu zkoušky, a dojde-li k poškození
populace mikroorganismů chemickou látkou, může
k jejich obnově dojít opět do 100 dnů.
Zkouška, na níž je založena tato zkušební metoda,
byla zprvu vyvinuta pro látky, u nichž lze
předvídat množství, které pronikne do půdy.
Příkladem jsou přípravky na ochranu rostlin, u
nichž je polní aplikační dávka známá. U
agrochemikálií postačuje provést zkoušku se dvěma
úrovněmi dávky, které odpovídají předpokládané
nebo odhadované aplikační dávce. U agrochemikálií
lze zkoušet účinné složky nebo přípravky
v komerční úpravě. Použití zkoušky však není
omezeno pouze na agrochemikálie. Změnou množství
zkoušené látky aplikované na půdu a způsobu
vyhodnocení dat lze zkoušku využít také pro
chemické látky, u nichž není známo, v jakém
množství proniknou do půdy. U jiných chemických
látek než agrochemikálií se tedy stanovuje účinek
řady koncentrací na transformaci dusíku. Data
z těchto zkoušek se použijí k sestrojení křivky
závislosti odezvy na dávce a k výpočtu hodnot
EC
x
, kde x je procentuální účinek.XXI.1.2 DEFINICE
Transformace dusíku: je konečný rozklad dusíkaté
organické látky mikroorganismy cestou amonifikace
a nitrifikace na příslušný konečný anorganický
produkt – dusičnan.
EC
x
(Účinná koncentrace): je koncentrace zkoušené
látky v půdě, která vede k x-procentní inhibici
transformace dusíku na dusičnan.EC
50
(Medián účinné koncentrace): je koncentrace
zkoušené látky v půdě, která vede k 50% inhibici
transformace dusíku na dusičnan.XXI.1.3 REFERENČNÍ LÁTKY
Žádné.
XXI.1.4 PODSTATA ZKUŠEBNÍ METODY
Do proseté půdy se vpraví prášková rostlinná
moučka a na půdu se poté aplikuje zkoušená látka,
nebo se půda ponechá nedotčená (jako kontrola).
Při zkoušení agrochemikálií se doporučuje provést
zkoušku s nejméně dvěma koncentracemi zvolenými
tak, aby byly v určitém vztahu k nejvyšší
předpokládané koncentrací na poli. Po 0, 7, 14 a
28 dnech inkubace se vzorky exponované a
kontrolní půdy vyluhují vhodným rozpouštědlem a
stanoví se obsah dusičnanů. Rychlost tvorby
dusičnanů v exponovaných vzorcích se porovnává
s rychlostí v kontrolních vzorcích a vypočte se
procentuální odchylka hodnot experimentálních
vzorků od kontrolních vzorků. Všechny zkoušky
musí probíhat alespoň 28 dnů. Jsou-li 28. den
rozdíly mezi experimentální a kontrolní půdou
25 % nebo větší, v měření se pokračuje až do 100
dnů. Při zkoušení jiných látek než agrochemikálií
se do vzorků půdy přidá řada koncentrací zkoušené
látky a množství vzniklých dusičnanů
v experimentálních a kontrolních vzorcích se měří
po 28denní inkubaci. Výsledky zkoušek s více
koncentracemi se analyzují za použití regresního
modelu a vypočtou se hodnoty EC
x
(tj. EC50
, EC25
a/nebo EC10). Viz definice.XXI.1.5 VALIDITA ZKOUŠKY
Vyhodnocení výsledků zkoušek u agrochemikálií se
provádí s relativně malými rozdíly (tj. průměrná
hodnota +-25 %) mezi koncentracemi dusičnanů
v kontrolní a exponovaných vzorcích, takže velké
kolísání u kontrolních vzorků může vést
k nesprávným výsledkům. Rozdíly mezi jednotlivými
kontrolními vzorky by proto měly být menší než
+/-15 %.
XXI.1.6 POPIS METODY
XXI.1.6.1 Zkušební zařízení
Nádoby použité ve zkoušce musí být z chemicky
inertního materiálu. Měly by mít vhodný objem,
která by měl odpovídat postupu použitému pro
inkubaci půdy, tzn. buď inkubace celého množství
půdy, nebo inkubace jednotlivých vzorků půdy (viz
oddíl 1.7.1.2). Je třeba, aby během zkoušky došlo
k co nejmenším ztrátám vody a aby byla umožněna
výměna plynů (např. tím, že se nádoby zakryjí
perforovanou polyethylenovou fólií). Při zkoušení
těkavých látek se použijí uzavřené plynotěsné
nádoby. Měly by být tak velké, aby přibližně
jedna čtvrtina jejich objemu byla zaplněna
vzorkem půdy.
Použije se standardní laboratorní vybavení, které
zahrnuje
— třepačku: mechanickou třepačku nebo
rovnocenné vybavení;
— odstředivku (3 000 g) nebo filtrační zařízení
(za použití filtračního papíru bez
dusičnanů);
— měřicí zařízení pro stanovení dusičnanů
s vhodnou citlivostí a reprodukovatelností.
XXI.1.6.2 Výběr a počet půd
Použije se jedna půda. Půda by měla mít tyto
charakteristiky:
— obsah písku: nejméně 50 % a nejvýše 75 %;
— pH: 5,5 – 7,5;
— obsah organického uhlíku: 0,5 – 1,5 %;
— stanoví se mikrobiální biomasa (viz
literatura 8, 9) a její uhlík by měl tvořit
nejméně 1 % celkového organického uhlíku
v půdě.
Ve většině případů představuje půda s těmito
charakteristikami nejkonzervativnější případ,
neboť adsorpce zkoušené chemické látky je
minimální a její dostupnost pro mikroorganismy je
maximální. V důsledku toho je zpravidla zkoušení
s dalšími půdami zbytečné. Za určitých okolností
však může být použití další půdy nezbytné,
např. při zamýšleném hlavním použití zkoušené
látky na určité druhy půd, jako jsou kyselé lesní
půdy nebo v případě elektrostaticky nabitých
chemikálií.
XXI.1.6.3 Odběr a skladování vzorků půd
XXI.1.6.3.1 Odběr
K dispozici by měly být podrobné informace o
historii místa, ze kterého je půda odebírána.
Mezi těmito informacemi musí být přesná poloha,
vegetace, údaje o ošetřování přípravky na ochranu
rostlin, použití organických a minerálních
hnojiv, přídavky biologického materiálu nebo
náhodná kontaminace. Pro odběr půdy by mělo být
zvoleno místo, které umožňuje dlouhodobé
používání. Vhodnými místy jsou trvalé pastviny,
pole s jednoletými kulturními plodinami (kromě
kukuřice) nebo hustě oseté plochy zeleného
hnojení. Místa vybraná pro odběr vzorků by neměla
být minimálně jeden rok před odběrem ošetřována
přípravky na ochranu rostlin. Rovněž by neměla
být alespoň šest měsíců použita organická
hnojiva. Použití minerálních hnojiv je přípustné
pouze tehdy, je-li to nezbytné pro plodiny, a
vzorky půdy by neměly být odebírány dříve než po
třech měsících po aplikaci. Neměly by být
používány půdy s hnojivy, o nichž je známo, že
mají biocidní účinky (např. kyanamid vápenatý).
Vzorky by neměly být odebírány při dlouhých
obdobích sucha nebo zavodnění (delších než
30 dnů) nebo po nich. Vzorky orných půd se
odebírají z hloubky 0 až 20 cm. U luk (pastvin)
nebo jiných půd, u nichž po delší dobu (alespoň
po jedno vegetační období) nebyla prováděna orba,
může maximální hloubka odběru nepatrně
překračovat 20 cm (např. až 25 cm).
Vzorky půd by měly být přepravovány v takových
nádobách a za takové teploty, aby bylo zaručeno,
že se původní vlastnosti půdy významně nezmění.
XXI.1.6.3.2 Skladování
Upřednostňuje se použití čerstvě odebrané půdy.
Pokud je skladování půdy v laboratoři
nevyhnutelné, může být skladována v temnu při
(4 +- 2) st.C maximálně po dobu tří měsíců. Během
skladování půd musí být zajištěny aerobní
podmínky. Pokud jsou půdy odebírány z oblastí,
v nichž jsou po dobu alespoň tří měsíců v roce
zmrzlé, lze zvážit šestiměsíční skladování při
18 st.C až 22 st.C. Před každým experimentem se
stanoví mikrobiální biomasa skladovaných půd a
uhlík pocházející z biomasy by měl tvořit nejméně
1 % celkového organického uhlíku v půdě (viz
oddíl 1.6.2).
XXI.1.6.4 Zacházení s půdou a její příprava pro zkoušku
XXI.1.6.4.1 Předběžná inkubace
Pokud byla půda skladována (viz oddíl 1.6.3.2),
doporučuje se provést předběžnou inkubaci v délce
2 až 28 dnů. Teplota a vlhkost půdy během
předběžné inkubace by měly být podobné podmínkám
při zkoušce (viz oddíly 1.6.4.2 a 1.7.1.3).
XXI.1.6.4.2 Fyzikálně-chemické charakteristiky
Z půdy se ručně odstraní velké kusy (např.
kameny, části rostlin atd.) a poté se za vlhka,
aniž je půda nadměrně vysoušena, prosejí částice
o velikosti 2 mm a menší. Vlhkost vzorku půdy se
upraví destilovanou nebo deionizovanou vodou na
hodnotu 40 % až 60 % maximální vodní kapacity.
XXI.1.6.4.3 Obohacení organickým substrátem
Půda by měla být obohacena vhodným organickým
substrátem, např. zelenou travní moučkou
s vojtěškou (hlavní složka: Medicago sativa)
s poměrem C/N od 12/1 do 16/1. Doporučená dávka
vojtěškové moučky je 5 g vojtěšky na kilogram
půdy (vztaženo na sušinu).
XXI.1.6.5 Příprava zkoušené látky pro aplikaci na půdu
Zkoušená látka se obvykle aplikuje pomocí nosiče.
Nosičem může být voda (u látek rozpustných ve
vodě) nebo inertní tuhá látka, např. jemný
křemičitý písek (velikost zrna: 0,1 – 0,5 mm).
Jiné kapalné nosiče než voda (např. organická
rozpouštědla jako aceton, chloroform) by neměly
být používány, neboť mohou zničit mikroflóru.
Použije-li se jako nosič písek, může být obalen
zkoušenou látkou rozpuštěnou nebo rozptýlenou ve
vhodném rozpouštědle. V takovém případě se
rozpouštědlo před smísením s půdou odstraní
odpařením. Pro optimální distribuci zkoušené
látky v půdě se doporučuje použít 10 g písku na
kilogram půdy (vztaženo na sušinu). Do
kontrolních vzorků se aplikuje pouze odpovídající
množství vody a/nebo písku.
Při zkoušení těkavých chemických látek je třeba
pokud možno zabránit ztrátám při aplikaci a
pokusit se o homogenní rozptýlení látky v půdě
(látka se např. nastříkne do půdy na více
místech).
XXI.1.6.6 Zkušební koncentrace
Při zkoušení agrochemikálií se použijí alespoň
dvě koncentrace. Nižší koncentrace by měla
odpovídat přinejmenším maximálnímu očekávanému
množství látky, které se v reálných podmínkách
dostane do půdy, zatímco vyšší koncentrace by
měla být násobkem nižší koncentrace. Výpočet
koncentrace zkoušené látky přidávané do půdy se
provede za předpokladu rovnoměrného zapravení do
hloubky 5 cm a pro sypnou hustotu půdy 1,5. U
agrochemikálií, které se aplikují přímo do půdy,
nebo u chemikálií, u nichž lze množství, které se
dostane do půdy, předpovědět, jsou doporučenými
zkušebními koncentracemi maximální předpokládané
koncentrace v životním prostředí (Predicted
Environmental Concentration, PEC) a jejich
pětinásobky. U látek, které se zpravidla aplikují
do půdy několikrát za sezónu, se zkušební
koncentrace odvodí ze součinu PEC a očekávaného
maximálního počtu aplikací. Horní koncentrace by
však neměla překročit desetinásobek maximální
jednorázově aplikované dávky. U jiných látek než
agrochemikálií se použije geometrická řada
nejméně pěti koncentrací. V rozpětí těchto
zkušebních koncentrací by se měly nacházet
stanovované hodnoty EC
x
.XXI.1.7 PROVEDENÍ ZKOUŠKY
XXI.1.7.1 Podmínky expozice
XXI.1.7.1.1 Expozice a kontrola
Při zkoušení agrochemikálií se půda rozdělí na
tři díly o stejné hmotnosti. Dva díly se smísí
s nosičem obsahujícím látku a třetí díl se smísí
pouze s nosičem (kontrola). Doporučuje se, aby
byla zkouška provedena s minimálně třemi
duplikátními vzorky exponovaných i neexponovaných
půd. Při zkoušení jiných látek než agrochemikálií
se půda rozdělí na šest dílů o stejné hmotnosti.
Pět vzorků se smísí s nosičem obsahujícím
zkoušenou látku a šestý vzorek se smísí pouze
s nosičem bez chemické látky. Doporučuje se
použít tři duplikátní vzorky exponované i
neexponované půdy. Je třeba věnovat pozornost
homogennímu rozptýlení zkoušené látky
v exponovaných vzorcích půdy. Při míšení by
nemělo docházet k hutnění nebo shlukování půdy.
XXI.1.7.1.2 Inkubace vzorků půd
Inkubaci vzorků půd lze provést dvěma způsoby: se
souhrnným vzorkem exponované půdy a souhrnným
vzorkem neexponované půdy, nebo se sériemi
jednotlivých stejně velkých dílčích vzorků jak
exponované, tak neexponované půdy. U těkavých
látek se však zkouška provádí pouze se sériemi
jednotlivých dílčích vzorků. Pokud se inkubují
souhrnné vzorky, připraví se velká množství
exponované a neexponované půdy a během zkoušky se
podle potřeby odebírají dílčí vzorky k analýze.
Výchozí množství připravené pro exponované vzorky
a kontrolní vzorky závisí na velikosti dílčích
vzorků, počtu duplikátních vzorků použitých pro
analýzu a na předpokládaném počtu intervalů,
v nichž se odeberou vzorky. Půdy inkubované jako
souhrnný vzorek se před odběrem dílčích vzorků
důkladně promísí. Pokud se inkubují série
jednotlivých vzorků půd, rozdělí se souhrnný
vzorek exponované půdy a souhrnný vzorek
neexponované půdy na požadovaný počet dílčích
vzorků a ty se použijí podle potřeby. U
experimentů, kdy lze předpokládat více než dva
intervaly odběru, by měl být připraven dostatečný
počet dílčích vzorků s ohledem na všechny
duplikátní vzorky a všechny intervaly odběru.
Alespoň tři duplikátní vzorky zkušební půdy měly
být inkubovány za aerobních podmínek (viz oddíl
1.7.1.1). U všech zkoušek by měly být použity
vhodné nádoby s dostatečným prostorem pod víkem,
aby nenastaly anaerobní podmínky. U těkavých
látek se zkouška provádí pouze se sériemi
jednotlivých dílčích vzorků.
XXI.1.7.1.3 Podmínky zkoušky a její trvání
Zkouška se provádí v temnu při pokojové teplotě
(20 +/- 2) st.C. Vlhkost vzorku půdy se udržuje po
dobu zkoušky v rozmezí 40 % až 60 % (+-5 %)
maximální vodní kapacity půdy (viz oddíl
1.6.4.2). Podle potřeby se přidává destilovaná
nebo deionizovaná voda.
Zkoušky trvají nejméně 28 dnů. Při zkouškách
agrochemikálií se porovnávají rychlosti tvorby
dusičnanů v exponovaných a kontrolních vzorcích.
Pokud se 28. dne tyto rychlosti liší o více než
25 %, pokračuje se ve zkoušce do doby, než rozdíl
klesne na 25 % a méně, nebo do 100 dnů, podle
toho, co nastane dříve. U jiných látek než
agrochemikálií se zkouška ukončí po 28 dnech.
28. den se stanoví množství dusičnanů
v exponovaných a kontrolních vzorcích a
vypočítají se hodnoty EC
x
.XXI.1.7.2 Odběry vzorků a analýzy půd
XXI.1.7.2.1 Intervaly odběru vzorků
Při zkoušení agrochemikálií se obsah dusičnanů ve
vzorcích analyzuje v 0., 7., 14. a 28. den. Pokud
se zkouška prodlužuje, provede se další měření ve
14-denních intervalech po 28. dni.
Při zkoušení jiných látek než agrochemikálií se
použije alespoň pět zkušebních koncentrací a
obsah dusičnanů se ve vzorcích půd analyzuje na
začátku expoziční doby (den 0) a na jeho konci
(po 28 dnech). Je-li to považováno za nezbytné,
lze provést další mezilehlé měření,
např. v 7. den. Data získaná 28. den se použijí
pro stanovení EC
x
chemické látky. Podle potřeby
lze data ze dne 0 u kontrolních vzorků použít ve
zprávě jako výchozí koncentraci dusičnanů v půdě.XXI.1.7.2.2 Analýza vzorků půd
Pro každý čas odběru vzorků se v exponovaných i
kontrolních vzorcích stanoví obsah dusičnanů.
Dusičnany se extrahují ze vzorků třepáním
s vhodným extrakčním roztokem, např. s 0,1M
roztokem chloridu draselného. Doporučuje se
použít 5 ml roztoku KCl na gram sušiny půdy. Při
optimální extrakci by měly být nádoby s půdou a
extrakčním roztokem naplněny nejvýše z jedné
poloviny. Směsi se extrahují třepáním při
150 ot./min. po dobu 60 minut. Směsi se odstředí
nebo zfiltrují a kapalná fáze se analyzuje na
dusičnany. Kapalný extrakt zbavený pevných částic
lze před analýzou skladovat při (20 +/-5) st.C po
dobu šesti měsíců.
XXI.2. DATA
XXI.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Při zkoušení agrochemikálií se zaznamená množství
vytvořených dusičnanů v každém duplikátním vzorku
a průměrné hodnoty se zaznamenají do tabulky.
Rychlost přeměny dusíku se vyhodnotí vhodnými
všeobecně uznávanými statistickými metodami
(např. F-testem na 5 % hladině významnosti).
Množství vzniklých dusičnanů se vyjádří v mg
dusičnanů na kg sušiny půdy za den. Rychlost
tvorby dusičnanů se pro každou expozici porovná
s rychlostí získanou pro kontrolní vzorky a
vypočte se odchylka od kontrolních vzorků
v procentech.
Při zkoušení jiných látek než agrochemikálií se
stanoví množství dusičnanů v každém duplikátním
vzorku a pro účely odhadu hodnot EC
x
se sestrojí
křivka závislosti odezvy na dávce. Množství
dusičnanů (tj. množství dusičnanů v mg na kg
sušiny půdy) zjištěná v exponovaných vzorcích po
28 dnech se porovnají s hodnotami zjištěnými u
kontrolních vzorků. Z těchto údajů se pro každou
zkušební koncentraci vypočte velikost inhibice
v procentech. Tyto hodnoty v procentech se
vynesou do grafu proti koncentraci a poté se
statistickými metodami vypočítají hodnoty ECx
.
Standardními metodami (viz literatura 10 až 12)
se rovněž vypočítají intervaly spolehlivosti
(p = 0,95) pro vypočtené hodnoty ECx
.
Zkoušené látky s vysokým obsahem dusičnanů mohou
přispívat k množství dusičnanu vytvořeného při
zkoušce. Pokud se zkouší vysoké koncentrace
těchto látek (např. chemikálie, u nichž se
očekává opakované použití), musí být součástí
zkoušky vhodné kontrolní vzorky (tj. půda a
zkoušená látka bez rostlinné moučky). Data
z těchto kontrol musí být zohledněna při
výpočtech ECx
.XXI.2.2 INTERPRETACE VÝSLEDKŮ
Pokud je při hodnocení výsledků zkoušek
s agrochemikáliemi při jakémkoli odběru po 28
dnech rozdíl rychlosti tvorby dusičnanů při nižší
expozici (tj. při maximální očekávané
koncentraci) a rychlosti tvorby v kontrolách
roven 25 % nebo nižší, lze konstatovat, že
zkoušená látka nemá dlouhodobý vliv na
transformaci dusíku v půdách. Pro hodnocení
výsledků zkoušek jiných látek než agrochemikálií
se použijí hodnoty EC
50
, EC25 a/nebo EC10.XXI.3. ZPRÁVY
Protokol o zkoušce musí obsahovat následující
informace:
Úplnou identifikaci použité půdy zahrnující
tyto údaje:
— zeměpisná poloha místa (zeměpisná šířka a
délka);
— informace a historii místa (tj. vegetační
kryt, ošetření přípravky na ochranu
rostlin, použití hnojiv, náhodná
kontaminace atd.);
— způsob využití (např. zemědělská půda,
les atd.);
— hloubka odběru vzorků (cm);
— obsah písku/prachu/jílu (v % sušiny);
— pH (ve vodě);
— obsah organického uhlíku (v % sušiny);
— obsah dusíku (v % sušiny);
— výchozí koncentrace dusičnanů
(mg dusičnanů na kg sušiny);
— kapacita iontové výměny (mmol/kg);
— mikrobiální biomasa v procentech
celkového organického uhlíku;
— odkaz na metody použité pro stanovení
každého z parametrů;
— všechny informace týkající se odběru a
skladování vzorků půd;
— podrobné údaje o případné předběžné
inkubaci půdy.
Zkoušená látka:
— fyzikální povaha a případně fyzikálně-
chemické vlastnosti;
— případně údaje o chemické identitě,
včetně strukturního vzorce, čistoty (tj.
procentuální obsah účinné složky u
přípravků na ochranu rostlin), obsahu
dusíku.
Substrát:
— zdroj substrátu;
— složení (tj. vojtěšková moučka, zelená
travní moučka s vojtěškou);
— obsah uhlíku, dusíku (v % sušiny);
— velikost síta (mm).
Zkušební podmínky:
— podrobné údaje o obohacení půdy
organickým substrátem;
— počet použitých koncentrací zkoušené
látky, popřípadě zdůvodnění volby
koncentrací;
— podrobné údaje o aplikaci zkoušené látky
na půdu;
— inkubační teplota;
— vlhkost půdy na začátku zkoušky a v jejím
průběhu;
— použitá metoda inkubace půdy
(tj. inkubace souhrnného vzorku, nebo
inkubace jednotlivých dílčích vzorků
půdy);
— počet duplikátních vzorků;
— doby odběru vzorků;
— metoda použitá pro extrakci dusičnanů
z půdy.
Výsledky:
— postup analýzy a zařízení použité pro
stanovení dusičnanů;
— jednotlivé naměřené hodnoty obsahu
dusičnanů a jejich průměrné hodnoty
v tabulkové formě;
— rozdíly mezi duplikátními vzorky u
exponovaných a kontrolních vzorků půd;
— podle potřeby vysvětlení oprav
provedených při výpočtech;
— procentuální odchylka v rychlosti tvorby
dusičnanů pro každou dobu odběru vzorků,
popřípadě hodnota EC
50
s 95% intervalem
spolehlivosti, jiné hodnoty ECx
(tj. EC25
nebo EC10
) s intervaly spolehlivost a
graf křivky závislosti odpovědi na dávce; — statistické zpracování výsledků;
— všechny informace a pozorování užitečné
pro interpretaci výsledků.
XXI.4. LITERATURA
(1) EPPO (1994). Decision-Making Scheme for the
Environmental Risk Assessment of Plant
Protection Chemicals. Chapter 7: Soil
Microflora. EPPO Bulletin 24: 1 – 16, 1994.
(2) BBA (1990). Effects on the Activity of the
Soil Microflora. BBA Guidelines for the
Official Testing of Plant Protection
Products, VI, 1 – 1 (2. vyd., 1990).
(3) EPA (1987). Soil Microbial Community Toxicity
Test. EPA 40 CFR Part 797.3700. Toxic
Substances Control Act Test Guidelines;
Proposed rule. 28. září, 1987.
(4) SETAC-Europe (1995). Procedures for assessing
the environmental fate and ecotoxicity of
pesticides, (vyd. M. R. Lynch), Pub. SETAC-
Europe, Brussels.
(5) ISO 14238 (1997). Soil Quality –
Determination of Nitrogen Mineralisation and
Nitrification in Soils and the Influence of
Chemicals on these Processes. Technical
Committee ISO/TC 190/SC 4.
(6) OECD (1995). Final Report of the OECD
Workshop on Selection of Soils/Sediments,
Belgirate, Italy, 18.-20. ledna 1995.
(7) ISO 10381-6 (1993). Soil quality – Sampling.
Guidance on the collection, handling and
storage of soil for the assessment of aerobic
microbial processes in the laboratory.
(8) ISO 14240-1 (1997). Soil quality –
Determination of soil microbial biomass -
Part 1: Substrate-induced respiration method.
(9) ISO 14240-2 (1997). Soil quality –
Determination of soil microbial biomass –
Part 2: Fumigation-extraction method.
(10) Litchfield, J. T., Wilcoxon F. (1949). A
simplified method of evaluating dose-effect
experiments. Jour. Pharmacol. Exper. Ther.,
96, 99 – 113.
(11) Finney, D. J. (1971). Probit Analysis, 3.
vyd., Cambridge, London, New York.
(12) Finney, D. J. (1978). Statistical Methods
in biological Assay. Griffin, Weycombe, UK.
XXII. METODA PRO STANOVENÍ AKTIVITY PŮDNÍCH
MIKROORGANISMŮ PŘI TRANSFORMACI UHLÍKU
(metoda C.22 podle přílohy směrnice 2004/73/ES ze dne 29.
dubna 2004, kterou se po dvacáté deváté přizpůsobuje
technickému pokroku směrnice Rady 67/548/EHS o sbližování
právních a správních předpisů týkajících se klasifikace,
balení a označování nebezpečných látek)
XXII.1.METODA
Tato metoda odpovídá metodě OECD TG 217 (2000).
XXII.1.1 ÚVOD
Tato zkušební metoda popisuje laboratorní postup
pro vyšetřování možných dlouhodobých účinků
jednorázové expozice přípravkům na ochranu
rostlin a popřípadě jiným chemický látkám na
aktivitu půdních mikroorganismů při transformaci
uhlíku. Je založena na podkladech a doporučeních
národních i mezinárodních organizací (viz
literatura 1 až 6). Při posuzování a hodnocení
toxických vlastností zkoušených látek může být
nezbytné stanovit účinky na aktivitu půdních
mikroorganismů, např. jsou-li požadovány údaje o
vedlejších účincích přípravků na ochranu rostlin
na půdní mikroflóru nebo očekává-li se expozice
půdních mikroorganismů chemickým látkám jiným než
přípravkům na ochranu rostlin. Cílem zkoušky na
transformaci uhlíku je zjistit účinky takových
chemických látek na půdní mikroflóru. Pokud se
zkoušejí agrochemikálie (např. přípravky na
ochranu rostlin, hnojiva, chemické přípravky pro
lesnictví), provádí se jak zkouška na
transformaci uhlíku, tak zkouška na transformaci
dusíku. Pokud se zkoušejí jiné chemické látky než
agrochemikálie, postačuje zkouška na transformaci
dusíku. Nacházejí-li se však u těchto chemických
látek hodnoty EC
50
pro transformaci dusíku
v rozpětí hodnot nacházených pro komerčně
dostupné inhibitory nitrifikace
(např. nitrapyrin), lze pro získání dalších
informací provést zkoušku na transformaci uhlíku.
Půdy se skládají z živých a neživých složek,
které se vyskytují ve formě složitých a
heterogenních směsí. Mikroorganismy hrají
důležitou roli v rozkladu a transformaci
organických látek v úrodných půdách, přičemž
různé druhy přispívají k různým aspektům
úrodnosti půdy. Jakékoli dlouhodobé porušení
těchto biochemických procesů by mohlo porušit
koloběh živin a to by mohlo mít vliv na úrodnost
půdy. K transformaci uhlíku a dusíku dochází u
všech úrodných půd. Ačkoliv se populace
mikroorganismů odpovědných za tyto procesy u
jednotlivých půd liší, jedná se v podstatě o
totéž schéma transformace.
Popsaná zkušební metoda slouží ke zjištění
dlouhodobých nepříznivých účinků látky na proces
transformace uhlíku v aerobních povrchových
půdách. Zkouška je citlivá na změny ve velikosti
a aktivitě mikrobiální populace, která je
odpovědná za transformaci uhlíku, neboť tyto
populace budou vystaveny jak chemickému stresu,
tak nedostatku uhlíku. Použijí se písčité půdy
s nízkým obsahem organického materiálu. Tyto půdy
se exponují zkoušené látce a inkubují se za
podmínek, které umožňují rychlý mikrobiální
metabolismus. Za těchto podmínek se zdroje snadno
dostupného uhlíku rychle vyčerpají. To způsobí
nedostatek uhlíku, který vede k nejen k odumření
mikrobiálních buněk, ale také indukuje klidové
stadium a/nebo tvorbu sporů. Pokud se zkouška
provádí déle než 28 dnů, lze souhrn těchto reakcí
měřit v kontrolních vzorcích (neexponovaná půda)
jako postupnou ztrátu metabolicky aktivní
mikrobiální biomasy (viz literatura 7). Pokud je
biomasa v půdě s nedostatkem uhlíku za podmínek
zkoušky ovlivněna přítomností chemické látky,
pravděpodobně se nevrátí do téhož stavu jako
kontrolní vzorek. Porušení stavu způsobené
zkoušenou látkou kdykoliv během zkoušky tedy
často přetrvává až do konce zkoušky.
Zkouška, na níž je založena tato zkušební metoda,
byla zprvu vyvinuta pro látky, u nichž lze
předvídat množství, které pronikne do půdy.
Příkladem jsou přípravky na ochranu rostlin, u
nichž je polní aplikační dávka známá. U
agrochemikálií postačuje provést zkoušku se dvěma
úrovněmi dávky, které odpovídají předpokládané
nebo odhadované aplikační dávce. U agrochemikálií
lze zkoušet účinné složky nebo přípravky
v komerční úpravě. Zkouška však není omezena na
chemické látky, jejichž koncentraci v životním
prostředí lze předpovědět. Změnou množství
zkoušené látky aplikované na půdu a způsobu
vyhodnocení dat lze zkoušku využít také pro
chemické látky, u nichž není známo, v jakém
množství proniknou do půdy. U jiných chemických
látek než agrochemikálií se proto stanovuje
účinek řady koncentrací na transformaci uhlíku.
Data z těchto zkoušek se použijí k sestrojení
křivky závislosti odezvy na dávce a k výpočtu
hodnot EC
x
, kde x je procentuální účinek.XXII.1.2 DEFINICE
Transformace uhlíku: je rozklad organického
materiálu působením mikroorganismů, jehož
výsledkem je anorganický konečný produkt oxid
uhličitý.
EC
x
(Účinná koncentrace): je koncentrace zkoušené
látky v půdě, která vede k x-procentní inhibici
transformace uhlíku na oxid uhličitý. EC
50
(Medián účinné koncentrace): je koncentrace
zkoušené látky v půdě, která vede k 50% inhibici
transformace uhlíku na oxid uhličitý.XXII.1.3 REFERENČNÍ LÁTKY
Žádné.
XXII.1.4 PODSTATA ZKUŠEBNÍ METODY
Prosetá půda se buď exponuje zkušební látce, nebo
se ponechá neexponovaná (kontrola). Při zkoušení
agrochemikálií se doporučuje provést zkoušku
s nejméně dvěma koncentracemi zvolenými tak, aby
byly v určitém vztahu k nejvyšší předpokládané
koncentraci na poli. Po 0, 7, 14 a 28 dnech
inkubace se vzorky exponované a kontrolní půdy
smísí s glukosou a po následujících 12 h se měří
respirační rychlost vyvolaná glukosou. Respirační
rychlost se vyjádří jako uvolněný oxid uhličitý
(v mg oxidu uhličitého na kg sušiny za hodinu)
nebo jako spotřebovaný kyslík (v mg kyslíku na kg
půdy za hodinu). Průměrná respirační rychlost u
exponovaných vzorků půd se porovná s rychlostí u
kontrolních vzorků a vypočte se procentuální
odchylka exponovaných vzorků od kontrolních
vzorků. Všechny zkoušky musí probíhat alespoň
28 dnů. Jsou-li 28. den rozdíly mezi
experimentální a kontrolní půdou rovné 25 % nebo
větší, v měření se pokračuje ve 14-denních
intervalech nejdéle do 100 dnů. Při zkoušení
jiných chemických látek než agrochemikálií se do
vzorků půdy přidá řada koncentrací zkoušené látky
a respirační rychlost vyvolaná glukosou
(tj. průměrné množství uvolněného oxidu
uhličitého nebo spotřebovaného kyslíku) se změří
po 28 dnech. Výsledky zkoušek s řadou koncentrací
se analyzují za použití regresního modelu a
vypočtou se hodnoty EC
x
(tj. EC50
, EC25 a/nebo
EC10). Viz definice.XXII.1.5 VALIDITA ZKOUŠKY
Vyhodnocení výsledků zkoušek u agrochemikálií se
provádí s relativně malými rozdíly (tj. průměrná
hodnota +-25 %) mezi uvolněným oxidem uhličitým
nebo spotřebovaným kyslíkem u kontrolních a
exponovaných vzorků, takže velké kolísání u
kontrolních vzorků může vést k nesprávným
výsledkům. Rozdíly mezi jednotlivými kontrolními
vzorky by proto měly být menší než +/-15 %.
XXII.1.6 POPIS METODY
XXII.1.6.1 Zkušební zařízení
Nádoby použité ve zkoušce musí být z chemicky
inertního materiálu. Měly by mít vhodný objem,
který by měl odpovídat postupu použitému pro
inkubaci půdy, tzn. buď inkubace souhrnného
vzorku půdy, nebo inkubace jednotlivých vzorků
půdy (viz oddíl 1.7.1.2). Je třeba, aby během
zkoušky došlo k co nejmenším ztrátám vody a aby
byla umožněna výměna plynů (např. tím, že se
nádoby zakryjí perforovanou polyethylenovou
fólií). Při zkoušení těkavých látek se použijí
uzavřené plynotěsné nádoby. Měly by být tak
velké, aby přibližně jedna čtvrtina jejich objemu
byla zaplněna vzorkem půdy.
Pro stanovení respirace vyvolané glukosou jsou
nezbytné inkubační systémy a přístroje pro měření
uvolňovaného oxidu uhličitého nebo spotřeby
kyslíku. Příklady takových systémů lze nalézt
v literatuře 8 až 11.
XXII.1.6.2 Výběr a počet půd
Použije se jedna půda. Půda by měla mít tyto
charakteristiky:
— obsah písku: nejméně 50 % a nejvýše 75 %;
— pH: 5,5 – 7,5;
— obsah organického uhlíku: 0,5 – 1,5 %;
— stanoví se mikrobiální biomasa (viz
literatura 12 a 13) a její obsah uhlíku by
měl tvořit nejméně 1 % celkového organického
uhlíku v půdě.
Ve většině případů představuje půda s těmito
charakteristikami nejkonzervativnější případ,
neboť adsorpce zkoušené chemické látky je
minimální a její dostupnost pro mikroorganismy je
maximální. V důsledku toho je zpravidla zkoušení
s dalšími půdami zbytečné. Za určitých okolností
může být nezbytné nasazení další půdy, např. při
zamýšleném hlavním použití zkoušené látky na
určité druhy půd, jako jsou kyselé lesní půdy
nebo v případě elektrostaticky nabitých
chemikálií.
XXII.1.6.3 Odběr a skladování vzorků půd
XXII.1.6.3.1 Odběr
K dispozici by měly být podrobné informace o
historii místa, ze kterého je půda odebírána.
Mezi těmito informacemi musí být přesná poloha,
vegetace, údaje o ošetřování přípravky na ochranu
rostlin, použití organických a minerálních
hnojiv, přídavky biologického materiálu nebo
náhodná kontaminace. Pro odběr půdy by mělo být
zvoleno místo, které umožňuje dlouhodobé
používání. Vhodnými místy jsou trvalé pastviny,
pole s jednoletými kulturními plodinami (kromě
kukuřice) nebo hustě oseté plochy zeleného
hnojení. Místa vybraná pro odběr vzorků by neměla
být minimálně jeden rok před odběrem ošetřována
přípravky na ochranu rostlin. Rovněž by neměla
být alespoň šest měsíců použita organická
hnojiva. Použití minerálních hnojiv je přípustné
pouze tehdy, je-li to nezbytné pro plodiny, a
vzorky půdy by neměly být odebírány dříve než po
třech měsících po aplikaci. Neměly by být
používány půdy s hnojivy, o nichž je známo, že
mají biocidní účinky (např. kyanamid vápenatý).
Vzorky by neměly být odebírány při dlouhých
obdobích sucha nebo zavodnění (delších než
30 dnů) nebo po nich. Vzorky orných půd se
odebírají z hloubky 0 až 20 cm. U luk (pastvin)
nebo jiných půd, u nichž po delší dobu (alespoň
po jedno vegetační období) nebyla prováděna orba,
může maximální hloubka odběru mírně překračovat
20 cm (např. až 25 cm). Vzorky půd by měly být
přepravovány v takových nádobách a za takové
teploty, aby bylo zaručeno, že se původní
vlastnosti půdy významně nezmění.
XXII.1.6.3.2 Skladování
Upřednostňuje se použití čerstvě odebrané půdy.
Pokud je skladování půdy v laboratoři
nevyhnutelné, může být skladována v temnu při
(4 +- 2) st.C po dobu maximálně tří měsíců. Během
skladování půd musí být zajištěny aerobní
podmínky. Pokud jsou půdy odebírány z oblastí,
v nichž jsou po dobu alespoň tří měsíců v roce
zmrzlé, lze zvážit šestiměsíční skladování při
18 st.C. Před každým experimentem se stanoví
mikrobiální biomasa skladovaných půd a uhlík
pocházející z biomasy by měl tvořit nejméně 1 %
celkového organického uhlíku v půdě (viz oddíl
1.6.2).
XXII.1.6.4 Zacházení s půdou a její příprava pro zkoušku
XXII.1.6.4.1 Předběžná inkubace
Pokud byla půda skladována (viz oddíl 1.6.3.2 a
1.7.1.3), doporučuje se provést předběžnou
inkubaci v délce 2 až 28 dnů. Teplota a vlhkost
půdy během předběžné inkubace by měly být podobné
podmínkám při zkoušce (viz oddíly 1.6.4.2 a
1.7.1.3).
XXII.1.6.4.2 Fyzikálně-chemické charakteristiky
Z půdy se ručně odstraní velké kusy (např.
kameny, části rostlin atd.) a poté se za vlhka,
aniž je půda nadměrně vysoušena, prosejí částice
o velikosti 2 mm a menší. Vlhkost vzorku půdy se
upraví destilovanou nebo deionizovanou vodou na
hodnotu 40 % až 60 % maximální vodní kapacity.
XXII.1.6.5 Příprava zkoušené látky pro aplikaci na půdu
Zkoušená látka se obvykle aplikuje pomocí nosiče.
Nosičem může být voda (u látek rozpustných ve
vodě) nebo inertní tuhá látka, např. jemný
křemičitý písek (velikost zrna: 0,1 – 0,5 mm).
Jiné kapalné nosiče než voda (např. organická
rozpouštědla jako aceton, chloroform) by neměly
být používány, neboť mohou zničit mikroflóru.
Použije-li se jako nosič písek, může být obalen
zkoušenou látkou rozpuštěnou nebo rozptýlenou ve
vhodném rozpouštědle. V takovém případě se
rozpouštědlo před smísením s půdou odstraní
odpařením. Pro optimální distribuci zkoušené
látky v půdě se doporučuje použít 10 g písku na
kilogram půdy (vztaženo na sušinu). Do
kontrolních vzorků se aplikuje pouze odpovídající
množství vody a/nebo písku.
Při zkoušení těkavých chemických látek je třeba
zabránit ztrátám při aplikaci a pokusit se o
homogenní rozptýlení látky v půdě (látka se např.
nastříkne do půdy na více místech).
XXII.1.6.6 Zkušební koncentrace
Při zkoušení přípravků na ochranu rostlin nebo
jiných chemických látek, u nichž lze předpovědět
koncentraci v životním prostředí, se použijí
alespoň dvě koncentrace. Nižší koncentrace by
měla odpovídat přinejmenším maximálnímu
očekávanému množství látky, které v reálných
podmínkách pronikne do půdy, zatímco vyšší
koncentrace by měla být násobkem nižší
koncentrace. Výpočet koncentrace zkoušené látky
přidávané do půdy se provede za předpokladu
rovnoměrného zapravení do hloubky 5 cm a pro
sypnou hustotu půdy 1,5. U agrochemikálií, které
se aplikují přímo do půdy, nebo u chemikálií, u
nichž lze množství, které se dostane do půdy,
předpovědět, jsou doporučenými zkušebními
koncentracemi předpokládané koncentrace
v životním prostředí (Predicted Environmental
Concentration, PEC) a jejich pětinásobky. U
látek, které se zpravidla aplikují do půdy
několikrát za sezónu, se zkušební koncentrace
odvodí ze součinu PEC a očekávaného maximálního
počtu aplikací. Horní koncentrace by však neměla
překročit desetinásobek maximální jednorázově
aplikované dávky.
U jiných látek než agrochemikálií se použije
geometrická řada nejméně pěti koncentrací. V
rozpětí těchto zkušebních koncentrací by se měly
nacházet stanovované hodnoty EC
x
.XXII.1.7 PROVEDENÍ ZKOUŠKY
XXII.1.7.1 Podmínky expozice
XXII.1.7.1.1 Expozice a kontrola
Při zkoušení agrochemikálií se půda rozdělí na
tři díly o stejné hmotnosti. Dva díly se smísí
s nosičem obsahujícím látku a třetí díl se smísí
pouze s nosičem (kontrola). Doporučuje se, aby
byla zkouška provedena s minimálně třemi
duplikátními vzorky exponovaných i neexponovaných
půd. Při zkoušení jiných látek než agrochemikálií
se půda rozdělí na šest dílů o stejné hmotnosti.
Pět vzorků se smísí s nosičem obsahujícím
zkoušenou látku a šestý vzorek se smísí pouze
s nosičem bez chemické látky. Doporučuje se
použít tři duplikátní vzorky exponované i
neexponované půdy. Je třeba věnovat pozornost
homogennímu rozptýlení zkoušené látky
v exponovaných vzorcích půdy. Při míšení by
nemělo docházet k hutnění nebo shlukování půdy.
XXII.1.7.1.2 Inkubace vzorků půd
Inkubaci vzorků půd lze provést dvěma způsoby: se
souhrnným vzorkem exponované půdy a souhrnným
vzorkem neexponované půdy, nebo se sériemi
jednotlivých stejně velkých dílčích vzorků jak
exponované, tak neexponované půdy. U těkavých
látek se však zkouška provádí pouze se sériemi
jednotlivých dílčích vzorků. Pokud se inkubují
souhrnné vzorky, připraví se velká množství
exponované a neexponované půdy a během zkoušky se
podle potřeby odebírají dílčí vzorky k analýze.
Výchozí množství připravené pro exponované vzorky
a kontrolní vzorky závisí na velikosti dílčích
vzorků, počtu duplikátních vzorků použitých pro
analýzu a na předpokládaném počtu intervalů,
v nichž se odeberou vzorky. Půdy inkubované jako
souhrnný vzorek se před odběrem dílčích vzorků
důkladně promísí. Pokud se inkubují série
jednotlivých vzorků půd, rozdělí se souhrnný
vzorek exponované půdy a souhrnný vzorek
neexponované půdy na požadovaný počet dílčích
vzorků a ty se použijí podle potřeby. U
experimentů, kdy lze předpokládat více než dva
intervaly odběru, by měl být připraven dostatečný
počet dílčích vzorků s ohledem na všechny
duplikátní vzorky a všechny intervaly odběru.
Alespoň tři duplikátní vzorky zkušební půdy měly
být inkubovány za aerobních podmínek (viz oddíl
1.7.1.1). U všech zkoušek by měly být použity
vhodné nádoby s dostatečným prostorem pod víkem,
aby nenastaly anaerobní podmínky. U těkavých
látek se zkouška provádí pouze se sériemi
jednotlivých dílčích vzorků.
XXII.1.7.1.3 Podmínky zkoušky a její trvání
Zkouška se provádí v temnu při pokojové teplotě
(20 +/- 2) st.C. Vlhkost vzorku půdy se udržuje po
dobu zkoušky v rozmezí 40 % až 60 % (+-5 %)
maximální vodní kapacity půdy (viz oddíl
1.6.4.2). Podle potřeby se přidává destilovaná
nebo deionizovaná voda.
Zkoušky trvají nejméně 28 dnů. Při zkouškách
agrochemikálií se porovnávají množství uvolněného
oxidu uhličitého nebo množství spotřebovaného
kyslíku u exponovaných a kontrolních vzorků.
Pokud se 28. dne tyto rychlosti liší o více než
25 %, pokračuje se ve zkoušce do doby, než rozdíl
klesne na 25 % a méně, nebo do 100 dnů, podle
toho, co nastane dříve. U jiných chemických látek
než agrochemikálií se zkouška ukončí po 28 dnech.
28. den se stanoví množství uvolněného oxidu
uhličitého nebo množství spotřebovaného kyslíku u
exponovaných a kontrolních vzorků a vypočítají se
hodnoty EC
x
.XXII.1.7.2 Odběry vzorků a analýzy půd
XXII.1.7.2.1 Intervaly odběru vzorků
Při zkoušení agrochemikálií se rychlost respirace
vyvolané glukosou ve vzorcích analyzuje 0., 7.,
14. a 28. den. Pokud se zkouška prodlužuje,
provede se další měření ve 14denních intervalech
po 28. dni.
Při zkoušení jiných látek než agrochemikálií se
použije alespoň pět zkušebních koncentrací a
obsah respirace vyvolané glukosou se ve vzorcích
půd analyzuje na začátku expoziční doby (den 0) a
na jeho konci (po 28 dnech). Je-li to považováno
za nezbytné, lze provést další mezilehlé měření,
např. 7. den. Data získaná 28. den se použijí pro
stanovení EC
x
chemické látky. V případě potřeby
lze data ze dne 0 u kontrolních vzorků použít
k odhadu výchozího množství metabolicky aktivní
mikrobiální biomasy v půdě.XXII.1.7.2.2 Měření rychlostí respirace vyvolané
glukosou
Pro každý čas odběru vzorků se v exponovaných i
kontrolních vzorcích stanoví rychlost respirace
vyvolané glukosou. Vzorky půd se smísí
s dostatečným množstvím glukosy, aby se ihned
vyvolala maximální respirační odezva. Množství
glukosy potřebné pro vyvolání maximální
respirační odezvy u dané půdy lze stanovit
v orientační zkoušce se sérií koncentrací glukosy
(viz literatura 14). U písčitých půd s obsahem
organického uhlíku od 0,5 do 1,5 % obvykle stačí
2 000 mg až 4 000 mg glukosy na kg sušiny.
Glukosu lze rozmělnit na prášek s čistým
křemenným pískem (10 g písku na kg sušiny) a
homogenně smísit s půdou.
Vzorky půdy obohacené glukosou se inkubují ve
vhodné aparatuře, která umožňuje měřit respirační
rychlosti při (20 +/- 2)st.C buď kontinuálně, nebo
každou hodinu, nebo každé dvě hodiny (viz oddíl
1.6.1). Měření uvolněného oxidu uhličitého nebo
spotřebovaného kyslíku se provádí nepřetržitě po
dobu 12 h a měření se zahájí co nejdříve, tj. do
1 až 2 h po přidání glukosy. Změří se celkové
množství uvolněného oxidu uhličitého nebo celkové
množství spotřebovaného kyslíku za 12 h a stanoví
se průměrná respirační rychlost.
XXII.2.DATA
XXII.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Při zkoušení agrochemikálií se zaznamená množství
uvolněného oxidu uhličitého nebo množství
spotřebovaného kyslíku u každého duplikátního
vzorku a průměrné hodnoty se zaznamenají do
tabulky. Výsledky se vyhodnotí vhodnými všeobecně
uznávanými statistickými metodami (např. F-testem
při 5% hladině významnosti). Rychlosti respirace
vyvolané glukosou se vyjádří v mg oxidu
uhličitého na kg sušiny za hodinu nebo
v mg kyslíku na kg sušiny za hodinu. Průměrná
rychlost uvolňování oxidu uhličitého nebo
průměrná rychlost spotřeby kyslíku u každé
expozice se porovná s odpovídajícími hodnotami u
kontrolních vzorků a vypočte se procentuální
odchylka exponovaných vzorků od kontrolních
vzorků.
Při zkoušení jiných látek než agrochemikálií se
stanoví množství uvolněného oxidu uhličitého nebo
množství spotřebovaného kyslíku v každém
duplikátním vzorku a pro účely odhadu hodnot EC
x
se sestrojí křivka závislosti odezvy na dávce.
Rychlosti respirace vyvolané glukosou (tj. mg
oxidu uhličitého na kg sušiny za hodinu nebo mg
kyslíku na kg sušiny za hodinu) zjištěné
v exponovaných vzorcích po 28 dnech se porovnají
s hodnotami zjištěnými u kontrolních vzorků.
Z těchto údajů se pro každou zkušební koncentraci
vypočte velikost inhibice v procentech. Tyto
hodnoty v procentech se vynesou proti koncentraci
a poté se statistickými metodami vypočítají
hodnoty ECx
. Standardními metodami (viz
literatura 15 až 17) se rovněž vypočítají
intervaly spolehlivosti (p = 0,95) pro vypočtené
hodnoty ECx
.XXII.2.2 INTERPRETACE VÝSLEDKŮ
Pokud je při hodnocení výsledků zkoušek
s agrochemikáliemi při kterémkoli odběru po
28 dnech rozdíl respiračních rychlostí při nižší
expozici (tj. při maximální očekávané
koncentraci) a rychlosti u kontroly roven 25 %
nebo nižší, lze konstatovat, že zkoušená látka
nemá dlouhodobý vliv na transformaci uhlíku
v půdách. Pro hodnocení výsledků zkoušek jiných
látek než agrochemikálií se použijí hodnoty EC
50
,
EC25 a/nebo EC10.XXII.3. ZPRÁVY
PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat následující
informace:
Úplnou identifikaci použité půdy zahrnující
tyto údaje:
— zeměpisná poloha místa (zeměpisná šířka a
délka);
— informace o historii místa (tj. vegetační
kryt, ošetření přípravky na ochranu
rostlin, použití hnojiv, náhodná
kontaminace atd.);
— způsob využití (např. zemědělská půda,
les atd.);
— hloubka odběru vzorků (cm);
— obsah písku/prachu/jílu (v % sušiny);
— pH (ve vodě);
— obsah organického uhlíku (v % sušiny
hmotnosti);
— obsah dusíku (v % sušiny);
— kapacita iontové výměny (mmol/kg);
— výchozí mikrobiální biomasa v procentech
celkového organického uhlíku;
— odkaz na metody použité pro stanovení
každého z parametrů;
— všechny informace týkající se odběru a
skladování vzorků půd;
— podrobné údaje o případné předběžné
inkubaci půdy.
Zkoušená látka:
— fyzikální povaha a případně její
fyzikálně-chemické vlastnosti;
— případně údaje o chemické identitě,
včetně strukturního vzorce, čistoty
(tj. procentuální obsah účinné složky u
přípravků na ochranu rostlin), obsahu
dusíku.
Zkušební podmínky:
— podrobné údaje o obohacení půdy
organickým substrátem;
— počet použitých koncentrací zkoušené
látky, popřípadě zdůvodnění volby
koncentrací;
— podrobné údaje o aplikaci zkoušené látky
na půdu;
— inkubační teplota;
— vlhkost půdy na začátku zkoušky a v jejím
průběhu;
— použitá metoda inkubace (tj. buď inkubace
souhrnného vzorku půdy, nebo inkubace
jednotlivých dílčích vzorků půdy);
— počet duplikátních vzorků;
— doby odběru vzorků
. Výsledky:
— metoda a zařízení použité pro měření
respiračních rychlostí;
— data včetně jednotlivých hodnot a
průměrných hodnot množství oxidu
uhličitého nebo kyslíku zpracovaná
v tabulkové formě;
— rozdíly mezi duplikátními vzorky u
exponovaných a kontrolních vzorků půd;
— v případě potřeby vysvětlení oprav
provedených při výpočtech;
— procentuální odchylka v rychlostech
respirace vyvolané glukosou pro každou
dobu odběru vzorků, popřípadě hodnota
EC
50
s 95% intervalem spolehlivosti, jiné
hodnoty ECx
(tj. EC25
nebo EC10
)
s intervaly spolehlivosti a graf křivky
závislosti odpovědi na dávce; — případné statistické vyhodnocení
výsledků;
— všechny informace a pozorování užitečné
pro interpretaci výsledků.
XXII.4 LITERATURA
(1) EPPO (1994). Decision-Making Scheme for the
Environmental Risk Assessment of Plant
Protection Chemicals. Chapter 7: Soil
Microflora. EPPO Bulletin 24: 1 – 16, 1994.
(2) BBA (1990). Effects on the Activity of the
Soil Microflora. BBA Guidelines for the
Official Testing of Plant Protection
Products, VI, 1 – 1 (2. vyd., 1990).
(3) EPA (1987). Soil Microbial Community Toxicity
Test. EPA 40 CFR Part 797.3700. Toxic
Substances Control Act Test Guidelines;
Proposed rule. September 28, 1987.
(4) SETAC-Europe (1995). Procedures for assessing
the environmental fate and ecotoxicity of
pesticides, vyd. M. R. Lynch, Pub. SETAC-
Europe, Brussels.
(5) OECD (1995). Final Report of the OECD
Workshop on Selection of Soils/Sediments,
Belgirate, Italy, 18.-20. ledna, 1995.
(6) ISO 10381-6 (1993). Soil quality – Sampling.
Guidance on the collection, handling and
storage of soil for the assessment of aerobic
microbial processes in the laboratory.
(7) Anderson, J. P. E. (1987). Handling and
Storage of Soils for Pesticide Experiments.
In: Pesticide Effects on Soil Microflora.
Vyd. L. Somerville, M. P. Greaves, Chap. 3:
45 – 60.
(8) Anderson, J. P. E. (1982). Soil Respiration.
In: Methods of Soil Analysis – Part 2:
Chemical and Microbiological Properties.
Agronomy Monograph N° 9. Vyd. A. L. Page,
R. H. Miller a D. R. Keeney. 41: 831 – 871.
(9) ISO 11266-1 (1993). Soil Quality – Guidance
on Laboratory Tests for Biodegradation in
Soil: Part 1. Aerobic Conditions.
(10) ISO 14239 (1997E). Soil Quality –
Laboratory incubation systems for measuring
the mineralization of organic chemicals in
soil under aerobic conditions.
(11) Heinemeyer, O., Insam, H., Kaiser, E. A.,
Walenzik, G. (1989). Soil microbial biomass
and respiration measurements; an automated
technique based on infrared gas analyses.
Plant and Soil, 116: 77 – 81.
(12) ISO 14240-1 (1997). Soil quality –
Determination of soil microbial biomass –
Part 1: Substrate-induced respiration method.
(13) ISO 14240-2 (1997). Soil quality –
Determination of soil microbial biomass –
Part 2: Fumigation-extraction method.
(14) Malkomes, H.-P. (1986). Einfluß von
Glukosemenge auf die Reaktion der Kurzzeit-
Atmung im Boden gegenüber
Pflanzenschutzmitteln, Dargestellt am
Beispiel eines Herbizide. Nachrichtenbl.
Deut. Pflanzenschutzd., Braunschweig, 38: 113
– 120.
(15) Litchfield, J. T., Wilcoxon F. (1949). A
simplified method of evaluating dose-effect
experiments. Jour. Pharmacol. Exper. Ther.,
96, 99 – 113.
(16) Finney, D. J. (1971). Probit Analysis. 3.
vyd., Cambridge, London, New York.
(17) Finney, D. J. (1978). Statistical Methods
in biological Assay. Griffin, Weycombe, UK.
XXIII. METODA PRO STANOVENÍ AEROBNÍ A ANAEROBNÍ
TRANSFORMACE CHEMICKÉ LÁTKY V PŮDĚ
(metoda C.23 podle přílohy směrnice 2004/73/ES ze dne 29.
dubna 2004, kterou se po dvacáté deváté přizpůsobuje
technickému pokroku směrnice Rady 67/548/EHS o sbližování
právních a správních předpisů týkajících se klasifikace,
balení a označování nebezpečných látek)
XXIII.1. METODA
Tato zkušební metoda odpovídá metodě OECD TG 307
(2002).
XXIII.1.1 ÚVOD
Postup popsaný v této zkušební metodě je vyvinut
pro účely hodnocení aerobní a anaerobní
transformace chemické látky v půdě. Je založen na
doporučeních a směrnicích národních a
mezinárodních organizací (viz literatura 1 až
9). Účelem experimentů je stanovit i) rychlost
transformace zkoušené látky a ii) povahu a
rychlost tvorby a rozkladu transformačních
produktů, kterým mohou být rostliny a půdní
organismy vystaveny. Tyto studie jsou požadovány
u chemických látek, které se aplikují přímo do
půdy nebo pravděpodobně mohou proniknout do
půdního ekosystému. Výsledky těchto laboratorních
studií mohou být také použity pro vypracování
postupů odběru vzorků a analýzy u podobných
polních studií.
Pro vyhodnocení způsobu transformace obvykle
postačují aerobní a anaerobní studie s jedním
druhem půdy (viz literatura 8, 10 a 11).
Rychlosti transformace se stanoví alespoň pro tři
další půdy (viz literatura 8 a 10).
Druhy zkušebních půd by měly být reprezentativní
pro environmentální podmínky, v nichž dojde
k použití látky nebo k jejímu uvolnění. Například
chemické látky, k jejichž uvolnění může dojít
v subtropickém až tropickém klimatu, by měly být
zkoušeny s ferrasoly nebo nitosoly (systém FAO).
Tato metoda se rovněž týká půd rýžových polí.
XXIII.1.2 DEFINICE
Zkoušená látka: jakákoli látka, ať již výchozí
látka, nebo příslušné transformační produkty.
Transformační produkty: všechny látky vznikající
při biotických a abiotických transformačních
reakcích zkoušené látky, včetně CO
2
a látek,
které jsou přítomny ve vázaných reziduích.
Vázaná rezidua: sloučeniny v půdě, rostlině nebo
v živočichu, které po extrakci zůstávají
v matrici ve formě výchozí látky nebo (jejího
metabolitu (jejích metabolitů) nebo
transformačních produktů. Metoda extrakce nesmí
podstatně měnit samotné sloučeniny nebo strukturu
matrice. Povahu vazeb lze částečně vyjasnit
extrakcí spojenou se změnami v matrici a
náročnými analytickými technikami. Dosud byly
tímto způsobem vyjasněny např. kovalentní,
iontové a adsorpční vazby a rovněž záchyty.
Tvorba vázaných reziduí obecně podstatně snižuje
biologickou přístupnost a dostupnost (viz
literatura 12) [upraveno podle IUPAC 1984 (viz
literatura 13)].
Aerobní transformace: reakce, ke kterým dochází
za přítomnosti kyslíku (viz literatura 14).
Anaerobní transformace: reakce probíhající
s vyloučením molekulárního kyslíku (viz
literatura 14).
Půda: směs minerálních a organických chemických
složek oživená malými organismy (většinou
mikroorganismy), přičemž organické složky
obsahují sloučeniny s vysokým obsahem uhlíku a
dusíku a vysokou molekulovou hmotností. Lze
pracovat s dvěma formami půdy:
a) s neporušenou půdou, jak v průběhu času
vznikla, s charakteristickými vrstvami
různých druhů půdy;
b) s porušenou půdou, která se obvykle vyskytuje
na obdělávaných polích v případě, že se
vzorky odebírají vyrýváním a používají se
v této zkušební metodě (viz literatura 14).
Mineralizace: úplný rozklad organické sloučeniny
na CO
2
, H2
O za aerobních podmínek a na CH4, CO2
a
H2
O za anaerobních podmínek. V souvislosti
s touto metodou, při níž se používají sloučeniny
značené radioisotopy, se mineralizací rozumí
rozsáhlý rozklad molekuly, při němž se
radioisotopy uhlíku oxidují za tvorby
odpovídajícího množství 14CO2
(viz literatura
14).Poločas: t
0,5
, je čas, za který dojde k 50%
transformaci zkoušené látky, jestliže lze
transformaci popsat kinetikou prvního řádu;
nezávisí na počáteční koncentraci.DT
50
(doba odbourání 50): doba, za kterou se
počáteční koncentrace zkoušené látky sníží o
50 %; liší se od poločasu t0,5
, pokud
transformace neprobíhá podle kinetiky prvního
řádu. DT75 (doba odbourání 75): doba, za kterou se
počáteční koncentrace zkoušené látky sníží o
75 %.
DT90 (doba odbourání 90): doba, za kterou se
počáteční koncentrace zkoušené látky sníží o
90 %.
XXIII.1.3 REFERENČNÍ LÁTKY
Referenční látky se použijí pro charakterizaci
a/nebo identifikaci transformačních produktů
spektroskopickými a chromatografickými metodami.
XXIII.1.4 POUŽITELNOST ZKOUŠKY
Tato je metoda je použitelná pro všechny chemické
látky (neznačené nebo značené radioaktivními
isotopy), pro něž je k dispozici analytická
metoda s dostatečnou správností a citlivostí. Je
použitelná pro mírně těkavé a netěkavé sloučeniny
rozpustné i nerozpustné ve vodě. Zkouška by
neměla být použita u látek, které z půdy silně
těkají (např. fumiganty, organická rozpouštědla),
a nelze je tedy v půdě udržet za experimentálních
podmínek této zkoušky.
XXIII.1.5 INFORMACE O ZKOUŠENÉ LÁTCE
Pro stanovení rychlosti transformace lze použít
jak látky neznačené radioisotopy, tak značené
látky. Značený materiál je nezbytný pro studium
způsobu transformace a pro stanovení látkové
bilance. Doporučuje se značení isotopem
14
C,
avšak užitečné mohou být i jiné isotopy, např.
13
C, 15
N, 3
H, 32
P. Značena by měla být pokud
možno nejstabilnější část (nejstabilnější části)
molekuly. Pokud například zkoušená látka obsahuje
jeden aromatický kruh, je třeba, aby byl tento
kruh označen. Pokud zkoušená látka obsahuje dva
nebo více kruhů, může být nezbytné provést
samostatné studie s cílem podchytit zbytky
každého z kruhů, a získat tak vhodné informace o
tvorbě transformačních produktů.). Čistota látky
by měla být alespoň 95 %.
Před provedením zkoušky na aerobní a anaerobní
transformaci v půdě by měly být k dispozici
alespoň tyto informace o látce:
a) rozpustnost ve vodě (metoda A.6)
b) rozpustnost v organických rozpouštědlech;
c) tlak par (metoda A.4) a Henryho konstanta;
d) rozdělovací koeficient n-oktanol/voda (metoda
A.8);
e) chemická stabilita v temnu (hydrolýza)
(metoda C.7);
f) pKa, pokud u molekuly nastává protonace nebo
deprotonace [směrnice OECD 112 ] (viz
literatura 16).
Mezi další užitečné informace patří údaje o
toxicitě zkoušené látky pro půdní mikroorganismy
[zkušební metody C.21 a C.22] (viz literatura
16).
K dispozici by měly být analytické metody (včetně
extrakčních a izolačních metod) pro kvantitativní
stanovení a identifikaci zkoušené látky a jejích
transformačních produktů.
XXIII.1.6 PODSTATA ZKUŠEBNÍ METODY
Vzorky půdy se exponují zkušební látce a inkubují
se v temnu v biometrických baňkách nebo
v průtokových systémech za řízených laboratorních
podmínek (při konstantní teplotě a vlhkosti
půdy). Ve vhodných intervalech se vzorky půd
extrahují a analyzuje se obsah výchozí látky a
transformačních produktů. Vhodným absorpčním
zařízením se k analýze shromáždí také těkavé
produkty. Prostřednictvím materiálu značeného
isotopem
14
C lze po zachycení uvolněného 14
CO2
měřit různé rychlosti mineralizace zkoušené látky
a dále lze stanovit látkovou bilanci včetně
tvorby vázaných reziduí v půdě.XXIII.1.7 KRITÉRIA JAKOSTI
XXIII.1.7.1 Výtěžnost
Extrakce a analýza provedená alespoň u dvou
duplikátních vzorků půdy ihned po přidání
zkoušené látky poskytne první informaci o
opakovatelnosti analytické metody a o
stejnoměrnosti aplikace zkoušené látky.
Výtěžnosti pozdějších stupňů experimentu se
zjistí z příslušných látkových bilancí.
Výtěžnosti by se měly nacházet v rozmezí 90 % až
110 % u značených chemických látek (viz
literatura 8) a v rozmezí 70 % až 110 % u
neznačených chemických látek (viz literatura 3).
XXIII.1.7.2 Opakovatelnost a citlivost analytické
metody
Opakovatelnost analytické metody (kromě účinnosti
první extrakce) pro kvantitativní stanovení
zkoušené látky a transformačních produktů lze
ověřit provedením analýzy duplikátních vzorků
týchž extraktů půdy, která byla dostatečně dlouho
inkubována, aby došlo k vytvoření transformačních
produktů.
Mez detekce (LOD) analytické metody pro zkoušenou
látku a pro transformační produkty by měla být
alespoň 0,01 mg na kg půdy (pro zkoušenou látku)
nebo 1 % aplikované dávky, podle toho, která
z hodnot je nižší. Rovněž by měla být
specifikována mez kvantitativní stanovitelnosti
(LOQ).
XXIII.1.7.3 Správnost dat o transformaci
Regresní analýza závislosti koncentrace zkoušené
látky na čase poskytuje vhodné informace o
spolehlivosti transformační křivky a umožňuje
vypočítat intervaly spolehlivosti pro poločasy (v
případě zdánlivé kinetiky prvního řádu) nebo pro
hodnoty DT50, popřípadě hodnot DT
75
a DT90
.XXIII.1.8 POPIS METODY
XXIII.1.8.1 Vybavení a chemická činidla
Inkubačními systémy jsou statické uzavřené
systémy nebo vhodné průtokové systémy (viz
literatura 7 a 17). Příklady vhodných průtokových
inkubačních aparatur a biometrických baněk jsou
uvedeny na obrázcích 1 a 2. Oba typy inkubačních
systémů mají své výhody a svá omezení (viz
literatura 7 a 17).
Pro zkoušku je nezbytné standardní laboratorní
vybavení, zejména:
— analytické přístroje, jako jsou GLC, HPLC,
TLC, včetně vhodných detekčních systémů pro
analýzu značených nebo neznačených látek nebo
pro inverzní isotopovou zřeďovací metodu;
— přístroje pro identifikaci látek (např. MS,
GC-MS, HPLC-MS, NMR atd.);
— kapalinový scintilační spektrometr;
— okysličovací zařízení pro spalování
radioaktivního materiálu;
— odstředivka;
— extrakční aparatura (např. centrifugační
zkumavky pro studenou extrakci a Soxhletův
přístroj pro kontinuální extrakci
s refluxem);
— zařízení pro zkoncentrování roztoků a
extraktů (např. rotační odparka);
— vodní lázeň;
— mechanické míchací zařízení (např. hnětací
zařízení, rotační mixér).
Použijí se např. tato chemická činidla:
— NaOH p.a, 2 M, nebo jiná vhodná zásada (např.
KOH, ethanolamin);
— H
2
SO4
p.a., 0,05 M; — ethylenglykol p.a.;
— tuhý absorpční materiál, např. natronové
vápno, a polyurethanové zátky;
— organická rozpouštědla čistoty p.a., např.
aceton, methanol atd.;
— kapalný scintilátor.
XXIII.1.8.2 Aplikace zkoušené látky
Za účelem aplikace zkoušené látky do půdy a
jejího rozptýlení lze zkoušenou látku rozpustit
ve vodě (v deionizované nebo destilované vodě)
nebo lze v případě potřeby použít co nejmenší
množství acetonu nebo jiných organických
rozpouštědel (viz literatura 6), ve kterých je
zkoušená látka dostatečně rozpustná a stabilní.
Zvolené množství rozpouštědla však nesmí mít
významný vliv na mikrobiální aktivitu půdy (viz
oddíly 1.5 a 1.9.2 až 1.9.3). Rozpouštědla, která
působí jako inhibitory mikrobiální aktivity,
např. chloroform, dichloromethan a jiná
halogenovaná rozpouštědla, nesmějí být použita.
Látku lze do půdy přidat také např. ve směsi
s křemenným pískem (viz literatura 6) nebo ve
formě malých dílčích vzorků zkušební půdy, které
byly předem vysušeny na vzduchu a sterilizovány.
Pokud se látka přidává pomocí rozpouštědla, mělo
by být rozpouštědlo odpařeno ještě před tím, než
jsou k původním nesterilním vzorkům půdy přidány
obohacené dílčí vzorky.
U běžně používaných chemických látek, jež se
dostávají do půdy prostřednictvím zemědělské
aplikace kalů z čistíren odpadních vod, se
zkoušená látka nejprve přidá do kalu, který se
poté vpraví do vzorku půdy (viz oddíly 1.9.2 a
1.9.3).
Nedoporučuje se používat rutinně přípravky
v komerční úpravě. Například u špatně rozpustných
látek však může být použití přípravku v komerční
úpravě vhodnou alternativou.
XXIII.1.8.3 Půdy
XXIII.1.8.3.1 Výběr půd
Pro stanovení způsobu transformace lze použít
reprezentativní půdy; doporučují se
písčitohlinitá, prachovitohlinitá, hlinitá nebo
hlinitopísčitá půda [podle klasifikace FAO a USDA
(viz literatura 18)] o hodnotě pH 5,5 až 8,0 a
obsahu organického uhlíku 0,5 – 2,5 %, přičemž
mikrobiální biomasa by měla tvořit nejméně 1 %
celkového organického uhlíku (viz literatura 10).
Pro studie transformačních rychlostí se použijí
alespoň tři další půdy reprezentující rozsah
relevantních půd. Půdy by se měly lišit, pokud
jde o obsah organického uhlíku, pH, obsah jílu a
mikrobiální biomasy (viz literatura 10).
U všech půd by měly být charakterizovány alespoň
jejich: struktura (% písku, % prachu, % jílu)
[podle klasifikace FAO a USDA (viz literatura
18)], pH, kationtová výměnná kapacita, organický
uhlík, sypná hustota, schopnost zadržet vodu a
mikrobiální biomasa (pouze pro aerobní studie).
Schopnost půdy zadržet vodu lze měřit jako polní
kapacitu, jako retenční vodní kapacitu nebo jako
vodní sací tlak (pF). Vysvětlení je uvedeno
v dodatku 1. V protokolu o zkoušce by mělo být
uvedeno, zda byly schopnost půdy zadržet vodu a
sypná hustota stanoveny u neporušených polních
vzorků, nebo porušených (zpracovaných) vzorků.
Pro interpretaci výsledků mohou být užitečné
další informace o vlastnostech půdy. Pro
stanovení charakteristik půdy lze použít metody
doporučené v literatuře (viz literatura 19 až
23). Mikrobiální biomasa se stanoví metodou
respirace indukované substrátem (SIR) (viz
literatura 25 a 26) nebo alternativními metodami
(viz literatura 20)
.XXIII.1.8.3.2 Odběr, příprava a skladování půd
K dispozici by měly být podrobné informace o
historii místa, ze kterého je půda odebírána.
Těmito informacemi jsou přesná poloha, vegetační
kryt, údaje o ošetřování chemickými látkami,
použití organických a minerálních hnojiv,
přídavky biologického materiálu nebo jiná
kontaminace. Pokud byla půda v předchozích
čtyřech letech ošetřena zkoušenou látkou nebo
látkami s analogickou strukturou, neměla by být
použita pro transformační studie (viz literatura
10 a 15).
Půda by měla být čerstvě odebraná z terénu (z A
horizontu nebo z horní 20cm vrstvy) a měla by být
tak vlhká, aby bylo možné snadné prosévání. Kromě
půd z rýžových polí by půdy neměly být odebírány
v průběhu dlouhých období (více než 30 dnů)
sucha, mrazů nebo zavodnění nebo krátce po těchto
obdobích (viz literatura 14). Vzorky se
přepravují způsobem, který minimalizuje změny
obsahu vody v půdě, a uchovávají se v temnu za co
největšího přístupu vzduchu. Pro tento účel je
obecně vhodný volně uzavřený polyethylenový
sáček.
Půda se zpracuje co nejdříve po odběru. Před
proséváním na sítu o velikosti 2 mm, při němž se
odstraní malé kameny, drobní živočichové a zbytky
rostlin, se z půdy odstraní vegetace, větší
živočichové a kameny. Před proséváním by nemělo
dojít k nadměrnému vysušení a rozdrcení půdy (viz
literatura 15).
Pokud je v zimě obtížné odebrat vzorky v terénu
(zmrzlá půda, sněhová pokrývka), mohou být
odebrány z půdy skladované ve skleníku pod
vegetačním pokryvem (např. zatravněné půdy nebo
půdy s travní směsí s jetelem). V každém případě
se upřednostňují studie s čerstvě odebranými
půdami; pokud má být odebraná a zpracovaná půda
před zahájením studie skladována, musí být
skladována za odpovídajících podmínek a pouze po
omezenou dobu (při (4 +/- 2) st.C po dobu maximálně
tří měsíců), aby byla zachována mikrobiální
aktivita. Z výsledků nedávných výzkumů vyplývá, že
půdy z mírného pásma lze skladovat při 20 st.C déle
než tři měsíce (viz literatura 28 a 29), aniž
dojde k významné ztrátě mikrobiální aktivity.
Podrobné pokyny pro odběr, zpracování a
skladování půd pro biotransformační experimenty
lze nalézt v literatuře (viz literatura 8, 10,
15, 26 a 27).
Před tím, než se zpracovaná půda použije ve
zkoušce, provede se její předběžná inkubace, aby
se umožnilo klíčení a odstranila se semena a aby
se po změnách podmínek, ke kterým došlo od odběru
nebo skladování po nastolení inkubačních
podmínek, znovu ustavila rovnováha mikrobiálního
metabolismu. Obecně postačuje předběžné inkubační
období v délce od 2 do 28 dnů při podmínkách
teploty a vlhkosti blížících se podmínkám zkoušky
(viz literatura 15). Skladování a předběžná
inkubace by dohromady neměly trvat déle než tři
měsíce.
XXIII.1.9 PROVEDENÍ ZKOUŠKY
XXIII.1.9.1 Zkušební podmínky
XXIII.1.9.1.1 Zkušební teplota
V průběhu celé zkoušky by měly být půdy
inkubovány v temnu při stálé teplotě, která je
reprezentativní pro klimatické podmínky, ve
kterých dojde k použití látky nebo k jejímu
uvolnění. Pro zkoušky všech látek, které se
dostávají do půdy v mírném klimatickém pásu, se
doporučuje teplota (20 +/- 2) st.C. Teplota musí
být monitorována.
V případě chemických látek aplikovaných nebo
uvolňovaných v chladném klimatickém pásu (např.
v severských zemích, během podzimu/zimy) se
inkubují další vzorky půdy, avšak při nižší
teplotě (např. při (10 +/- 2) st.C).
XXIII.1.9.1.2 Vlhkost
Pro účely dostatečného provzdušňování a výživy
půdní mikroflóry by půda neměla být ani příliš
vlhká, ani příliš suchá. Vlhkost půdy doporučená
pro optimální růst mikroflóry se nachází v rozmezí
od 40 % do 60 % retenční vodní kapacity a
v rozmezí od 0,1 do 0,33 bar (viz literatura 6).
Naposledy uvedený rozsah odpovídá rozsahu pF od
2,0 do 2,5. Typická vlhkost různých druhů půd je
uvedena v dodatku 2. Pro transformační zkoušky při
aerobních podmínkách se vlhkost nastaví a udržuje
na hodnotě pF od 2,0 do 2,5 (viz literatura 3).
Vlhkost půdy se vyjádří jako hmotnost vody na
jednotku hmotnosti sušiny půdy, pravidelně se
kontroluje (např. každé 2 týdny) vážením
inkubačních baněk a ztráta vody se vyrovnává
přidáním vody (nejlépe sterilně filtrované vody
z vodovodu). Při upravování vlhkosti je třeba
zabránit ztrátám zkoušené látky a/nebo
transformačních produktů v důsledku těkání nebo
případné fotodegradace, nebo je třeba tyto ztráty
minimalizovat.
V případě transformačních zkoušek za anaerobních
podmínek a za podmínek rýžového pole se půda
nasytí vodou tak, že se zaplaví.
XXIII.1.9.1.3 Podmínky aerobní inkubace
V průtokových systémech se aerobní podmínky
udržují občasným propláchnutím nebo nepřetržitým
provětráváním zvlhčeným vzduchem. V biometrických
baňkách se výměna vzduchu udržuje difuzí.
XXIII.1.9.1.4 Sterilní aerobní podmínky
Za účelem získání informací o možné abiotické
transformaci zkoušené látky lze vzorky půdy
sterilizovat (metody sterilizace jsou uvedeny
v literatuře 16 a 29), exponovat je sterilní
zkoušené látce (např. přidáváním roztoku přes
sterilní filtr) a provzdušňovat je zvlhčeným
sterilním vzduchem, jak je popsáno v oddíle
1.9.1.3. U půd z rýžových polí se půda a voda
sterilizuje a inkubace se provede způsobem
uvedeným v oddílu 1.9.1.6.
XXIII.1.9.1.5 Podmínky anaerobní inkubace
S cílem nastolit a udržovat anaerobní podmínky se
půda, která byla exponována zkoušené látce a
inkubována za aerobních podmínek 30 dnů nebo
jeden poločas nebo po dobu odpovídající DT50
(podle toho, co je kratší), zaplaví vodou (vrstva
vody 1 – 3 cm) a inkubační systém se propláchne
inertním plynem (např. dusíkem nebo argonem).
Aerobní podmínky převažují v povrchových půdách a
dokonce v podpovrchových půdách. Anaerobní
podmínky se mohou vyskytovat jen příležitostně
během zaplavení půdy po vydatných srážkách, nebo
jsou-li takové podmínky ustaveny na rýžových
polích. Zkušební systém musí umožňovat měření pH,
koncentrace kyslíku a oxidačněredukčního
potenciálu a musí být vybaven zařízením pro
zachycování těkavých produktů. Biometrický systém
musí být uzavřený, aby bylo zabráněno přístupu
vzduchu difuzí.
XXIII.1.9.1.6 Inkubace za podmínek rýžového pole
Pro účely studia transformace v půdách rýžových
polí se půda zaplaví vrstvou vody o výšce asi 1 –
5 cm a zkoušená látka se aplikuje do vodné fáze
(viz literatura 9). Doporučená tloušťka vrstvy
půdy je alespoň 5 cm. Systém se provzdušňuje
vzduchem jako za aerobních podmínek. Hodnota pH,
koncentrace kyslíku a oxidačně-redukční potenciál
vodné vrstvy se monitorují a zaznamenávají. Před
zahájením transformačních studií je nezbytné
alespoň dvoutýdenní předběžné inkubační období
(viz oddíl 1.8.3.2).
XXIII.1.9.1.7 Délka zkoušky
Studie rychlosti a způsobu transformace by neměly
za normálních podmínek trvat déle než 120 dnů (viz
literatura 3, 6 a 8), neboť poté by podle
očekávání mělo v umělém laboratorním systému
izolovaném od přirozeného doplňování postupně
docházet ke snižování mikrobiální aktivity půdy.
Aerobní studie mohou být ukončeny daleko dříve než
za 120 dnů, pokud je v dané době jasně dosaženo
konečného transformačního schématu a konečné
mineralizace. Zkoušku lze ukončit po 120 dnech,
nebo pokud se transformovalo 90 % zkoušené látky,
avšak pouze tehdy, vytvořilo-li se alespoň 5 %
CO
2
. Pokud je to nezbytné pro popis rozkladu
zkoušené látky a tvorby a rozkladu hlavních
transformačních produktů, lze studie prodloužit
(např. na 6 nebo 12 měsíců) (viz literatura 8).
Delší inkubační období by měla být zdůvodněna ve
zprávě o zkoušce a doplněna měřením biomasy během
těchto období a na jejich konci.XXIII.1.9.2 Provedení zkoušky
Do každé z inkubačních baněk se vpraví asi 50 až
200 g půdy (hmotnost sušiny) (viz obrázky 1 a 2
v dodatku 3) a půda se jednou z metod uvedených
v oddílu 1.8.2 exponuje zkoušené látce. Pokud se
pro účely aplikace zkoušené látky použijí
organická rozpouštědla, odstraní se z půdy
odpařením. Půda se poté důkladně promíchá
Zpachtlí nebo se baňka protřepe. Pokud se studie
provádí za podmínek rýžového pole, půda a voda se
po aplikaci zkoušené látky důkladně promísí. Malé
podíly (např. 1 g) exponované půdy se analyzují
na zkoušenou látku za účelem kontroly
rovnoměrnosti distribuce. Alternativní metody
jsou uvedeny níže.
Aplikované množství by mělo odpovídat nejvyššímu
aplikovanému množství přípravku na ochranu
rostlin doporučenému podle pokynů k použití a
rovnoměrnému zapravení do vhodné hloubky na poli
(např. do horní 10cm vrstvy půdy.
Výpočet výchozí koncentrace na základě plochy se
provede takto:
A[kg/ha].106 [mg/kg]
Cpuda = ------------------------------------
l[m].104 [m2/ha].d[kgpuda/m3]
C
půda
= výchozí koncentrace v půdě [mg*kg1
];
A = aplikační dávka [kg*ha1
]; l = tloušťka půdní
vrstvy na poli [m], d = sypná hustota suché půdy
[kg*m-3
]. Zhruba platí, že aplikační dávka
1 kg*ha1
vede ke koncentraci v půdě přibližně
1 mg*kg1
v 10cm vrstvě (při předpokládané sypné
hustotě 1 g*cm-3
).Například u chemických látek
aplikovaných na list nebo do půdy bez zapravení
se pro výpočet množství chemické látky, které je
třeba přidat do každé baňky, použije hloubka
vrstvy půdy 2,5 cm. U chemických látek
zapravovaných do půdy je příslušná hloubka
specifikována v pokynech pro použití. U
chemických látek obecně by mělo být aplikované
množství odhadnuto na základě hlavní cesty vstupu
do půdy; jsou-li například hlavní cestou vstupu
do půdy kaly z čistíren odpadních vod, měla by
být chemická látka přidána do kalu v koncentraci,
která odráží očekávanou koncentraci v kalu, a
množství kalu zapravené do půdy by mělo odpovídat
normálnímu množství kalu zapravovanému do
zemědělských půd. Pokud tato koncentrace není
dostatečná pro identifikaci hlavních
transformačních produktů, může napomoci inkubace
samostatných půdních vzorků obsahujících vyšší
koncentrace, avšak neměly by být používány
nadměrné koncentrace, které mají vliv na
mikrobiální funkce (viz oddíly 1.5 a 1.8.2). Jinou možností je expozice velké dávky půdy
(tj. 1 až 2 kg), její důkladné promísení vhodným
míchacím zařízením a přenesení malých podílů o
hmotnosti 50 až 200 g do inkubačních baněk (např.
pomocí děliče vzorku). Malé podíly (např. 1 g)
exponované půdy se analyzují na zkoušenou látku
za účelem kontroly rovnoměrné distribuce. Takový
postup se upřednostňuje, neboť umožňuje
stejnoměrnější rozptýlení zkoušené látky v půdě.
Neexponované vzorky se inkubují za stejných
podmínek (aerobních) jako vzorky exponované
zkoušené látce. Tyto vzorky se použijí pro
stanovení biomasy během studií a na jejich konci.
Pokud se látka aplikuje do půdy rozpuštěná
v organickém rozpouštědle (organických
rozpouštědlech), inkubují se vzorky půdy
vystavené témuž množství rozpouštědla
(rozpouštědel) za týchž (aerobních) podmínek jako
vzorky exponované zkoušené látce. Tyto vzorky se
použijí pro stanovení biomasy na začátku studií,
v jejich průběhu a na jejich konci za účelem
kontroly účinků rozpouštědla (rozpouštědel) na
mikrobiální biomasu.
Baňky obsahující exponovanou půdu se buď zapojí
do průtokového systému popsaného na obrázku 1,
nebo se uzavřou absorbční kolonou, jak je uvedeno
na obrázku 2 (viz dodatek 3).
XXIII.1.9.3 Odběr vzorků a měření
V příslušných časových intervalech se vyberou
duplikátní inkubační baňky, vzorky půd se
extrahují vhodnými rozpouštědly různé polarity a
analyzují na zkoušenou látku a/nebo na
transformační produkty. V dobře založených
studiích je k dispozici dostatečný počet baněk,
aby bylo možné ke každému odběru vybrat dvě
baňky. V různých časových intervalech (v 7denních
intervalech během prvního měsíce a po prvním
měsíci v 17denních intervalech) během inkubace
každého vzorku půdy a dále na konci inkubace se
také odeberou absorpční roztoky nebo tuhé
absorpční materiály a analyzují se na těkavé
produkty. Kromě vzorku půdy odebraného ihned po
aplikaci (vzorek ze dne 0) se provede alespoň
dalších 5 odběrů. Časové intervaly se zvolí tak,
aby bylo možné stanovit schéma rozkladu zkoušené
látky a způsob tvorby a rozkladu transformačních
produktů (např. po 0, 1, 3, 7 dnech; po 2, 3
týdnech; po 1, 2, 3 měsících atd.).
V případě zkoušené látky značené isotopem
14
C se
spálením kvantitativně stanoví neextrahovatelná
radioaktivita a pro každý vzorkovací interval se
vypočte látková bilance. V případě anaerobní inkubace nebo inkubace za
podmínek rýžového pole se půda a vodná fáze
analyzují na zkoušenou látku a transformační
produkty buď společně, nebo se před extrakcí a
analýzou oddělí filtrací nebo centrifugací.
XXIII.1.9.4 Nepovinné zkoušky
Pro odhad vlivu teploty a vlhkosti půdy na
rychlosti transformace zkoušené látky a/nebo
jejích transformačních produktů v půdě mohou být
užitečné aerobní nesterilní studie při další
teplotě nebo vlhkosti půdy.
O další charakterizaci neextrahovatelné
radioaktivity se lze pokusit například použitím
metody extrakce tekutinou v nadkritickém stavu.
XXIII.2. DATA
XXIII.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Pro každý vzorkovací interval se uvede množství
zkoušené látky, transformačních produktů,
těkavých látek (pouze v %) a neextrahovatelných
látek v procentech výchozí koncentrace, popřípadě
v mg na kg půdy (na hmotnost sušiny). Pro každý
vzorkovací interval se uvede látková bilance
v procentech výchozí koncentrace. Grafické
znázornění závislosti koncentrace zkoušené látky
na čase umožní provést odhad jejího poločasu
transformace nebo hodnoty DT
50
. Měly by být
identifikovány hlavní transformační produkty a
měly by být také sestrojeny křivky jejich
závislosti na čase, aby se ukázala rychlost
jejich tvorby a rozkladu. Hlavním transformačním
produktem je jakýkoli produkt, který kdykoli
během studie představuje >= 10 % aplikované
dávky.
Zachycené těkavé produkty jsou určitým ukazatelem
těkavosti zkoušené látky a jejích transformačních
produktů z půdy.
Přesnější stanovení poločasů nebo hodnot DT
50
a
popřípadě hodnot DT75 a DT90 se provede výpočtem
za použití vhodného modelu kinetiky. Společně
s hodnotami poločasu a DT50 se uvede popis
použitého modelu kinetiky, řád kinetiky a
koeficient determinace (r2
). Pokud není r2
< 0,7,
upřednostňuje se kinetika prvního řádu. Podle
možnosti se výpočty použijí také na hlavní
transformační produkty. Příklady vhodných modelů
jsou popsány v literatuře 31 až 35. V případě studií rychlosti prováděných při
různých teplotách se závislost rychlosti
transformace na teplotě popíše v rozsahu
experimentálních teplot pomocí Arrheniovy
rovnice:
B
k = A.e-B/T nebo lnk = lnA - --
T
kde ln A a B jsou regresní konstanty získané
z úseku na ose y a ze směrnice regresní přímky
závislosti ln k na 1/T, kde k je rychlostní
konstanta při teplotě T a T je teplota
v Kelvinech. Je třeba věnovat pozornost omezení
rozsahu teplot, v němž platí Arrheniova rovnice,
jestliže transformaci určuje mikrobiální činnost.
XXIII.2.2 HODNOCENÍ A INTERPRETACE VÝSLEDKŮ
Přestože se studie provádějí v umělém
laboratorním systému, umožňují výsledky odhadnout
rychlost transformace zkoušené látky a rovněž
rychlost tvorby a rozkladu transformačních
produktů za polních podmínek (viz literatura 36 a
37).
Studie transformačního způsobu zkoušené látky
poskytuje informaci o způsobu, jakým se mění
struktura aplikované látky v půdě působením
chemických a mikrobiálních reakcí.
XXIII.3. ZPRÁVY
XXIII.3.1 PROTOKOL O ZKOUŠCE
Protokol o zkoušce musí obsahovat tyto údaje:
Zkoušená látka:
— obecný název, chemický název, číslo CAS,
strukturní vzorec (s uvedení polohy značícího
atomu (značících atomů) při použití
radionuklidů) a relevantní fyzikálně-chemické
vlastnosti (viz oddíl 1.5);
— čistota zkoušené látky (obsah nečistot);
— popřípadě radiochemická čistota značené
chemické látky a specifická aktivita;
Referenční látky:
chemický název a struktura referenčních látek
použitých k charakterizaci a/nebo
identifikaci transformačního produktu;
Zkušební půdy:
— podrobné údaje o místě odběru;
— datum a postup odběru vzorků půdy;
— vlastnosti půdy, např. pH, obsah organického
uhlíku, struktura (% písku, % prachu,
% jílu), kationtová výměnná kapacita, sypná
hustota, schopnost zadržet vodu a mikrobiální
biomasa;
— doba skladování půdy a podmínky skladování
(pokud byla skladována);
Zkušební podmínky:
— datum provedení studií;
— množství aplikované zkoušené látky;
— použitá rozpouštědla a metoda aplikace
zkoušené látky;
— hmotnost exponované půdy na začátku zkoušky a
hmotnost půdy odebírané pro analýzu v každém
intervalu;
— popis použitého inkubačního systému;
— rychlosti průtoku vzduchu (pouze u
průtokových systémů);
— zkušební teplota;
— vlhkost půdy během inkubace;
— mikrobiální biomasa na začátku aerobních
studií, během nich a na jejich konci;
— pH, koncentrace kyslíku a oxidačně-redukční
potenciál na začátku anaerobních studií a
studií za podmínek rýžového pole, během nich
a na jejich konci;
— metoda (metody) extrakce;
— metody kvantitativního stanovení a
identifikace zkoušené látky a hlavních
transformačních produktů v půdě a
v absorpčních materiálech;
— počet duplikátních vzorků a počet kontrol.
Výsledky:
— výsledky stanovení mikrobiální aktivity;
— opakovatelnost a citlivost použitých
analytických metod;
— hodnoty výtěžnosti (hodnoty v % pro platnou
studii jsou uvedeny v oddíle 1.7.1);
— tabulky s výsledky vyjádřenými v % výchozí
aplikované dávky, popřípadě v mg na kg půdy
(vztaženo na hmotnost sušiny půdy);
— látková bilance během studií a na jejich
konci;
— charakterizace neextrahovatelné (vázané)
radioaktivity nebo reziduí v půdě;
— kvantifikace uvolněného CO
2
a dalších
těkavých sloučenin;— křivky závislostí koncentrací zkoušené látky,
popřípadě hlavních transformačních produktů
v půdě na čase;
— poločas nebo hodnoty DT
50
, DT75
a DT90
pro
zkoušenou látku, popřípadě i pro hlavní
transformační produkty včetně příslušných
intervalů spolehlivosti;— odhad rychlosti abiotického rozkladu za
sterilních podmínek;
— posouzení kinetiky transformace pro zkoušenou
látku, popřípadě i pro hlavní transformační
produkty;
— případný návrh způsobu transformace;
— diskuse a interpretace výsledků;
— nezpracovaná data (tj. chromatogramy
jednotlivých vzorků, příklady výpočtu
rychlostí transformace a metody použité pro
identifikaci transformačních produktů).
XXIII.4. LITERATURA
(1) US- Environmental Protection Agency (1982).
Pesticide Assessment Guidelines, Subdivision N.
Chemistry: Environmental Fate.
(2) Agriculture Canada (1987). Environmental Chemistry
and Fate. Guidelines for registration of pesticides in
Canada.
(3) Evropská unie (EU) (1995). Směrnice Komise 95/36/ES
ze dne 14. července 1995, kterou se mění směrnice Rady
91/414/EHS o uvádění přípravků na ochranu rostlin na trh.
Příloha II část A a příloha III část A: Rozpad a chování
v životním prostředí.
(4) Dutch Commission for Registration of Pesticides
(1995). Application for registration of a pesticide.
Section G: Behaviour of the product and its metabolites
in soil, water and air.
(5) BBA (1986). Richtlinie für die amtliche Prüfung von
Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von
Pflanzenschutzmitteln im Boden – Abbau, Umwandlung und
Metabolismus.
(6) ISO/DIS 11266 (1994). Soil Quality – Guidance on
laboratory tests for biodegradation of organic chemicals
in soil, Technical Committee ISO/TC 190/SC 4.
(7) ISO 14239 (1997E). Soil Quality – Laboratory
incubation systems for measuring the mineralization of
organic chemicals in soil under aerobic conditions.
(8) SETAC (1995). Procedures for Assessing the
Environmental Fate and Ecotoxicity of Pesticides. Vyd.
Mark R. Lynch.
(9) MAFF – Japan 2000 – Draft Guidelines for
transformation studies of pesticides in soil – Aerobic
metabolism study in soil under paddy field conditions
(flooded).
(10) OECD (1995). Final Report of the OECD Workshop on
Selection of Soils/Sediments. Belgirate, Itálie, 18. –
20. ledna 1995.
(11) Guth, J. A. (1980). The study of transformations.
In: Interactions between Herbicides and the Soil (Vyd. R.
J. Hance), Academic Press, 123 – 157.
(12) DFG: Pesticide Bound Residues in Soil. Wiley – VCH
(1998).
(13) T. R. Roberts: Non-extractable pesticide residue in
soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC
1984)
(14) OECD Test Guideline 304 A: Inherent Biodegradability
in Soil (přijato 12. května 1981)
(15) ISO 10381-6 (1993). Soil Quality – Sampling – Part
6: Guidance on the collection, handling and storage of
soil for the assessment of aerobic microbial processes in
the laboratory.
(16) Příloha V směrnice 67/548/EHS
(17) Guth, J. A. (1981). Experimental approaches to
studying the fate of pesticides in soil. In: Progress in
Pesticide Biochemistry. Vyd. D. H. Hutson, T. R. Roberts,
J. Wiley & Sons. Vol 1, 85 – 114.
(18) Soil Texture Classification (US and FAO systems):
Weed Science, 33, Suppl. 1 (1985) a Soil Sci. Soc. Amer.
Proc. 26:305 (1962).
(19) Methods of Soil Analysis (1986). Part 1, Physical
and Mineralogical Methods. Vyd. A. Klute, Agronomy Series
No 9, 2. vydání.
(20) Methods of Soil Analysis (1982). Part 2, Chemical
and Microbiological Properties. Vyd. A. L. Page, R. H.
Miller, D. R. Kelney, Agronomy Series No 9, 2. vydání.
(21) ISO Standard Compendium Environment (1994). Soil
Quality – General aspects; chemical and physical methods
of analysis; biological methods of analysis, 1. vydání.
(22) Mückenhausen, E. (1975). Die Bodenkunde und ihre
geologischen, geomorphologischen, mineralogischen und
petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(23) Scheffer, F., Schachtschabel, P. (1975). Lehrbuch
der Bodenkunde. F. Enke Verlag, Stuttgart.
(24) Anderson, J. P. E., Domsch, K. H. (1978). A
physiological method for the quantitative measurement of
microbial biomass in soils. Soil Biol. Biochem. 10, 215 –
221.
(25) ISO 14240-1 and 2 (1997). Soil quality –
Determination of soil microbial biomass – Part 1:
Substrate-induced respiration method. Part 2: Fumigation-
extraction method.
(26) Anderson, J. P. E. (1987). Handling and storage of
soils for pesticide experiments. In: Pesticide Effects on
Soil Microflora. Vyd. L. Somerville, M. P. Greaves,
Taylor & Francis, 45 – 60.
(27) Kato, Yasuhiro. (1998). Mechanism of pesticide
transformation in the environment: Aerobic and bio-
transformation of pesticides in aqueous environment.
Proceedings of the 16th Symposium on Environmental
Science of Pesticide, 105 – 120.
(28) Keuken O., Anderson J. P. E. (1996). Influence of
storage on biochemical processes in soil. In: Pesticides,
Soil Microbiology and Soil Quality, 59 – 63 (SETAC-
Europe).
(29) Stenberg B., Johansson M., Pell M., Sjödahl-Svensson
K., Stenström J., Torstensson L. (1996). Effect of freeze
and cold storage of soil on microbial activities and
biomass. In: Pesticides, Soil Microbiology and Soil
Quality, 68-69 (SETAC-Europe).
(30) Gennari, M., Negre, M., Ambrosoli, R. (1987).
Effects of ethylene oxide on soil microbial content and
some chemical characteristics. Plant and Soil 102, 197-
200.
(31) Anderson, J. P. E. (1975). Einfluss von Temperatur
und Feuchte auf Verdampfung, Abbau und Festlegung von
Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII,
141-146.
(32) Hamaker, J. W. (1976). The application of
mathematical modelling to the soil persistence and
accumulation of pesticides. Proc. BCPC Symposium:
Persistence of Insecticides and Herbicides, 181-199.
(33) Goring, C. A. I., Laskowski, D. A., Hamaker, J. W.,
Meikle, R. W. (1975). Principles of pesticide degradation
in soil. In: Environmental Dynamics of Pesticides. Vyd.
R. Haque, V. H. Freed, 135 – 172.
(34) Timme, G., Frehse, H., Laska, V. (1986). Statistical
interpretation and graphic representation of the
degradational behaviour of pesticide residues. II.
Pflanzenschutz – Nachrichten Bayer 39, 188 –204.
(35) Timme, G., Frehse, H. (1980). Statistical
interpretation and graphic representation of the
degradational behaviour of pesticide residues. I.
Pflanzenschutz – Nachrichten Bayer 33, 47 – 60.
(36) Gustafson D. I., Holden L. R. (1990). Non-linear
pesticide dissipation in soil; a new model based on
spatial variability. Environm. Sci. Technol. 24, 1032 –
1041.
(37) Hurle K., Walker A. (1980). Persistence and its
prediction. In: Interactions between Herbicides and the
Soil. Vyd. R. J. Hance, Academic Press, 83 – 122.
DODATEK 1
TLAK VODY, POLNÍ KAPACITA (PK) A RETENČNÍ VODNÍ KAPACITA
(RVK)
---------------------------------------------------------- Výška pFa barb Poznámky vodního sloupce [cm] ---------------------------------------------------------- 1077 104 Suchá půda 1,6*1044,2 16 Bod vadnutí 1044 10 1033 1 6*1022,8 0,6 3,3*1022,5 0,33c 1022 0,1 -+ 60 1,8 0,06 |- Rozpětí polní kapacityd 33 1,5 0,033 -+ 10 1 0,01 RVK (přibližná hodnota) 1 0 0,001 Půda nasycená vodou ---------------------------------------------------------- a pF = dekadický logaritmus výšky vodního sloupce v cm. b 1 bar = 105 Pa. c Odpovídá přibližnému obsahu vody při složení 10 % písku, 35 % hlíny a 45 % jílu. d Polní kapacita není konstanta, ale mění se v závislosti na druhu půdy od pF 1,5 do 2,5.
Tlak vody se vyjadřuje v cm vodního sloupce nebo
v jednotkách bar. Vzhledem k velkému rozpětí se sací tlak
vyjadřuje jednoduše jako hodnota pF, která je
ekvivalentní logaritmu vodního sloupce v cm.
Polní kapacita je definována jako množství vody, které
přírodní půda po delším deštivém období nebo po
dostatečném zavlažení udrží proti gravitaci 2 dny.
Stanovuje se u neporušené půdy v polním pokusu. Naměřená
hodnota tedy není použitelná pro laboratorní vzorky
porušené půdy. Hodnoty PK stanovené u porušených půd
mohou vykazovat větší systematické odchylky.
Retenční vodní kapacita (RVK) se stanovuje v laboratoři u
neporušené i porušené půdy tak, že se kapilárním
vzlínáním nasytí sloupec půdy vodou. Využije se zejména u
porušených půd, kdy může být RVK až o 30 % vyšší než
polní kapacita (1). Také se stanovuje snadněji než
spolehlivé hodnoty PK.
DODATEK 2
VLHKOST PůDY (v g vody na 100 g sušiny) U RŮZNÝCH DRUHŮ
PŮD Z RŮZNÝCH ZEMÍ
-------------------------------------------------------------
Druh půdy Země Vlhkost půdy při
RVK1 pF = 1,8 pF = 2,5
-------------------------------------------------------------
Písčitá Německo 28,7 8,8 3,9
Hlinitopísčitá Německo 50,4 17,9 12,1
Hlinitopísčitá Švýcarsko 44,0 35,3 9,2
Prachovitohlinitá Švýcarsko 72,8 56,6 28,4
Jílovitohlinitá Brazílie 69,7 38,4 27,3
Jílovitohlinitá Japonsko 74,4 57,8 31,4
Písčitohlinitá Japonsko 82,4 59,2 36,0
Prachovitohlinitá USA 47,2 33,2 18,8
Písčitohlinitá USA 40,4 25,2 13,3
-------------------------------------------------------------
1 Retenční vodní kapacita
DODATEK 3
Obrázek 1
Příklad průtokové aparatury pro studium transformace
chemických látek v půdě (viz literatura 1 a 2)
1: jehlový ventil 4: baňka pro 7, 8: zátka
studium z hydroxidu
metabolismu sodného pro
v půdě (zalitá zachycení CO2
vodou pouze a jiných
v případě kyselých
anaerobních těkavých
podmínek a látek
podmínek
rýžového pole)
2: promývačka s vodou 5: baňka 9: průtokoměr
s ethylenglykol
em pro
zachycení
organických
těkavých
sloučenin
3: ultramembrána 6: baňka
(pouze ve s kyselinou
sterilních sírovou pro
podmínkách), zachycení
velikost pórů alkalických
0,2 m těkavých
sloučenin
Obrázek 2
Příklad biometrické baňky pro studium transformace
chemických látek v půdě (viz literatura 3)

(1) Guth, J. A. (1980). The study of transformations.
In: Interactions between Herbicides and the Soil.
Vyd. R. J. Hance, Academic Press, 123 – 157.
(2) Guth, J. A. (1981). Experimental approaches to
studying the fate of pesticides in soil. In:
Progress in Pesticide Biochemistry. Vyd. D.H.
Hutson, T.R. Roberts, J. Wiley & Sons. Vol 1,
85 – 114.
(3) Anderson, J. P. E. (1975). Einfluss von
Temperatur und Feuchte auf Verdampfung, Abbau und
Festlegung von Diallat im Boden. Z. PflKrankh
Pflschutz, Sonderheft VII, 141 – 146.
XXIV. METODA PRO STANOVENÍ AEROBNÍ A ANAEROBNÍ
TRANSFORMACE V SYSTÉMECH VODA-SEDIMENT
(metoda C.24 podle přílohy směrnice 2004/73/ES ze dne 29.
dubna 2004, kterou se po dvacáté deváté přizpůsobuje
technickému pokroku směrnice Rady 67/548/EHS o sbližování
právních a správních předpisů týkajících se klasifikace,
balení a označování nebezpečných látek)
XXIV.1.METODA
Tato zkušební metoda je replikou metody OECD TG
308 (2002).
XXIV.1.1 ÚVOD
Chemické látky se mohou dostat do mělkých nebo
hlubokých povrchových vod takovými cestami, jako
jsou přímá aplikace, unášení postřiku, odtok,
ukládání odpadu, průmyslové, komunální nebo
zemědělské emise a atmosférický spad. V této
zkušební metodě je popsán laboratorní postup
posouzení aerobní a anaerobní transformace
organických chemických látek v systémech voda-
sediment. Je založena na doporučeních a
směrnicích národních a mezinárodních organizací
(viz literatura 1 až 8). Tyto studie jsou
požadovány u látek, které jsou aplikovány
bezprostředně do vody nebo které se mohou dostat
do vody výše uvedenými cestami.
Podmínky ve vrchní vodní fázi přírodních systémů
voda-sediment jsou často aerobní. Podmínky
v povrchové vrstvě sedimentu mohou být buď
aerobní, nebo anaerobní, zatímco podmínky
hlouběji v sedimentu jsou obvykle anaerobní. S
cílem zahrnout všechny tyto možnosti je v tomto
dokumentu popsána zkouška jak za aerobních
podmínek, tak za anaerobních podmínek. Aerobní
zkouškou se simuluje aerobní vodní sloupec nad
aerobní vrstvou sedimentu, pod níž leží vrstva
s anaerobním gradientem. Anaerobní zkouška
simuluje zcela anaerobní systém voda-sediment.
Pokud je z okolností zřejmé, že je třeba se
odchýlit od těchto doporučení, např. použít
nedotčené střední vrstvy sedimentů nebo
sedimenty, které mohly být exponovány zkoušenou
látkou, existují jiné metody určené k tomuto
účelu (viz literatura 9).
XXIV.1.2 DEFINICE
Ve všech případech je třeba používat jednotky
mezinárodní soustavy jednotek (SI).
Zkoušená látka: jakákoli látka, ať již výchozí
látka, nebo příslušné transformační produkty.
Transformační produkty: všechny látky vznikající
při biotických a abiotických transformačních
reakcích zkoušené látky, včetně CO
2
a vázaných
reziduí.Vázaná rezidua: „Vázaná rezidua“ jsou sloučeniny
v půdě, rostlině nebo v živočichu, které po
extrakci zůstávají v matrici ve formě výchozí
látky nebo jejího metabolitu (jejích metabolitů).
Metoda extrakce nesmí podstatně měnit samotné
sloučeniny nebo strukturu matrice. Povahu vazeb
lze částečně vyjasnit extrakcí spojenou se
změnami v matrici a náročnými analytickými
technikami. Dosud byly tímto způsobem vyjasněny
např. kovalentní, iontové a adsorpční vazby a
rovněž záchyty. Tvorba vázaných reziduí obecně
podstatně snižuje biologickou přístupnost a
dostupnost (viz literatura 10) [upraveno IUPAC
1984 (viz literatura 11)].
Aerobní transformace: (oxidační): reakce, ke
kterým dochází za přítomnosti kyslíku (viz
literatura 12).
Anaerobní transformace: (redukční): reakce
probíhající s vyloučením molekulárního kyslíku
(viz literatura 12).
Sediment: je směs minerálních a organických
chemických složek, přičemž organické složky
obsahují sloučeniny s vysokým obsahem uhlíku a
dusíku a vysokou molekulovou hmotností. Ukládají
se v povrchových vodách a vytvářejí rozhraní
s těmito vodami.
Mineralizace: je úplný rozklad organické
sloučeniny na CO
2
a H2
O za aerobních podmínek a
na CH4
, CO2
a H2
O za anaerobních podmínek.
V rámci této zkušební metody, při níž se
používají sloučeniny značené radioisotopy, se
mineralizací rozumí rozsáhlý rozklad molekuly,
při němž se značící atomy uhlíku kvantitativně
oxidují nebo redukují, přičemž se uvolňuje
odpovídající množství 14
CO2
nebo 14
CH4
.
Poločas, t0,5, je čas, za který dojde k 50%
transformaci zkoušené látky, jestliže lze
transformaci popsat kinetikou prvního řádu;
nezávisí na počáteční koncentraci. DT
50
(doba odbourání 50): doba, za kterou se
počáteční koncentrace zkoušené látky sníží o 50
%.DT
75
(doba odbourání 75): doba, za kterou se
počáteční koncentrace zkoušené látky sníží o
75 %.DT
90
(doba odbourání 90): doba, za kterou se
počáteční koncentrace zkoušené látky sníží o
90 %.XXIV.1.3 REFERENČNÍ LÁTKY
Referenční látky by měly být použity pro
identifikaci a kvantitativní stanovení
transformačních produktů spektroskopickými a
chromatografickými metodami.
XXIV.1.4 INFORMACE O ZKOUŠENÉ LÁTCE
Pro stanovení rychlosti transformace lze použít
jak látky neznačené radioisotopy, tak značené
látky, přičemž značené materiály jsou
upřednostňovány. Značený materiál je nezbytný pro
studium způsobu transformace a pro stanovení
látkové bilance. Doporučuje se značení isotopem
14
C, avšak užitečné mohou být i jiné isotopy,
např. 13
C, 15
N, 3
H, 32
P. Značena by měla být
pokud možno nejstabilnější část (části) molekuly.
Pokud například látka obsahuje kruh, je třeba
tento kruh označit; pokud látka obsahuje dva nebo
více kruhů, může být nezbytné provést samostatné
studie za účelem stanovení osudu každého
z označených kruhů, a získat tak vhodné informace
o tvorbě transformačních produktů. Chemická
a/nebo radiochemická čistota látky by měla být
alespoň 95 %.
Před provedením zkoušky by měly být k dispozici
tyto informace o látce:
a) rozpustnost ve vodě (metoda A.6);
b) rozpustnost v organických rozpouštědlech;
c) tlak par (metoda A.4) a Henryho konstanta;
d) rozdělovací koeficient n-oktanol/voda (metoda
A.8);
e) adsorpční koeficient (podle potřeby Kd, Kf
nebo Koc) (metoda C.18);
f) hydrolýza (metoda C.7);
g) disociační konstanta (pKa) [směrnice OECD
112] (viz literatura 13);
h) chemická struktura zkoušené látky a případně
poloha značícího nuklidu.
Poznámka: Ve zprávě se uvede teplota, při
které byla měření prováděna.
Mezi další užitečné informace patří údaje o
toxicitě zkoušené látky pro půdní mikroorganismy,
údaje o snadné nebo vlastní biologické
rozložitelnosti a údaje o aerobní a anaerobní
transformaci v půdě.
K dispozici by měly být analytické metody (včetně
extrakčních a izolačních metod) pro kvantitativní
stanovení a identifikaci zkoušené látky a jejích
transformačních produktů ve vodě a sedimentu
(viz oddíl 1.7.2).
XXIV.1.5 PODSTATA ZKUŠEBNÍ METODY
V metodě popsané v této zkoušce se používají
aerobní i anaerobní systémy voda-sediment (viz
dodatek 1), které umožňují
i) měřit rychlost transformace zkoušené látky
v systému voda-sediment,
ii)měřit rychlost transformace zkoušené látky
v sedimentu,
iii) měřit rychlost mineralizace zkoušené látky
a/nebo produktů její transformace (pokud se
použije zkoušená látka značená isotopem
14
C),iv)identifikaci a kvantitativní stanovení
produktů transformace ve vodě a v sedimentu,
včetně látkové bilance (pokud se použije
značená zkoušená látka),
v) měřit distribuci zkoušené látky a produktů
její transformace mezi dvěma fázemi během
inkubace v temnu (aby nedošlo např.
k vykvetení řas) při konstantní teplotě.
Pokud to údaje umožňují, stanoví se poločasy
a hodnoty DT
50
, DT75
a DT90
, které by však
neměly být příliš extrapolovány mimo obor
experimentálních hodnot (viz oddíl 1.2). Pro aerobní i anaerobní studie jsou nezbytné
alespoň dva sedimenty a příslušné vodní fáze (viz
literatura 7). V některých případech by však měly
být použity více než dva systémy voda-sediment,
např. u chemických látek, které mohou být
přítomny ve sladkovodním i mořském ekosystému.
XXIV.1.6 POUŽITELNOST ZKOUŠKY
Tato je metoda je použitelná pro všechny chemické
látky (neznačené nebo značené radioaktivními
isotopy), pro něž je k dispozici analytická
metoda s dostatečnou správností a citlivostí. Je
použitelná pro mírně těkavé a netěkavé sloučeniny
rozpustné nebo špatně rozpustné ve vodě. Zkouška
by neměla být použita u látek, které z vody silně
těkají (např. fumiganty, organická rozpouštědla),
a nelze je tedy ve vodě nebo v sedimentu udržet
za experimentálních podmínek této zkoušky.
Tato metoda je dosud používána ke studiu
transformace chemických látek ve sladkovodním
systému voda-sediment, avšak může být v zásadě
použita také na estuarní a mořské systémy. Není
vhodná k simulaci podmínek v tekoucích vodách
(např. řekách) nebo na otevřeném moři.
XXIV.1.7 KRITÉRIA JAKOSTI
XXIV.1.7.1 Výtěžnost
Extrakce a analýza provedená alespoň u dvou
duplikátních vzorků systému voda-sediment ihned
po přidání zkoušené látky poskytne první
informaci o opakovatelnosti analytické metody a o
stejnoměrnosti aplikace zkoušené látky.
Výtěžnosti pozdějších stupňů experimentu se
zjistí z příslušných látkových bilancí (pokud se
použije značený materiál). Výtěžnosti by se měly
nacházet v rozmezí 90 % až 110 % u značených
chemických látek (viz literatura 6) a v rozmezí
70 % až 110 % u neznačených chemických látek.
XXIV.1.7.2 Opakovatelnost a citlivost analytické metody
Opakovatelnost analytické metody (kromě účinnosti
první extrakce) pro kvantitativního stanovení
zkoušené látky a transformačních produktů lze
ověřit provedením analýzy duplikátních vzorků
týchž extraktů vzorků vody nebo sedimentu, které
byly dostatečně dlouho inkubovány, aby došlo
k vytvoření transformačních produktů.
Mez detekce analytické metody (LOD) pro zkoušenou
látku a pro transformační produkty by měla být
alespoň 0,01 mg na kg vody nebo sedimentu (pro
zkoušenou látku) nebo 1 % výchozího množství
aplikovaného do zkušebního systému, podle toho,
která z hodnot je nižší. Rovněž by měla být
specifikována mez kvantitativní stanovitelnosti
(LOQ).
XXIV.1.7.3 Správnost dat o transformaci
Regresní analýza závislosti koncentrace zkoušené
látky na čase poskytuje vhodné informace o
správnosti transformační křivky a umožňuje
vypočítat intervaly spolehlivosti pro poločasy (v
případě zdánlivé kinetiky prvního řádu) nebo pro
hodnoty DT50 a popřípadě hodnoty DT
75
a DT90
.XXIV.1.8 POPIS METODY
XXIV.1.8.1 Zkušební systém a aparatura
Studie se provede se skleněnými nádobami
(např. baňkami, centrifugačními kyvetami), pokud
z předběžných informací (např. z rozdělovacího
koeficientu n-oktanol/voda, ze sorpčních dat
atd.) nevyplývá, že látka může ulpívat na skle;
v takovém případě lze zvážit použití náhradního
materiálu (např. teflonu). Pokud je o zkoušené
látce známo, že ulpívá na skle, lze problém
zmírnit jednou z následujících metod:
— stanovením hmotnosti zkoušené látky a
transformačních produktů sorbovaných na skle;
— zajištěním, aby se na konci zkoušky omylo
rozpouštědlem veškeré laboratorní sklo;
— použitím komerční úpravy přípravků (viz také
oddíl 1.9.2);
— použitím většího množství pomocného
rozpouštědla za účelem přidání zkoušené látky
do systému; pokud se použije pomocné
rozpouštědlo, nesmí štěpit zkoušenou látku
solvolýzou.
Příklady typických zkušebních aparatur, tj.
průtokové a biometrické systémy, jsou uvedeny
v dodatcích 2 a 3 (viz literatura 14). Jiné
užitečné inkubační systémy jsou popsány
v literatuře (viz literatura 15). Experimentální
aparatura by měla být konstruována tak, aby byla
možná výměna vzduchu nebo dusíku a zachycení
těkavých produktů. Rozměry aparatury musí
splňovat požadavky zkoušky (viz oddíl 1.9.1).
Ventilace musí být zajištěna buď jemným
probubláváním, nebo proháněním vzduchu nebo
dusíku nad hladinou vody. V druhém případě se
doporučuje vodu seshora mírně promíchávat, aby
docházelo k lepší distribuci kyslíku nebo dusíku
ve vodě. Neměl by se použít vzduch zbavený CO
2
,
neboť by došlo ke zvýšení pH vody. V žádném
případě není žádoucí, aby došlo ke zvíření
sedimentu, a je tomu třeba pokud možno zabránit.
Slabě těkavé chemické látky se zkoušejí
v biometrickém systému za mírného promíchávání
vodní hladiny. Lze rovněž použít uzavřené nádobky
s volným objemem pod víčkem vyplněným
atmosférickým vzduchem nebo dusíkem a vnitřní
ampulky pro zachycování těkavých produktů (viz
literatura 16). U aerobních zkoušek je nezbytná
pravidelná výměna plynu pod víčkem, aby se
vyrovnávala spotřeba kyslíku biomasou.Mezi vhodné lapače pro shromažďování těkavých
transformačních produktů patří kromě jiných
roztok hydroxidu draselného nebo sodného o
koncentraci 1 mol*dm-3 pro zachytávání oxidu
uhličitého a ethylenglykol, ethanolamin nebo 2%
parafín v xylenu pro organické sloučeniny.
Vzhledem k tomu, že alkalické roztoky absorbují
oxid uhličitý ze vzduchu určeného
k provzdušňování a oxid uhličitý uvolňující se
respirací v aerobních experimentech, musí být
pravidelně vyměňovány, aby se nevyčerpala jejich
absorpční kapacita.Těkavé látky tvořící se za
anaerobních podmínek, např. methan, lze
zachytávat na molekulovém sítu. Takové těkavé
látky lze spálit např. na CO
2
v křemenné trubičce
za přítomnosti CuO při teplotě 900 st.C a vzniklý
CO2
lze zachytit v absorbéru s alkálií (viz
literatura 17).Pro chemickou analýzu zkoušené látky a
transformačních produktů jsou nezbytné
laboratorní přístroje (např. přístroje pro
plynovou chromatografii s kapalinovou stacionární
fází (GLC), vysokoúčinnou kapalinovou
chromatografii (HPLC), pro chromatografii na
tenké vrstvě (TLC), hmotnostní spektrometrii
(MS), kombinaci plynové chromatografie a
hmotnostní spektrometrie (GC-MS), kombinaci
kapalinové chromatografie a hmotnostní
spektrometrie (LC-MS), jadernou magnetickou
rezonanci (NMR) atd.), včetně detekčních systémů
pro detekci sloučenin značených nebo neznačených
radioisotopy. Pokud se použije materiál značený
radioisotopy, je třeba mít k dispozici
scintilační spektrometr a zařízení pro spalování
za přítomnosti oxidačního činidla (pro spalování
vzorků sedimentů před radiometrickým měřením).
Další standardní laboratorní vybavení pro
fyzikálněchemická a biologická stanovení (viz
oddíl 1.8.2.2 tabulka 1), laboratorní sklo,
chemikálie a činidla se použijí podle potřeby.
XXIV.1.8.2 Výběr a počet vodních sedimentů
Místa odběru by měla být vybrána podle účelu
zkoušky v dané situaci. Při výběru místa odběru
vzorků musí být přihlédnuto k historii případných
zemědělských, průmyslových nebo komunálních
vstupů do povodí a do vod proti proudu. Sedimenty
by neměly být použity, pokud byly v předchozích 4
letech kontaminovány zkoušenou látkou nebo jejími
strukturními analogy.
XXIV.1.8.2.1 Výběr sedimentů
Pro aerobní studie se obvykle použijí dva
sedimenty (viz literatura 7). Tyto dva vybrané
sedimenty by se měly lišit co do obsahu
organického uhlíku a textury. Jeden sediment by
měl mít vysoký obsah organického uhlíku (2,5 –
7,5 %) a jemnou texturu a druhý sediment by měl
mít nízký obsah organického uhlíku (0,5 – 2,5 %) a
hrubou texturu. Obsah organického uhlíku by se měl
zpravidla lišit alespoň o 2 %. „Jemná textura“ je
definována obsahem složky [jíl + prach] , ([jíl +
prach] je minerální frakce sedimentu s velikostí
částic < 50 µm) vyšším než 50 % a „hrubá textura“
je definována obsahem složky [jíl + prach] nižším
než 50 %. Rozdíl v obsahu složek [jíl + prach] u
obou sedimentů by měl být zpravidla alespoň 20 %.
V případě, že se může chemikálie dostat do
mořských vod, měl by alespoň jeden systém voda-
sediment pocházet z moře.
Pro přísně anaerobní studii by měly být odebrány
dva sedimenty (včetně příslušné vody)
z anaerobních zón povrchových vod (viz literatura
7). Se sedimentem i vodní fází by mělo být
zacházeno opatrně a měly by být přepravovány
s vyloučením přístupu kyslíku.
Pro výběr sedimentu mohou být důležité i jiné
parametry, které by měly být zvažovány případ od
případu. Rozpětí pH sedimentů je například
důležité pro zkoušení chemikálií, u nichž
transformace a/nebo sorpce mohou záviset na pH.
Závislost sorpce na pH by se mohla odrážet
v hodnotě pKa zkoušené látky.
XXIV.1.8.2.2 Charakterizace vzorků systému voda-
sediment
Klíčové parametry, které musí být jak u vody, tak
u sedimentu měřeny a uvedeny ve zprávě (s odkazem
na použitou metodu), a fáze zkoušky, ve které
mají být měřeny, jsou shrnuty v níže uvedené
tabulce. Metody stanovení těchto parametrů jsou
pro informaci uvedeny v literatuře 18 až 21.
Kromě toho může být případ od případu nezbytné
měřit a uvádět další parametry (např. u
sladkovodního systému: obsah částic, alkalita,
tvrdost, vodivost, NO
3
/PO4
(poměr jednotlivých
hodnot); u sedimentů: kationtová výměnná
kapacita, retenční vodní kapacita, obsah
uhličitanů, celkový obsah dusíku a fosforu; u
mořských systémů: salinita). Pro posouzení
oxidačně-redukčních podmínek, a zejména
v souvislosti s anaerobní transformací, může být
také užitečná analýza sedimentů a vody na
dusičnany, sírany, biologicky dostupné železo,
popřípadě na jiné akceptory elektronů.Měření parametrů pro charakterizaci vzorků systémů voda-
sediment (viz literatura 7, 22 a 23)
-------------------------------------------------------------------------
Parametr Fáze zkušebního postupu
odběr v manipulace zahájení zahájení samotná konec
terénu po odběru aklimatizace zkoušky zkouška zkoušky
-------------------------------------------------------------------------
Voda
-------------------------------------------------------------------------
Původ/ x
zdroj
Teplota x
pH x x x x x
TOC x x x
Koncentrace x x x x x
O2*
Oxidačně- x x x x
redukční
potenciál*
-------------------------------------------------------------------------
Sediment
-------------------------------------------------------------------------
Původ/ x
zdroj
Hloubka x
vrstvy
pH x x x x x
Distribuce x
částic
TOC x x x x
Mikrobiální x x x
biomasa**
Oxidačně- Pozorování x x x x
redukční
potenciál* (barva/
zápach)
-------------------------------------------------------------------------
* Výsledky nedávných výzkumů ukázaly, že měření
koncentrace kyslíku ve vodě a oxidačně-redukčního
potenciálu vody nemají vypovídací hodnotu, pokud jde o
mechanismus růstu a vývoje mikrobiální populace
v povrchových vodách, a nemají ani předpovědní hodnotu
(viz literatura 24 a 25). Stanovení biochemické
spotřeby kyslíku (BOD, při odběru vzorků v terénu a při
zahájení a na konci zkoušky) a koncentrace mikro- a
makroživin Ca, Mg a Mn ve vodě (při zahájení a na konci
zkoušky) a měření celkového obsahu N a P v sedimentech
(při odběru vzorků v terénu a na konci zkoušky) může
být lepším nástrojem pro interpretaci a hodnocení
rychlosti a způsobů aerobní biotransformace.
** Metoda měření rychlosti mikrobiální respirace (viz
literatura 26), fumigační metoda (viz literatura 27)
nebo měření počtu mikroorganismů (např. bakterií,
aktinomycet, plísní a celkového počtu kolonií) pro
aerobní studie; rychlost methanogeneze u anaerobních
studií.
XXIV.1.8.3 Odběr vzorků, manipulace s nimi a jejich
skladování
XXIV.1.8.3.1 Odběr
Vzorky sedimentu se odeberou podle návrhu
směrnice ISO pro odběr vzorků sedimentů (viz
literatura 8). Vzorky se odeberou z celé 5 až 10
cm silné horní vrstvy sedimentu. Současně se
sedimentem se odebere z téhož místa nebo lokality
příslušný vzorek vody. U anaerobní studie musí
být sediment a příslušná voda odebrány a
přepravovány s vyloučením přístupu kyslíku (viz
literatura 28) (viz oddíl 1.8.2.1). V literatuře
je popsáno několik odběrových zařízení (viz
literatura 8 a 23).
XXIV.1.8.3.2 Manipulace
Sediment se oddělí od vody filtrací a poté se
pomocí přebytku vody z místa odběru prosévá za
mokra na 2mm sítu; voda se odstraní. Poté se
v inkubační baňce v požadovaném poměru (viz oddíl
1.9.1) smísí známé množství sedimentu a vody a
směs se připraví pro aklimatizaci (viz oddíl
1.8.4). U anaerobní studie musí být všechny kroky
prováděny s vyloučením přístupu kyslíku (viz
literatura 29 až 33).
XXIV.1.8.3.3 Skladování
V každém případě se doporučuje používat čerstvě
odebraný sediment a vodu; je-li však skladování
nezbytné, sediment s vodou se proseje výše
popsaným způsobem a zalitý vodou (vrstva vody 6 –
10 cm) se skladuje v temnu při (4 +/-2) st.C (viz
literatura 4) maximálně 4 týdny (viz literatura
7, 8 a 23). Vzorky pro aerobní studie se skladují
za volného přístupu vzduchu (např. v otevřených
nádobách), zatímco vzorky pro anaerobní studie se
skladují s vyloučením přístupu kyslíku. Při
přepravě a skladování nesmí sediment a voda
zmrznout a sediment nesmí být vysušován.
XXIV.1.8.4 Příprava vzorků systému sediment-voda ke
zkoušce
Před přidáním zkoušené látky musí proběhnout
aklimatizace, při níž musí být vzorky sedimentu-
vody umístěny v inkubační nádobě, která se
použije při hlavní zkoušce; podmínky aklimatizace
musí být totožné s podmínkami inkubace při
zkoušce (viz oddíl 1.9.1). Doba aklimatizace je
čas nezbytný pro dostatečnou stabilizaci systému,
kterou lze posoudit podle pH, koncentrace kyslíku
ve vodě, oxidačně-redukčního potenciálu sedimentu
a vody a makroskopické separace fází. Doba
aklimatizace není obvykle delší než jeden až dva
týdny a neměla by překročit čtyři týdny. Výsledky
měření provedených během této doby se uvedou ve
zprávě.
XXIV.1.9 PROVEDENÍ ZKOUŠKY
XXIV.1.9.1 Zkušební podmínky
Zkouška se provede v inkubační aparatuře (viz
oddíl 1.8.1) při poměru objemu vody a sedimentu
3:1 až 4:1, s vrstvou sedimentu 2,5 cm
(+/- 0,5 cm). Doporučené minimální množství
sedimentu na inkubační nádobu je 50 g (hmotnost
sušiny). Z nedávných studií vyplývá, že
skladování při 4 st.C může vést k poklesu obsahu
organického uhlíku v sedimentu, který by mohl
případně vést k poklesu mikrobiální aktivity.
Zkouška se provádí v temnu za konstantní teploty
v rozmezí 10 až 30 st.C. Vhodná je teplota
(20 +- 2) st.C. Podle potřeby lze případ od případu
v závislosti na zaměření zkoušky zvolit další,
nižší teplotu (např. 10 st.C). Inkubační teplota se
sleduje a uvede se ve zprávě.
XXIV.1.9.2 Úprava zkoušené látky a její aplikace
Použije se jedna zkušební koncentrace chemické
látky. Zkouška s druhou koncentrací může být
užitečná u chemických látek, které se dostávají
do vod různými cestami, a vykazují tedy významně
odlišné koncentrace, pokud lze nižší koncentraci
analyzovat s dostatečnou správností. U přípravků
na ochranu rostlin aplikovaných přímo do vodního
tělesa se použije maximální dávkování uvedené na
etiketě jako maximální aplikovaná dávka vypočtená
podle plochy hladiny vody ve zkušební nádobě. Ve
všech ostatních případech se použije koncentrace
založená na odhadech emise do životního
prostředí. Je třeba spolehlivě zajistit, aby byla
aplikována dostatečná koncentrace zkoušené látky
pro charakterizaci postupu transformace a tvorby
a odbourávání transformačních produktů.
V situaci, kdy se koncentrace zkoušené látky na
začátku studie blíží mezím detekce a/nebo kdy by
nebylo možné detekovat hlavní transformační
produkty, jsou-li přítomny v množství
odpovídajícím 10 % výchozí aplikované dávky, může
být nezbytné aplikovat vyšší dávky (např. 10krát
vyšší). Použité vyšší koncentrace však nesmí mít
významné nepříznivé účinky na mikrobiální
aktivitu v systému voda-sediment. S cílem
dosáhnout konstantní koncentrace v nádobách
různých rozměrů může být nezbytné upravit
množství použitého materiálu, přičemž se vychází
z výšky vodního sloupce v nádobě v poměru
k hloubce vody v odběrovém místě (předpokládá se
hloubka 100 cm, možná je však i jiná hloubka).
Příklad výpočtu je uveden v dodatku 4.
V ideálním případě se zkoušená látka aplikuje do
vodné fáze zkoušeného systému ve formě vodného
roztoku. Je-li to nevyhnutelné, je přípustné
použít pro aplikaci a rozptýlení zkoušené látky
malé množství rozpouštědla mísitelného s vodou
(např. acetonu nebo ethanolu), avšak jeho
množství by nemělo překročit 1 % (obj.) a
rozpouštědlo by nemělo mít nepříznivé účinky na
mikrobiální aktivitu ve zkušebním systému.
Přípravě vodného roztoku zkoušené látky je třeba
věnovat pozornost a k zajištění naprosté
homogenity může být vhodné použít generátorové
kolony a předem připravené směsi. Po přidání
vodného roztoku do zkušebního systému se
doporučuje vodnou fázi mírně promíchat tak, aby
se sediment zvířil co nejméně.
Použití komerčních úprav přípravků se
nedoporučuje, neboť složky přípravku mohou mít
vliv na distribuci zkoušené látky a/nebo
transformačních produktů mezi vodu a sediment. U
špatně rozpustných zkoušených látek však může být
použití komerční úpravy vhodnou možností.
Počet inkubačních nádob závisí na počtu
intervalů, v nichž mají být prováděny odběry (viz
oddíl 1.9.3). Je třeba nasadit dostatečný počet
zkušebních systémů, aby bylo možné v každém
intervalu vyhodnotit dva systémy. Použijí-li se
pro každý systém voda-sediment kontrolní systémy,
neexponují se zkoušené látce. Kontrolní systémy
lze použít pro stanovení mikrobiální biomasy
sedimentu a celkového organického uhlíku ve vodě
na konci studie. Dva kontrolní systémy (tj. po
jednom kontrolním systému z každého systému voda-
sediment) mohou být použity pro sledování
požadovaných parametrů v sedimentu a ve vodě
v průběhu aklimatizace (viz tabulka
v oddílu 1.8.2.2). Dva další kontrolní systémy
musí být nasazeny za účelem měření nepříznivých
účinků na mikrobiální aktivitu ve zkušebním
systému v případě, že se zkoušená látka aplikuje
pomocí rozpouštědla.
XXIV.1.9.3 Délka zkoušky a odběry vzorků
Délka experimentu by neměla překročit 100 dnů (6)
a experiment by měl trvat tak dlouho, dokud se
nestanoví způsob rozkladu a distribuce ve
vodě/sedimentu, nebo dokud se transformací a/nebo
těkáním nevyčerpá 90 % zkoušené látky. Odběr by
měl být proveden nejméně v šesti časech (včetně
času 0), přičemž vhodný režim odběrů a délka
zkoušky se stanoví nepovinnou orientační studií
(viz oddíl 1.9.4), nejsou-li k dispozici vhodné
údaje o zkoušené látce z dřívějších studií.
U hydrofobních zkoušených látek může být potřeba
dodatečným vzorkováním v průběhu počáteční fáze
studie zjistit stupeň distribuce mezi vodu a
sediment.
V příslušnou dobu se k analýze odebere celý obsah
inkubačních nádob (včetně duplikátních nádob).
Sediment a voda nad sedimentem se analyzují
zvlášť. Může-li snadno docházet k rychlé opětovné
oxidaci produktů anaerobní transformace, měly by
být během odběru a analýzy zachovány anaerobní
podmínky.
Voda se za minimálního zvíření sedimentu opatrně
odebere. Vhodnými analytickými postupy se
provedou extrakce a charakterizace zkoušené látky
a transformačních produktů. Je třeba také pečlivě
shromáždit materiál, který může být adsorbován na
inkubační nádobě nebo ve spojovacích trubičkách
použitých k zachycení těkavých látek.
XXIV.1.9.4 Nepovinná orientační zkouška
Pokud nelze délku etapy, kdy jsou odebírány
vzorky, odhadnout z jiných relevantních studií
zkoušené látky, lze případně provést orientační
zkoušku, která se provede za týchž zkušebních
podmínek, jaké jsou navrženy pro hlavní studii.
Příslušné podmínky a výsledky orientační zkoušky,
pokud byla provedena, by měly být v krátkosti
uvedeny ve zprávě.
XXIV.1.9.5 Měření a analýza
Pro každý čas odběru se provede měření
koncentrace zkoušené látky a transformačních
produktů ve vodě a v sedimentu a výsledky se
uvedou ve zprávě (jako koncentrace a v procentech
aplikovaného množství). V zásadě by měla být při
každém odběru provedena identifikace
transformačních produktů, které obsahují >= 10 %
radioaktivity aplikované do celého systému voda-
sediment, pokud nejsou dostatečné důvody proti
tomu. Měly by být také identifikovány
transformační produkty, jejichž koncentrace
v průběhu studie nepřetržitě roste, třebaže
nedosahuje výše uvedené meze, neboť to může
znamenat, že se jedná o perzistentní produkty.
Tento postup by měl být zvážen případ od případu
a ve zprávě by měl být odůvodněn.
Pro každý čas odběru se uvedou výsledky ze
systémů pro zachycování plynů/těkavých látek (CO
2
a jiných těkavých organických sloučenin). Uvede
se rychlost mineralizace. Pro každý čas odběru se
uvedou neextrahovatelná (vázaná) rezidua
v sedimentu.XXIV.2.DATA
XXIV.2.1 ZPRACOVÁNÍ VÝSLEDKŮ
Pro každý čas odběru se vypočte celková látková
bilance nebo výtěžnost (viz oddíl 1.7.1) přidané
radioaktivity. Výsledky se uvedou v procentech
přidané radioaktivity. Pro každý čas odběru se
uvede distribuce radioaktivity mezi vodu a
sediment (vyjádřeno v koncentracích a
v procentech).
Pro zkoušenou látku se vypočítá poločas a hodnoty
DT50 a popřípadě hodnoty DT
75
a DT90
a intervaly
spolehlivosti těchto hodnot (viz oddíl 1.7.3).
Vhodnými hodnotícími nástroji lze zjistit míru
zániku zkoušené látky ve vodě a v sedimentu. Může
jít o použití zdánlivé kinetiky prvního řádu, o
techniky proložení empirické křivky za použití
grafického nebo numerického řešení a o složitější
hodnocení, např. pomocí modelu s jednou nebo více
složkami. Další podrobné informace lze získat z
publikované literatury 35 až 37). Všechny přístupy mají své silné a slabé stránky a
značně se liší v komplexnosti. Předpoklad
kinetiky prvního řádu může být sice přílišným
zjednodušením procesu rozkladu a distribuce, vede
však v ideálním případě k hodnotám (rychlostní
konstantě nebo poločasu), které jsou snadno
srozumitelné a mají význam pro simulační
modelování a výpočet předpokládaných koncentrací
v životním prostředí. Empirický přístup nebo
lineární transformace mohou vést k lepšímu
proložení dat křivkami, a tedy k lepšímu odhadu
poločasů, hodnot DT
50
a popřípadě DT75
a DT90
.
Použití odvozených konstant však má své meze.
Složkové modely mohou poskytovat řadu užitečných
konstant, které jsou důležité pro posouzení
rizika a pro popis rozkladu chemické látky
v různých složkách a pro její distribuci. Použijí
se rovněž pro odhad rychlostních konstant tvorby
a rozkladu hlavních transformačních produktů. V
každém případě však musí být volba metody
odůvodněna a experimentátor by měl graficky nebo
statisticky prokázat její oprávněnost.XXIV.3.ZPRÁVY
XXIV.3.1 PROTOKOL O ZKOUŠCE
Protokol musí obsahovat následující informace:
Zkoušená látka:
— obecný název, chemický název, číslo CAS,
strukturní vzorec (s uvedením polohy
značícího nuklidu u látek značených
radionuklidy) a relevantní fyzikálně-chemické
vlastnosti;
— čistota zkoušené látky (obsah nečistot);
— popřípadě radiochemická čistota značené
chemické látky a molární aktivita.
Referenční látky:
— chemický název a struktura referenčních látek
použitých k charakterizaci a/nebo
identifikaci transformačního produktu.
Zkušební sedimenty a vody:
— lokalita a popis odběrového místa (odběrových
míst) sedimentu a vody, pokud možno včetně
dřívější kontaminace;
— všechny informace týkající se odběru,
případného skladování a aklimatizace systému
voda-sediment;
— charakteristiky vzorků systému voda-sediment,
jak jsou uvedeny v tabulce v oddílu 1.8.2.2.
Zkušební podmínky:
— použitý zkušební systém (např. průtokový
systém, biometrický systém, způsob
provzdušňování, způsob míchání, objem vody,
hmotnost sedimentu, tloušťka vrstvy vody i
sedimentu, rozměry zkušebních nádob atd.);
— aplikace zkoušené látky do systému: použitá
zkušební koncentrace, počet duplikátních
vzorků a kontrol, způsob aplikace zkoušené
látky (např. případné použití rozpouštědla)
atd.
— inkubační teplota;
— doby odběru;
— metody extrakce a účinnosti extrakce,
analytické metody a meze detekce;
— metody charakterizace/identifikace
transformačních produktů;
— odchylky od zkušebního postupu nebo
zkušebních podmínek.
Výsledky:
— původní číselná data reprezentativních analýz
(všechna původní data musí být uložena
v archivu vedeném podle zásad správné
laboratorní praxe);
— opakovatelnost a citlivost použitých
analytických metod;
— hodnoty výtěžnosti (hodnoty v % pro platnou
studii jsou uvedeny v oddíle 1.7.1);
— výsledky pro zkoušenou látku, popřípadě i pro
transformační produkty a neextrahovatelnou
radioaktivitu, zpracované v tabulkové formě a
vyjádřené v % aplikované dávky a v mgkg
1
pro
vodu, sediment a celý systém (pouze v %);— látková bilance během studií na jejich konci;
— grafické schéma transformace ve vodě a
sedimentu a v celém systému (včetně
mineralizace);
— rychlosti mineralizace;
— poločas, hodnoty DT
50
a popřípadě DT75
a DT90
pro zkoušenou látku, popřípadě i pro hlavní
transformační produkty, včetně intervalů
spolehlivosti, pro vodu, sediment a celý
systém;— charakteristika kinetiky transformace
zkoušené látky, popřípadě i hlavních
transformačních produktů;
— případný návrh způsobu transformace;
— diskuse o výsledcích.
XXIV.4.LITERATURA
(1) BBA-Guidelines for the examination of plant
protectors in the registration process.
(1990). Part IV, Section 5-1: Degradability
and fate of plant protectors in the
water/sediment system. Germany.
(2) Commission for registration of pesticides:
Application for registration of a pesticide.
(1991). Part G. Behaviour of the product and
its metabolites in soil, water and air,
Section G.2.1 (a). The Netherlands.
(3) MAFF Pesticides Safety Directorate. (1992).
Preliminary guideline for the conduct of
biodegradability tests on pesticides in
natural sediment/water systems. Ref No SC
9046. United Kingdom.
(4) Agriculture Canada: Environmental chemistry
and fate. (1987). Guidelines for registration
of pesticides in Canada. Aquatic (Laboratory)
–Anaerobic and aerobic. Canada. 35 – 37.
(5) US-EPA: Pesticide assessment guidelines,
Subdivision N. Chemistry: Environmental fate
(1982). Section 162 – 3, Anaerobic aquatic
metabolism.
(6) SETAC-Europe publication. (1995). Procedures
for assessing the environmental fate and
ecotoxicity of pesticides. Vyd. Dr. Mark R.
Lynch. SETAC-Europe, Brussels.
(7) OECD Test Guidelines Programme. (1995). Final
Report of the OECD Workshop on Selection of
Soils/sediments, Belgirate, Italy, 18. – 20.
ledna 1995.
(8) ISO 5667-12. (1995). Water quality – Sampling
– Part 12: Guidance on sampling of bottom
sediments, Technical Committee ISO/TC 146/SC
6.
(9) US-EPA (1998a). Sediment/water microcosm
biodegradation test. Harmonised Test
Guidelines (OPPTS 835.3180). EPA 712-C-98-
080.
(10) DFG: Pesticide Bound Residues in Soil.
Wiley-VCH (1998).
(11) T. R. Roberts: Non-extractable pesticide
residues in soils and plants. Pure Appl.
Chem. 56, 945-956 (IUPAC 1984).
(12) OECD Test Guideline 304A: Inherent
Biodegradability in Soil (přijato 12. května
1981).
(13) OECD (1993): Guidelines for Testing of
Chemicals. Paris. OECD (1994-2000): Addenda 6-
11 to Guidelines for the Testing of
Chemicals.
(14) Scholz, K., Fritz R., Anderson C.,
Spiteller M. (1988) Degradation of pesticides
in an aquatic model ecosystem. BCPC – Pests
and Diseases, 3B-4, 149 – 158.
(15) Guth, J. A. (1981). Experimental
approaches to studying the fate of pesticides
in soil. In: Progress in Pesticide
Biochemistry. Vyd. D. H. Hutson, T. R.
Roberts, J. Wiley & Sons, Vol. 1, 85 – 114.
(16) Madsen, T., Kristensen, P. (1997).
Effects of bacterial inoculation and non-
ionic surfactants on degradation of
polycyclic aromatic hydrocarbons in soil.
Environ. Toxicol. Chem. 16, 631 – 637.
(17) Steber, J., Wierich, P. (1987). The
anaerobic degradation of detergent range
fatty alcohol ethoxylates. Studies with 14C-
labelled model surfactants. Water Research
21, 661 – 667.
(18) Black, C. A. (1965). Methods of Soil
Analysis. Agronomy Monograph No. 9. American
Society of Agronomy, Madison.
(19) APHA (1989). Standard Methods for
Examination of Water and Wastewater
(17. vyd.). American Public Health
Association, American Water Works Association
and Water Pollution Control Federation,
Washington D.C.
(20) Rowell, D. L. (1994). Soil Science
Methods and Applications. Longman.
(21) Light, T. S. (1972). Standard solution
for redox potential measurements. Anal. Chem.
44, 1038 – 1039.
(22) SETAC-Europe publication (1991). Guidance
document on testing procedures for pesticides
in freshwater mesocosms. From the Workshop „A
Meeting of Experts on Guidelines for Static
Field Mesocosms Tests“, 3. – 4. června 1991.
(23) SETAC-Europe publication. (1993).
Guidance document on sediment toxicity tests
and bioassays for freshwater and marine
environments. From the Workshop „On Sediment
Toxicity Assessment (WOSTA)”, 8. –
10. listopadu 1993. Vyd. I. R. Hill, P.
Matthiessen, F. Heimbach.
(24) Vink, J. P. M., van der Zee,
S. E. A. T. M. (1997). Pesticide
biotransformation in surface waters:
multivariate analyses of environmental
factors at field sites. Water Research 31,
2858 – 2868.
(25) Vink, J. P. M., Schraa, G., van der Zee,
S. E. A. T. M. (1999). Nutrient effects on
microbial transformation of pesticides in
nitrifying waters. Environ. Toxicol, 329 –
338.
(26) Anderson, T. H., Domsch, K. H. (1985).
Maintenance carbon requirements of actively-
metabolising microbial populations under in-
situ conditions. Soil Biol. Biochem. 17, 197
– 203.
(27) ISO-14240-2. (1997). Soil quality –
Determination of soil microbial biomass –
Part 2: Fumigation-extraction method.
(28) Beelen, P. Van, F. Van Keulen. (1990),
The Kinetics of the Degradation of Chloroform
and Benzene in Anaerobic Sediment from the
River Rhine. Hydrobiol. Bull. 24 (1), 13 –
21.
(29) Shelton, D. R., Tiedje, J. M. (1984).
General method for determining anaerobic
biodegradation potential. App. Environ.
Microbiol. 47, 850 – 857.
(30) Birch, R. R., Biver, C., Campagna, R.,
Gledhill, W. E., Pagga, U., Steber, J.,
Reust, H., Bontinck, W. J. (1989). Screening
of chemicals for anaerobic biodegradation.
Chemosphere, 19, 1527 – 1550.
(31) Pagga, U., Beimborn, D. B. (1993).
Anaerobic biodegradation tests for organic
compounds. Chemosphere, 27, 1499 – 1509.
(32) Nuck, B. A., Federle, T. W. (1986). A
batch test for assessing the mineralisation
of 14C-radiolabelled compounds under
realistic anaerobic conditions. Environ. Sci.
Technol. 30, 3597 – 3603.
(33) US-EPA (1998b). Anaerobic
biodegradability of organic chemicals.
Harmonised Test Guidelines (OPPTS 835.3400).
EPA 712-C-98-090.
(34) Sijm, Haller, Schrap (1997). Influence of
storage on sediment characteristics and
drying sediment on sorption coefficients of
organic contaminants. Bulletin Environ.
Contam. Toxicol. 58, 961 – 968.
(35) Timme, G., Frehse, H., Laska, V. (1986)
Statistical interpretation and graphic
representation of the degradational behaviour
of pesticide residues II. Pflanzenschutz –
Nachrichten Bayer, 39, 187 – 203.
(36) Timme, G., Frehse, H. (1980) Statistical
interpretation and graphic representation of
the degradational behaviour of pesticide
residues I. Pflanzenschutz – Nachrichten
Bayer, 33, 47 – 60.
(37) Carlton, R.R., Allen, R. (1994). The use
of a compartment model for evaluating the
fate of pesticides in sediment/water systems.
Brighton Crop Protection Conference – Pest
and Diseases, 1349 – 1354.
DODATEK 1
POKYNY K AEROBNÍM A ANAEROBNÍM ZKUŠEBNÍM SYSTÉMŮM
Aerobní zkušební systém
Aerobní zkušební systém popsaný v této zkušební metodě se
skládá z aerobní vodní vrstvy (typická koncentrace
kyslíku v rozmezí od 7 do 10 mg*l
1
) a vrstvy sedimentu,
která je na povrchu aerobní a pod povrchem anaerobní
(typické průměrné oxidačně-redukční potenciály (Eh
)
v anaerobní zóně sedimentu jsou v rozmezí 80 až
190 mV). Nad vodní hladinu v každé inkubační jednotce se
zavádí zvlhčený vzduch, aby se v prostoru pod víčkem
udržovala dostatečná koncentrace kyslíku.Anaerobní zkušební systém
Pro anaerobní zkušební systém je zkušební postup
v podstatě tentýž, jako postup popsaný pro aerobní
systém, liší se však tím, že nad hladinu vody v každé
inkubační jednotce se zavádí zvlhčený dusík, aby se
udržovala jeho koncentrace v prostoru pod víčkem.
Sediment a voda jsou považovány za anaerobní, pokud je
oxidačně-redukční potenciál (E
h
) nižší 100 mV.
V anaerobní zkoušce se mineralizace posuzuje na základě
měření uvolněného oxidu uhličitého a methanu.DODATEK 2
PŘÍKLAD SKLENĚNÉ PRŮTOKOVÉ APARATURY
DODATEK 3
PŘÍKLAD BIOMETRICKÉ APARATURY
DODATEK 4
PŘÍKLAD VÝPOČTU DÁVKY APLIKOVANÉ DO ZKUŠEBNÍCH NÁDOB
---------------------------------------------------------------------- Vnitřní průměr válce: = 8 cm Výška vodního sloupce bez sedimentu: = 12 cm Plocha hladiny: 3,142 × 42 = 50,3 cm2Dávkování: 500 g zkoušené látky na ha odpovídá 5 µg/cm2Celkové množství v µg: 5 × 50,3 = 251,5 µg Přepočet celkového množství na hloubku 100 cm: 12 × 251,5 ÷ 100 = 30,18 µg Objem vodního sloupce: 50,3 × 12 = 603 ml Koncentrace ve vodě: 30,18 ÷ 603 = 0,050 µg/ml nebo 50 µg/l ----------------------------------------------------------------------